Вступ
Світова статистика останніх років свідчить про неухильний ріст захворюваності на цукровий діабет (ЦД) серед населення. Діабетична ретинопатія (ДР), одне з основних ускладнень цукрового діабету, займає одне з провідних місць серед відомих причин низького зору та сліпоти. Число випадків втрати зору в результаті цього ускладнення зберігає стійку тенденцію до постійного росту. Діабетична ретинопатія є однаково характерною як для інсулінозалежного, так і для інсулінонезалежного діабету.
Однією з основних причин зниження центрального зору в пацієнтів із діабетичною ретинопатією і цукровим діабетом 2-го типу (ЦД2) є діабетична макулопатія (ДМП) [1–4]. ДМП з можливим розвитком діабетичного макулярного набряку (ДМН) може відзначатися навіть у пацієнтів з початковими змінами на очному дні [5].
Основним симптомом ДМП є діабетичний макулярний набряк, що розвивається у 20 % пацієнтів після 10 років захворювання. Макулярний набряк може бути першим симптомом ДР або виникати на будь-якій стадії її розвитку [6].
Багаторічними дослідженнями встановлено, що ризик розвитку ДМН є вищим у пацієнтів із ЦД2 [7–9]. Згідно з результатами міжнародного дослідження WESDR, у пацієнтів із ЦД2 зі стажем захворювання до 5 років ДМН реєструють у 3 % випадків, а за тривалості 20 років і більше — у 28 %. Спостереження протягом 10 років показали, що ДМН проявляється в кожного четвертого пацієнта з ЦД2, який отримував ін’єкції інсуліну, і в 13,9 % пацієнтів, які отримували інші види цукрознижувальної терапії. Частота ДМН збільшується з прогресуванням ДР і сягає 70 % при проліферативній ДР (ПДР) [10–14].
У виникненні ДМН значну роль відіграють зміни задньої гіалоїдної мембрани (ЗГМ). Змінена ЗГМ перешкоджає метаболізму сітківки, викликає та підтримує набряк макули. Неповне самостійне відшарування скловидного тіла також може утворювати тангенціальні макулярні тракції, що пояснює стійкість ДМН до лазеркоагуляції й інтравітреальних ін’єкцій кортикостероїдів і анти-VEGF препаратів.
Для лікування тяжких і стійких до консервативного і лазерного методів лікування, а також анти-VEGF терапії та терапії глюкокортикостероїдами форм ДМП, а також при ДМП з формуванням епімакулярної мембрани та змінами внутрішньої пограничної мембрани сітківки (ВПМ), з наявністю вітреомакулярного синдрома, змінами скловидного тіла та макулярними крововиливами, ДМН з наявністю фіброваскулярних мембран сітківки та тракційним відшаруванням сітківки застосовують різні види сучасних вітреоретинальних втручань [15–21].
На превеликий жаль, виконання сучасних вітреоретинальних втручань у лікуванні ДМП призводить до виникнення інтраопераційних і післяопераційних ускладнень (геморагічні ускладнення, запальні реакції, офтальмогіпертензія, зміни центрального та периферичного поля зору), що багато в чому пов’язано з технікою хірургічного втручання [11, 16, 18, 22, 24].
Відомо, що навіть після виконання найсучасніших вітреоретинальних операцій можливий розвиток рецидивів ДМП і ДМН у найближчі та віддалені терміни спостереження. Є дані, що їх частота варіює від 6,6 до 20,8 % через 1 місяць та від 20,8 до 83,3 % через 1 рік після хірургічного лікування [22, 23].
Мета: дослідити профіль безпеки й ефективність різних сучасних вітреоретинальних втручань у лікуванні діабетичної макулопатії.
Матеріали та методи
Під нашим спостереженням перебували 313 хворих із ЦД2 (313 очей) з ДМП та початковою (I група; n = 40), помірною або тяжкою непроліферативною діабетичною ретинопатією (НПДР) (II група; n = 92) та проліферативною діабетичною ретинопатією (ПДР) (III група; n = 181).
Усім хворим були проведені офтальмологічні дослідження, що включали візометрію, статичну периметрію Humphrey, рефрактометрію, тонометрію, біомікроскопію, гоніоскопію, офтальмоскопію за допомогою асферичної лінзи Volk Super/Field (NC USA) і контактної тридзеркальної лінзи Гольдмана. Усім хворим виконували спектральнодоменну оптичну когерентну томографію (ОКТ) на приладі Optopoltechnology, SOCT, Copernicus REVO (протокол Retina3D, RetinaRaster) і ОКТ в режимі «Ангіо» (протокол RetinaAngio, ширина 6 × 6 мм). Під час дослідження застосовували вдосконалений алгоритм аналізу знімків ОКТ макулярної ділянки сітківки [16]. Також проводили дослідження очного дна на фундус-камері з його фотографуванням в 7 стандартних полях відповідно до модифікованої ETDRS системи клінічних ознак AirlieHouse. Флуоресцентну ангіографію виконували на апараті TOPCON TRS-NW7SF за показаннями (у разі підозри на початкову ретиновітреальну проліферацію чи неоваскуляризацію, яку не було ідентифіковано офтальмоскопічно і на фотографіях очного дна, а також у разі невідповідності зорових функцій офтальмоскопічним змінам у макулярній ділянці або даним ОКТ).
Ступінь тяжкості діабетичної ретинопатії та ДМП встановлювали відповідно до Міжнародної клінічної шкали діабетичної ретинопатії і діабетичної макулопатії Американської академії офтальмології (2002).
Критерії включення в дослідження: пацієнти з помірною та тяжкою НПДР, із прогресуючим зниженням центрального зору, змінами якості зору (метаморфопсії), з наявністю відносних (абсолютних) центральних скотом у зв’язку з резистентним ДМН та ДМП до лазерного лікування та анті-VEGF терапії (5 ін’єкцій афлібірцепту) та ЦД2; пацієнти з помірною та тяжкою НПДР з наявністю taut posterior hyaloid, ДМП та ДМН та ЦД2; пацієнти з помірною та тяжкою НПДР, ДМП з формуванням епімакулярної мембрани та змінами ВПМ та ЦД2; пацієнти з помірною та тяжкою НПДР, ДМП з наявністю тангенціальних або осьових тракцій сітківки (вітреомакулярний синдром) та ЦД2; пацієнти з помірною та тяжкою НПДР, ДМП та змінами скловидного тіла (деструкція, наслідок крововиливів) та ЦД2; пацієнти з частковим гемофтальмом, ДМП при ПДР, що є резистентними до консервативного лікування, та ЦД2; пацієнти з центральними преретинальними та субгіалоїдальними крововиливами, стійкими до консервативного та лазерного лікування, та ЦД2; пацієнти з ПДР, ДМП, ДМН з наявністю фіброваскулярних мембран сітківки та ризиком тракційного відшарування сітківки макулярної ділянки та ЦД2.
313 пацієнтів (313 очей), яким було проведене хірургічне лікування, становили 4 групи спостереження: 1-ша група — 78 пацієнтів (78 очей), яким виконали трипортову закриту субтотальну вітректомію 25+ (ЗСВ); 2-га група — 85 пацієнтів (85 очей), яким виконано ЗСВ і додатково проведено пілінг внутрішньої пограничної мембрани сітківки; 3-тя група — 81 пацієнт (81 око), яким виконали ЗСВ, пілінг ВПМ та додатково етап панретинальної лазеркоагуляції (ПРЛК); 4-та група — 69 пацієнтів (69 очей), яким виконали ЗСВ, пілінг ВПМ, етап ПРЛК та додатково факоемульсифікацію катаракти (ФЕК). Обсяг хірургічного лікування визначався за результатами детального офтальмологічного обстеження.
Ефективність різних видів вітреоретинальних втручань у лікуванні ДМП ми оцінювали за такими критеріями: підвищення максимальної коригованої гостроти зору (МКГЗ) у найближчі та віддалені терміни спостереження; зменшення центральної товщини сітківки (ЦТС) та макулярного об’єму (МО) у найближчі та віддалені терміни спостереження; частота рецидивів ДМП і ДМН у найближчі та віддалені терміни спостереження, а також досліджували характер і частоту операційних та післяопераційних ускладнень після різних видів вітреоретинальних втручань і вплив на них обсягу втручання.
Результати
При обстеженні пацієнтів 1-ї групи спостереження було виявлено, що ефективність лікування через 1 місяць після операції становила 67,9 %, через 3 місяці — 80,8 %, через 6 місяців — 76,9 % та через 1 рік — 76,0 %. Інтраопераційні ускладнення були геморагічними (мікрогеморагії, що становили 6,4 %, частковий гемофтальм — 2,6 %). У післяопераційному періоді відзначались геморагічні ускладнення, що становили 3,8 %, транзиторна гіпертензія — 12,8 % та запальні реакції — 10,3 %.
При обстеженні пацієнтів 2-ї групи спостереження було виявлено, що ефективність лікування через 1 місяць після операції становила 82,4 %, через 3 місяці — 82,4 %, через 6 місяців — 75,3 % та через 1 рік — 75,0 %. Інтраопераційні ускладнення були геморагічними (мікрогеморагії, що становили 7,05 %, частковий гемофтальм — 3,5 %). У післяопераційному періоді відзначались геморагічні ускладнення, що становили 5,9 %, транзиторна гіпертензія — 14,1 % та запальні реакції — 11,8 %. У пацієнтів 2-ї групи спостереження з’явились зміни у центральному полі зору — 5,9 %, зміни периферичного поля зору — 10,59 % та з’явились відносні периферичні скотоми — 9,41 %.
При обстеженні пацієнтів 3-ї групи спостереження було виявлено, що ефективність лікування через 1 місяць після операції становила 85,2 %, через 3 місяці — 85,2 %, через 6 місяців — 72,1 % та через 1 рік — 73,1 %. Інтраопераційні ускладнення були геморагічними (мікрогеморагії, що становили 6,17 %, частковий гемофтальм — 4,9 %). У післяопераційному періоді відзначались геморагічні ускладнення, що становили 3,7 %, транзиторна гіпертензія — 14,1 % та запальні реакції — 18,5 %. У пацієнтів 2-ї групи спостереження з’явились зміни у центральному полі зору — 4,94 %, зміни периферичного поля зору — 12,35 % та з’явились відносні периферичні скотоми — 18,52 %.
При обстеженні пацієнтів 4-ї групи спостереження було виявлено, що ефективність лікування через 1 місяць після операції становила 69,12 %, через 3 місяці — 78,26 %, через 6 місяців — 89,29 % та через 1 рік — 73,85 %. Інтраопераційні ускладнення були геморагічними (мікрогеморагії, що становили 5,8 %, частковий гемофтальм — 6,78 %). У післяопераційному періоді відзначались геморагічні ускладнення, що становили 5,7 %, транзиторна гіпертензія — 5,1 % та запальні реакції — 20,3 %, зміни центрального поля зору — 4,94 %, зміни периферичного поля зору — 11,48 %, відносні периферичні скотоми — 18,35 %.
У табл. 1 надана центральна товщина сітківки до операції, через 1, 3 і 6 місяців та 1 рік після ЗСВ (1-ша група) та ЗСВ з пілінгом ВПМ (2-га група).
Як видно з табл. 1, виконання ЗСВ без видалення ВПМ та з пілінгом ВПМ дозволило зменшити ЦТС за 1 і 3 місяці після операції (р < 0,05). Через 6 місяців і 1 рік після вітреоретинального втручання в обох групах спостереження відзначається збільшення ЦТС внаслідок розвитку рецидиву ДМН на деяких очах. При цьому ЦТС як через 6 місяців після хірургічного лікування, так і за рік була статистично значуще меншою порівняно з доопераційним рівнем.
Виконання ЗСВ без видалення ВПМ та з пілінгом ВПМ дозволило зменшити МО через 1 і 3 місяці після операції (р < 0,05). За 6 місяців і 1 рік після вітреоретинального втручання в обох групах спостереження відзначається збільшення МО внаслідок рецидиву ДМН, як і у випадку з ЦТС. При цьому МО як через 6 місяців після хірургічного лікування, так і за рік був статистично значуще меншим порівняно з доопераційним рівнем.
У табл. 2 надана МКГЗ через 1, 3 і 6 місяців та 1 рік після ЗСВ (1-ша група) та ЗСВ з пілінгом ВПМ (2-га група) (у відсотках, Р ± m).
Як видно з табл. 2, застосування обох методів вітреоретинального втручання дозволило підвищити МКГЗ в післяопераційному періоді у статистично значущій більшості випадків, що зафіксовано в усі терміни спостереження.
Привертає увагу той факт, що на 10 очах (11,76 %) пацієнтів 2-ї групи за рік після виконання ЗСВ з пілінгом ВПМ відзначалось погіршення зорових функцій (центрального та периферичного зору), а також при офтальмоскопії та за допомогою ОСТ були виявлені ознаки атрофії зорового нерва. При цьому ознак рецидиву ДМП на цих очах не помічено.
І в 1-й, і в 2-й групі спостереження за 1 місяць після вітреоретинального втручання було констатовано зменшення дрібних твердих ексудатів, геморагій, а також зафіксована резорбція ДМН.
Слід зазначити, що на 6-му місяці спостереження в обох групах зросло число пацієнтів зі зниженням МКГЗ, що ми пов’язуємо, зокрема, із прогресуючими клінічними проявами ДМП і ДМН. При цьому в 1-й групі спостереження, у якій пілінг ВПМ не проводили, МКГЗ коливалась від 0,1 до 0,8 (в середньому 0,55 ± 0,09), а у 2-й групі спостереження, у якій пілінг ВПМ проводили, МКГЗ коливалась від 0,09 до 0,4 (в середньому 0,3 ± 0,06), тобто була статистично нижчою порівняно з 1-ю групою (р < 0,001). Зниження МКГЗ за 6 місяців після вітреоретинального втручання без рецидиву ДМП і ДМН в 2-й групі становило 5,9 % випадків (5 очей).
За 6 місяців після хірургічного втручання також було встановлено концентричне звуження меж поля зору до 5–10° переважно у назальних меридіанах в 2-й групі спостереження у 11,8 % випадків (10 очей) та наявність центральних і парацентральних відносних скотом у 5,9 % випадків (5 очей) без наявності рецидивів ДМП і ДМН.
Привертає увагу той факт, що за рік після виконання ЗСВ та ЗСВ з пілінгом ВПМ трохи зменшились ЦТС та МО, що, на нашу думку, пов’язано з регресом частини рецидивів ДМП. Також в обох групах спостереження відзначалось підвищення МКГЗ.
У табл. 3 надана ЦТС до операції, через 1, 3 і 6 місяців та 1 рік після ЗСВ з пілінгом ВПМ (2-га група) та ЗСВ з пілінгом ВПМ і етапом ПРЛК (3-тя група).
Як видно з табл. 3, виконання ЗСВ з пілінгом ВПМ та ЗСВ з пілінгом ВПМ і етапом ПРЛК дозволило зменшити ЦТС вже за 1 і 3 місяці після операції (р < 0,05). Через 6 місяців і 1 рік після вітреоретинального втручання в обох групах спостереження відзначалося збільшення ЦТС внаслідок розвитку рецидиву ДМН на деяких очах. При цьому ЦТС як через 6 місяців після хірургічного лікування, так і за рік була статистично значуще меншою порівняно з доопераційним рівнем.
Виконання ЗСВ з пілінгом ВПМ та ЗСВ з пілінгом ВПМ і етапом ПРЛК дозволило зменшити МО вже за 1 і 3 місяці після операції (р < 0,05). Через 6 місяців після вітреоретинального втручання в обох групах спостереження відзначалось збільшення МО внаслідок рецидиву ДМН, як і у випадку з ЦТС. При цьому МО як через 6 місяців після хірургічного лікування, так і за рік був статистично значуще меншим порівняно з доопераційним рівнем.
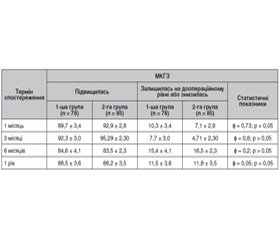
У табл. 4 надана МКГЗ через 1, 3 і 6 місяців та 1 рік після ЗСВ з пілінгом ВПМ (2-га група) та ЗСВ з пілінгом ВПМ і етапом ПРЛК (3-тя група).
Дослідження зорових функцій показало, що в 2-й групі спостереження МКГЗ підвищилась порівняно з доопераційним рівнем у 82,3 % пацієнтів, а в 3-й — у 83,3 %. Привертає увагу той факт, що за такого обсягу проведеного дослідження частота концентричного звуження полів зору в 3-й групі спостереження (ЗСВ з пілінгом ВПМ і етапом ПРЛК) була статистично значуще вищою. В обох групах за 1 місяць після вітреоретинального втручання відзначався регрес ДМП, а також резорбція ДМН.
На 6-му місяці спостереження в обох групах зросло число пацієнтів зі зниженням ЦКГЗ, що, на нашу думку, пов’язано з прогресуючими клінічними проявами ДМП і ДМН у 10,6 % випадків у 2-й групі і в 9,87 % випадків — у 3-й. У 5,9 % випадків (5 очей) серед пацієнтів 2-ї групи та у 4,94 % випадків (4 ока) серед пацієнтів 3-ї групи зниження ЦКГЗ відбувалось без ознак рецидиву ДМП і ДМН.
При дослідженні МКГЗ за рік після оперативного втручання зафіксовано підвищення цього показника у 82,3 % пацієнтів 2-ї групи та у 83,3 % пацієнтів 3-ї групи (p > 0,05).
При дослідженні поля зору в пацієнтів обох груп через 6 місяців після втручання відзначене концентричне звуження у 10,59 % (9 очей) в 2-й групі та в 12,35 % (10 очей) у 3-й; центральні та парацентральні відносні скотоми виявлені у 5,88 % (5 очей) і у 4,94 % випадків (4 ока) відповідно, а відносні периферичні скотоми — у 9,41 % (8 очей) і у 18,52 % (15 очей) випадків відповідно.
Слід зазначити, що на 6-му місяці спостереження частота появи периферичних скотом у 3-й групі, де додатково виконували ПРЛК, була статистично вищою, ніж у 2-й групі (р < 0,05). Через 1 рік була зафіксована статистично значуще більша частота концентричного звуження полів зору та відносних і абсолютних скотом у 3-й групі спостереження, ніж у 2-й.
У табл. 5 надана ЦТС до операції, через 1, 3 і 6 місяців та 1 рік після ЗСВ з пілінгом ВПМ і етапом ПРЛК (3-тя група) та ЗСВ з пілінгом ВПМ, етапом ПРЛК і ФЕК (4-та група).
Як видно з табл. 5, виконання ЗСВ з пілінгом ВПМ і етапом ПРЛК (3-тя група) та ЗСВ з пілінгом ВПМ, етапом ПРЛК і ФЕК дозволило зменшити ЦТС через 1 і 3 місяці після операції (р < 0,05). При цьому необхідно відзначити, що, незважаючи на статистично значуще зменшення середнього значення показника через 1 місяць після операції в обох групах, ЦТС у 4-й групі була значно вищою. Це стало наслідком особливостей техніки втручання. Через 6 місяців та 1 рік після хірургічного втручання в обох групах спостереження відзначалось збільшення ЦТС внаслідок розвитку рецидиву ДМН на деяких очах. При цьому ЦТС як через 6 місяців після хірургічного лікування, так і за рік була статистично значуще меншою порівняно з доопераційним рівнем.
Виконання ЗСВ з пілінгом ВПМ і етапом ПРЛК та ЗСВ з пілінгом ВПМ, етапом ПРЛК і ФЕК дозволило зменшити МО через 1 і 3 місяці після операції (р < 0,05). Через 6 місяців і 1 рік після вітреоретинального втручання в обох групах спостереження відзначалось збільшення МО внаслідок рецидиву ДМН, як і у випадку з ЦТС. При цьому МО як через 6 місяців після хірургічного лікування, так і за рік був статистично значуще меншим порівняно з доопераційним рівнем.
У табл. 6 надана МКГЗ через 1, 3 і 6 місяців та 1 рік після ЗСВ з пілінгом ВПМ і етапом ПРЛК (3-тя група) та ЗСВ з пілінгом ВПМ, етапом ПРЛК і ФЕК (4-та група).
У табл. 7 надана частота рецидивів ДМП за методами лікування в динаміці спостереження (за всіма групами пацієнтів). За методами лікування частота рецидивів на різних термінах спостереження суттєво не відрізнялась від загальної тенденції. Через 1 місяць частішими відзначені рецидиви в пацієнтів, яким виконували ЗСВ з пілінгом ВПМ, ПРЛК і ФЕК, — 31,9 % (р = 0,025). Через 1 і 3 місяці мінімальна кількість рецидивів була зафіксована в пацієнтів, яким виконували ЗСВ з пілінгом ВПМ і ПРЛК (по 14,8 %); через 3 місяці і 1 рік частота рецидивів за методами лікування загалом не відрізнялась.
Найбільш небезпечними рецидивами ми вважали пізні, тобто ті, що виникали за 6 місяців та за рік після операції, оскільки вони були стійкими і вже не коригувалися подальшим лікуванням. Ранні рецидиви мали тенденцію до зникнення, тобто були перехідними.
У дослідженні ми простежили, як саме розподілялися рецидиви ДМП після хірургічного лікування залежно від терміну їх появи.
На підставі клінічного спостереження та аналізу всі рецидиви ми поділили на три види: ранні перехідні — ті, що виникали на 1–3-му місяці та згодом зникали; ранні стійкі — ті, що виникали на 1–3-му місяці та потім залишалися і були зафіксовані на 6-му місяці і 1-му році спостереження; пізні — ті, що виникали через 6 місяців і 1 рік.
Аналіз у такому розрізі показав деякі відмінності між застосованими методами хірургічного лікування ДМП. Ранні перехідні рецидиви становили 6,4, 2,4, 1,2 та 7,3 % відповідно та статистично не відрізнялись (χ2 = 5,081; p = 0,166). Зокрема, найбільш частими виявилися ранні стійкі рецидиви, які за різними методами лікування становили від 16,1 до 25,6 %. Пізніх ускладнень не виявлено в пацієнтів, яким було виконано ЗСВ та ЗСВ з пілінгом ВПМ, ПРЛК і ФЕК. В останньому випадку різниця між групами є статистично значущою (χ2 = 15,639; р = 0,001). Отже, при виконанні ЗСВ, а також при виконанні ЗСВ з пілінгом ВПМ, ПРЛК і ФЕК всі рецидиви були ранніми, більшість із них (77,3 і 80,0 %) мала стійкий характер. При виконанні ЗСВ з пілінгом ВПМ, а також при виконанні ЗСВ з пілінгом ВПМ і ПРЛК більшість рецидивів були ранніми стійкими та пізніми (91,3 та 95,7 %).
Проведений аналіз результатів застосування ЗСВ і ЗСВ з пілінгом ВПМ показав їх високу ефективність і безпечність на всіх термінах спостереження.
Частота рецидивів ДМП і ДМН в обох групах спостереження за 1, 3, 6 місяців та за 1 рік не відрізнялась. За нашими даними, пілінг ВПМ не забезпечував переваг в плані профілактики рецидивів ДМН, але показав гірші функціональні результати за такого обсягу досліджень у віддалені терміни спостереження.
Обговорення
Наші результати щодо зниження МКГЗ і змін периферичного зору після проведення ЗСВ з пілінгом ВПМ на очах, де операція була виконана в повному обсягу, а також щодо частоти і характеру операційних і післяопераційних ускладнень, рецидивів ДМП узгоджувалися з даними інших дослідників [2, 11, 21–24]. Концентричне звуження полів зору і поява периферичних скотом у низці випадків пов’язані і з операційною травмою, і з впливом газо-повітряної тампонади вітреальної порожнини ока. В літературі є дані про наявність так званої деформації зсуву шарів сітківки відносно одне одного при видаленні ВПМ, видаленні задньої гіалоїдної мембрани і епіретинального фіброзу. Це призводить до значно більшого пошкодження структур сітківки і зорового нерва, ніж у точці хірургічного впливу. Це багато в чому пояснює наявність значних дефектів поля зору в результаті мінімального хірургічного впливу при таких втручаннях, як ЗСВ та ЗСВ з пілінгом ВПМ. Також є дані, що свідчать про витончення темпоральної і потовщення назальної частини макули після видалення ВПМ, а також про зменшення товщини сітківки та витончення нейроепітелію в фовеа, що пояснює низьку гостроту зору після операції [16, 25]. Загалом доцільність виконання пілінгу сітківки, показання для цього, розмір видаленої частини ВПМ як етапу вітректомії при лікуванні ДМП і ДМН потребують ретельного вивчення. Видалення навіть невеликої (2–3,5 мм) частки ВПМ може призвести до необоротних процесів в сітчастій оболонці, яка і без цього перебуває в стані хронічної ішемії і гіпоксії при ДР і ЦД2. Відомо, що одним із чотирьох елементів ВПМ є плазматична мембрана мюллерівських, а також інших гліальних клітин сітківки, яка найбільшої товщини набуває саме в макулі [11]. Клітини Мюллера є найбільшими клітинами сітківки; вони розташовані від зовнішньої до внутрішньої пограничної мембрани. Клітини Мюллера мають високу метаболічну активність, забезпечують постачання нейронам сітківки продуктів розпаду глікогену, виведення продуктів обміну нейронів, захищають нейрони від надлишкового вивільнення нейромедіаторів, здійснюють фагоцитоз продуктів розпаду при патологічних станах, синтез ретиноїдної кислоти з ретинолу, захист нейронів шляхом контролю гомеостазу іонів. Гліальні клітини беруть участь у процесах регенерації сітківки при її пошкодженнях, в тому числі при ДР і ДМП [11, 26]. З огляду на вищевикладене ми вважаємо, що пілінг ВПМ у пацієнтів з ДР і ДМП можна виконувати лише в виняткових випадках і за суворими показаннями. Видалення навіть обмеженої ділянки ВПМ призводить до пошкодження відростків мюллерівських та інших гліальних клітин, що призводить до зниження зорових функцій у післяопераційному періоді без змін на очному дні. Це призводить до двох протилежних результатів: задоволеності вітреоретинального хірурга анатомічним результатом і незадоволеності пацієнта отриманими зоровими функціями.
Встановлена висока ефективність методу ЗСВ з пілінгом ВПМ та одночасним виконанням етапу ПРЛК при лікуванні ДМП. Додаткове виконання ПРЛК дозволило значно зменшити товщину сітківки в макулярній ділянці та макулярний об’єм у терміни спостереження 1, 3 і 6 місяців порівняно з групою, де етап ПРЛК не виконували. При цьому слід зазначити, що МКГЗ в обох групах не відрізнялася. За 1 рік спостереження ці показники не відрізнялись від результатів групи, в якій ПРЛК не виконували. При обстеженні пацієнтів групи, в якій виконували етап ПРЛК, у всі терміни спостереження була відзначена поява центральних, парацентральних і периферичних скотом. На нашу думку, суттєво велика частота периферичних скотом в усі терміни спостереження була пов’язана з виконанням і впливом лазерного опромінювання на структури сітківки. Слід зазначити, що пригнічення функції периферичних відділів сітківки, що визначають за допомогою статичної периметрії Humphrey, за локалізацією загалом збігалося із зонами виконаної ПРЛК. Частка цих пацієнтів скаржилася на звуження меж поля зору, а також на порушення сутінкового зору. Ці дані збігаються з даними різних наукових джерел [1, 11, 20, 24]. На наш погляд, виконання ПРЛК як етапу комбінованого лікування ДМП не дає особливих переваг порівняно з виконанням тільки ЗСВ або ЗСВ з пілінгом ВПМ, якщо йдеться про клінічні прояви ДМП і резорбції ДМН або про підвищення МКГЗ на всіх термінах спостереження. Ми також вважаємо, що виконання ПРЛК під час ЗСВ може бути фактором ризику розвитку додаткових дефектів поля зору. Можливо, більш правильно було б виконувати під час операції тільки обмежену ендолазеркоагуляцію за суворими показаннями, а основний етап ПРЛК — в післяопераційному періоді кваліфікованим лазерним хірургом з можливим застосуванням нових лазерних технологій.
Аналіз результатів комбінованого хірургічного лікування ДМП, що включало ЗСВ з пілінгом ВПМ, етап ПРЛК і ФЕК, показав, що через 1, 3, 6 місяців і за 1 рік після втручання статистично значуще зменшилась частота ДМН та інших проявів ДМП. Привертає увагу той факт, що при комбінації ЗСВ, пілінгу ВПМ і ПРЛК частота ДМН через 1 місяць зменшилася до 14,8 %, а при поєднанні цих методів із ФЕК — тільки до 31,88 %, через 3 місяці — до 14,8 і 21,74 % відповідно. На нашу думку, це пов’язано з особливостями техніки виконання процедури ФЕК, яка, навіть віртуозно виконана, подовжує час оперативного втручання, викликає перепади внутрішньоочного тиску, може посилювати запальну реакцію в післяопераційному періоді. Не можна відкидати те, що ці фактори, а також вплив ультразвуку і збільшення об’єму рідини, яка циркулює в оці під час ФЕК, чинять негативний вплив на макулярну ділянку сітківки і можуть підтримувати її набряк, а можливо, навіть посилювати його в ранні терміни після операції. Підсумовуючи результати цього етапу нашого дослідження, ми доходимо висновку, що ефективність усіх досліджуваних методів вітреоретинальних втручань у віддалені терміни спостереження (1 рік) статистично не відрізнялась і становила 76,0, 75,0, 73,1 та 73,5 % відповідно за групами спостереження.
Висновки
1. Застосування сучасних вітреоретинальних втручань в лікуванні ДМП і ДМН є ефективним через 1 місяць у 60,7, 82,4, 85,2 та 68,12 %, а через 1 рік — у 76,0, 75,0, 73,1 та 73,5 % відповідно.
2. Частота рецидивів ДМП через 1 рік після вітреоретинальних втручань становила 24,0–27,0 % і не залежала від їх модифікації. Ефективність лікування ДМП залежала від стадії ДР і становила 72,5 % при початковій НПДР, 77,2 % при вираженій і тяжкій НПДР та 66,3 % при ПДР.
3. Виконання всіх етапів хірургічного втручання повинно бути суворо обґрунтованим. Необхідно завжди враховувати ризики впливу кожного з етапів втручання для отримання оптимальних функціональних результатів, особливо у віддалені терміни спостереження.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Дослідження проведене на базі Національного університету охорони здоров’я України імені П.Л. Шупика в рамках НДР «Клінічне та експериментальне обґрунтування діагностики, лікування та профілактики рефракційних, дистрофічних, травматичних і запальних захворювань органа зору», номер державної реєстрації 0116U002821.
Отримано/Received 20.04.2021
Рецензовано/Revised 26.04.2021
Прийнято до друку/Accepted 05.05.2021

/59.jpg)
/60.jpg)
/61.jpg)
/62.jpg)