Журнал «Здоровье ребенка» Том 16, №6, 2021
Вернуться к номеру
Регуляція вмісту мікроРНК. Частина 3. Циркадні механізми. Однонуклеотидні поліморфізми генів мікроРНК
Авторы: Абатуров О.Є., Бабич В.Л.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В науковому огляді наведений процес регуляції вмісту мікроРНК — асоціація активності експресії мікроРНК із циркадними ритмами функціонування організму та залежність від наявності однонуклеотидних поліморфізмів генів. Для написання статті виконувався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. У статті надана характеристика молекулярної архітектури циркадних годинників ссавців, що обумовлені дією зміни дня і ночі, світла і темряви. Зазначено, що порушення циркадних ритмів організму асоційоване з розвитком ожиріння, цукрового діабету, депресії, серцево-судинної патології та пухлин. Також відомо, що порушення циркадного ритму активності функцій печінки призводить до розвитку метаболічних розладів і, зокрема, до виникнення неалкогольної жирової хвороби печінки, діабету й ожиріння. Зазначено, що мікроРНК є факторами, що визначають функціонування механізмів циркадного ритму, а експресія деяких з них високозалежна від часу доби. У статті відображено, що на сьогодні ідентифіковано більш ніж 240 однонуклеотидних поліморфізмів генів і рідкісних мутацій в прі-, пре- і зрілих мікроРНК-послідовностях. Відомо, що однонуклеотидні поліморфізми генів першої групи (прі- і пре-мікроРНК) перешкоджають звичайному процесу матурації мікроРНК. Однонуклеотидні поліморфізми генів другої групи (seed-ділянки) призводять до порушення взаємодії мікроРНК з мРНК-мішенями. Встановлена асоціація між генетичними поліморфізмами мікроРНК та різними захворюваннями людини, в тому числі з хворобами гепатобіліарної системи. Таким чином, активність експресії мікроРНК визначає функціонування механізмів циркадного ритму організму ссавців, а експресія деяких з них високозалежна від часу доби. Звичайному процесу матурації мікроРНК перешкоджають однонуклеотидні поліморфізми генів першої групи (прі- і пре-мікроРНК). До порушення взаємодії мікроРНК з мРНК-мішенями призводять однонуклеотидні поліморфізми генів другої групи. Порушення циркадних ритмів і генетичні поліморфізми мікроРНК асоційовані з розвитком різних патологічних станів та захворювань людини, в тому числі захворювань гепатобіліарної системи.
The scientific review presents the process of regulation of miRNA content — the association of miRNA expression activity with circadian rhythms of organism functioning and the dependence on the presence of single nucleotide gene polymorphisms. To write the article, information was searched using databases Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. The article presents the characteristics of the molecular architecture of circadian clocks of mammals, which are due to the action of day and night, light and darkness. It is stated that the violation of circadian rhythms of the organism is associated with the development of obesity, diabetes, depression, cardiovascular pathology, and tumors. It is also known that the violation of the circadian rhythm of liver function leads to the development of metabolic disorders and, in particular, the emergence of non-alcoholic fatty liver disease, diabetes, and obesity. It is emphasized that microRNAs are factors that determine the functioning of circadian rhythm mechanisms, and the expression of some of them is highly dependent on the time of day. The article shows that to date, more than 240 single-nucleotide polymorphisms of genes and rare mutations in pri-, pre- and mature miRNA sequences have been identified. It is known that single nucleotide polymorphisms of genes of the first group (pri- and pre-microRNAs) interfere with the normal process of maturation of microRNAs. Single-nucleotide polymorphisms of genes of the second group (“seed” region) lead to disruption of the interaction of microRNAs with target mRNAs. An association between microRNA genetic polymorphisms and various human diseases, including diseases of the hepatobiliary system, has been established. Thus, the activity of miRNA expression determines the functioning of the mechanisms of the circadian rhythm of the mammalian organism, and the expression of some of them is highly dependent on the time of day. The normal process of maturation of miRNAs is hindered by single nucleotide polymorphisms of genes of the first group (pri- and pre-miRNAs). Single nucleotide polymorphisms of genes of the second group lead to disruption of interaction of miRNA with mRNA targets. Circadian rhythm disorders and genetic microRNA polymorphisms are associated with the development of various pathological conditions and human diseases, including diseases of the hepatobiliary system.
мікроРНК; циркадні механізми; однонуклеотидні поліморфізми генів мікроРНК; огляд
microRNA; circadian mechanisms; single nucleotide polymorphisms of microRNA genes; review
Вступ
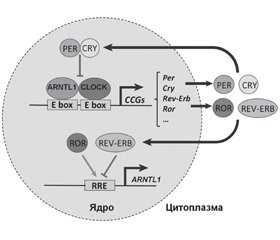
Циркадні механізми
Однонуклеотидні поліморфізми генів мікроРНК
Висновки
- Aitken S., Semple C.A. The circadian dynamics of small nucleolar RNA in the mouse liver. J. R. Soc. Interface. 2017 May. 14(130). pii: 20170034. doi: 10.1098/rsif.2017.0034.
- Biaoxue R., Xiguang C., Shuanying Y. Annexin A1 in malignant tumors: current opinions and controversies. Int. J. Biol. Markers. 2014 Mar 24. 29(1). e8-20. doi: 10.5301/jbm.5000046.
- Buhr E.D., Takahashi J.S. Molecular components of the Mammalian circadian clock. Handb. Exp. Pharmacol. 2013. (217). 3-27. doi: 10.1007/978-3-642-25950-0_1.
- Cai Y., Yu X., Hu S., Yu J. A brief review on the mechanisms of miRNA regulation. Genomics Proteomics Bioinformatics. 2009 Dec. 7(4). 147-54. doi: 10.1016/S1672-0229(08)60044-3.
- Cammaerts S., Strazisar M., De Rijk P., Del Favero J. Genetic variants in microRNA genes: impact on microRNA expression, function, and disease. Front. Genet. 2015 May 21. 6. 186. doi: 10.3389/fgene.2015.00186.
- Cao X., Yang Y., Selby Ch.P., Liu Z., Sancar A. Molecular mechanism of the repressive phase of the mammalian circadian clock. Proceedings of the National Academy of Sciences. Jan 2021. 118(2). e2021174118. doi: 10.1073/pnas.2021174118.
- Chinnapaiyan S., Dutta R.K., Devadoss D., Chand H.S., Rahman I., Unwalla H.J. Role of Non-Coding RNAs in Lung Circadian Clock Related Diseases. International Journal of Molecular Sciences. 2020. 21(8). 3013. https://doi.org/10.3390/ijms21083013.
- Ding L., Xiao X.-H. Gut microbiota: closely tied to the regulation of circadian clock in the development of type 2 diabetes mellitus. Chinese Medical Journal. 2020. 133(7). 817-825. doi: 10.1097/CM9.0000000000000702.
- Du N.H., Arpat A.B., De Matos M., Gatfield D. MicroRNAs shape circadian hepatic gene expression on a transcriptome-wide scale. Elife. 2014 May 27. 3. e02510. doi: 10.7554/eLife.02510.
- Gardiner L.-J., Rusholme-Pilcher R., Colmer J., Rees H., Crescente J.M. еt al. Interpreting machine learning models to investigate circadian regulation and facilitate exploration of clock function. bioRxiv. 2021. 02.04. 429826. https://doi.org/10.1101/2021.02.04.429826
- Gatfield D., Le Martelot G., Vejnar C.E. et al Integration of microRNA miR-122 in hepatic circadian gene expression. Genes Dev. 2009 Jun 1. 23(11). 1313-26. doi: 10.1101/gad.1781009.
- Gaucher J., Montellier E., Sassone-Corsi P. Molecular Cogs: Interplay between Circadian Clock and Cell Cycle. Trends Cell Biol. 2018 May. 28(5). 368-379. doi: 10.1016/j.tcb.2018.01.006.
- Gong J., Tong Y., Zhang H.M. et al. Genome-wide identification of SNPs in microRNA genes and the SNP effects on microRNA target binding and biogenesis. Hum. Mutat. 2012 Jan. 33(1). 254-63. doi: 10.1002/humu.21641.
- Hu Q., Song J., Ding B. et al miR-146a promotes cervical cancer cell viability via targeting IRAK1 and TRAF6. Oncol. Rep. 2018 Jun. 39(6). 3015-3024. doi: 10.3892/or.2018.6391.
- Kinoshita C., Okamoto Y., Aoyama K., Nakaki T. MicroRNA: A Key Player for the Interplay of Circadian Rhythm Abnormalities, Sleep Disorders and Neurodegenerative Diseases. Clocks & Sleep. 2020. 2(3). 282-307. https://doi.org/10.3390/clockssleep2030022
- Króliczewski J., Sobolewska A., Lejnowski D. et al MicroRNA single polynucleotide polymorphism influences on microRNA bioge–nesis and mRNA target specificity. Gene. 2018 Jan 15. 640. 66-72. doi: 10.1016/j.gene.2017.10.021.
- Lamia K.A., Papp S.J., Yu R.T. et al Cryptochromes mediate rhythmic repression of the glucocorticoid receptor. Nature. 2011 Dec 14. 480(7378). 552-6. doi: 10.1038/nature10700.
- Li X.D., Li Z.G., Song X.X., Liu C.F. A variant in microRNA-196a2 is associated with susceptibility to hepatocellular carcinoma in Chinese patients with cirrhosis. Pathology. 2010 Dec. 42(7). 669-73. doi: 10.3109/00313025.2010.522175.
- Liu Y., Ren F., Luo Y. et al Down-Regulation of MiR-193a-3p Dictates Deterioration of HCC: A Clinical Real-Time qRT-PCR Study. Med. Sci. Monit. 2015 Aug 11. 21. 2352-60. doi: 10.12659/MSM.894077.
- Marcheva B., Ramsey K.M., Buhr E.D. et al Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes. Nature. 2010 Jul 29. 466(7306). 627-31. doi: 10.1038/nature09253.
- Mazzoccoli G., De Cosmo S., Mazza T. The Biological Clock: A Pivotal Hub in Non-alcoholic Fatty Liver Disease Pathogenesis. Front. Physiol. 2018 Mar 15. 9. 193. doi: 10.3389/fphys.2018.00193.
- Mendoza-Viveros L., Bouchard-Cannon P., Hegazi S. et al Molecular modulators of the circadian clock: lessons from flies and mice. Cell. Mol. Life Sci. 2017 Mar. 74(6). 1035-1059. doi: 10.1007/s00018-016-2378-8.
- Na Y.J., Sung J.H., Lee S.C. et al. Comprehensive analysis of microRNA-mRNA co-expression in circadian rhythm. Exp. Mol. Med. 2009 Sep 30. 41(9). 638-47. doi: 10.3858/emm.2009.41.9.070.
- Oyama Y., Bartman C.M., Gile J., Eckle T. Circadian MicroRNAs in Cardioprotection. Curr. Pharm. Des. 2017. 23(25). 3723-3730. doi: 10.2174/1381612823666170707165319.
- Peng Q., Li S., Lao X. et al The association of common functional polymorphisms in mir-146a and mir-196a2 and hepatocellular carcinoma risk: evidence from a meta-analysis. Medicine (Baltimore). 2014 Dec. 93(29). e252. doi: 10.1097/MD.0000000000000252.
- Qu Y., Zhang Y., Wang K., Song C., Wang P., Ye H., Zhang J., Dai L. Single Nucleotide Polymorphisms in MicroRNA-Binding Site of Epidermal Growth Factor Receptor Signaling Pathway and Susceptibility to Esophageal Squamous Cell Carcinoma. Digestive Diseases. 2020. 38. 1-8. doi: 10.1159/000501447.
- Renström F., Koivula R.W., Varga T.V. et al. Season-dependent associations of circadian rhythm-regulating loci (CRY1, CRY2 and MTNR1B) and glucose homeostasis: the GLACIER Study. Diabetologia. 2015 May. 58(5). 997-1005. doi: 10.1007/s00125-015-3533-8.
- Sato F., Kohsaka A., Bhawal U.K., Muragaki Y. Potential Roles of Dec and Bmal1 Genes in Interconnecting Circadian Clock and Energy Metabolism. Int. J. Mol. Sci. 2018 Mar 8. 19(3). pii: E781. doi: 10.3390/ijms19030781.
- Shende V.R., Goldrick M.M., Ramani S., Earnest D.J. Expression and rhythmic modulation of circulating microRNAs targeting the clock gene Bmal1 in mice. PLoS One. 2011. 6(7). e22586. doi: 10.1371/journal.pone.0022586.
- Shimba S., Ogawa T., Hitosugi S. et al. Deficient of a clock gene, brain and muscle Arnt-like protein-1 (BMAL1), induces dyslipidemia and ectopic fat formation. PLoS One. 2011. 6(9). e25231. doi: 10.1371/journal.pone.0025231.
- Solt L.A., Kojetin D.J., Burris T.P. The REV-ERBs and RORs: molecular links between circadian rhythms and lipid homeostasis. Future Med. Chem. 2011 Apr. 3(5). 623-38. doi: 10.4155/fmc.11.9.
- Srivastava K., Tyagi K. Single nucleotide polymorphisms of microRNA in cardiovascular diseases. Clin. Chim. Acta. 2018 Mar. 478. 101-110. doi: 10.1016/j.cca.2017.12.037.
- Takahashi J.S. Transcriptional architecture of the mammalian circadian clock. Nat. Rev. Genet. 2017 Mar. 18(3). 164-179. doi: 10.1038/nrg.2016.150.
- Wang H., Fan Z., Zhao M. et al Oscillating primary transcripts harbor miRNAs with circadian functions. Sci. Rep. 2016 Feb 22. 6. 21598. doi: 10.1038/srep21598.
- Wang J., Symul L., Yeung J. et al. Circadian clock-dependent and -independent posttranscriptional regulation underlies temporal mRNA accumulation in mouse liver. Proc. Natl. Acad. Sci. U S A. 2018 Feb 20. 115(8). E1916-E1925. doi: 10.1073/pnas.1715225115.
- Wang X., Gu H., Qin D. et al Exosomal miR-223 Contributes to Mesenchymal Stem Cell-Elicited Cardioprotection in Polymicrobial Sepsis. Sci. Rep. 2015 Sep 8. 5. 13721. doi: 10.1038/srep13721.
- Xu Y., Li L., Xiang X. et al. Three common functional polymorphisms in microRNA encoding genes in the susceptibility to hepatocellular carcinoma: a systematic review and meta-analysis. Gene. 2013 Sep 25. 527(2). 584-93. doi: 10.1016/j.gene.2013.05.085.
- Yu J.Y., Hu F., Du W. et al. Study of the association between five polymorphisms and risk of hepatocellular carcinoma: A meta-analysis. J. Chin. Med. Assoc. 2017 Apr. 80(4). 191-203. doi: 10.1016/j.jcma.2016.09.009.
- Zhao S., Liu M.F. Mechanisms of microRNA-mediated gene regulation. Sci. China Life Sci. 2009 Dec. 52(12). 1111-6. doi: 10.1007/s11427-009-0152-y.
- Zhou L., Miller C., Miraglia L.J., Romero A., Mure L.S., Panda S., Kay S.A. A genome-wide microRNA screen identifies the microRNA-183/96/182 cluster as a modulator of circadian rhythms. Proceedings of the National Academy of Sciences. 2021. 118(1). e2020454118. doi: 10.1073/pnas.2020454118.

/66.jpg)
/67.jpg)
/68.jpg)