Вважають, що природжена CMV-інфекція має місце щонайменше у 1 % немовлят [12], хоча результати останніх клінічних досліджень вказують на питому вагу зазначених уражень на рівні 8 % випадків серед усіх новонароджених [14]. У 10 % уражених дітей ця форма інфекції спочатку має безсимптомний перебіг, що ускладнює ранню клінічну діагностику [27].
Тяжкість природженої CMV-нейроінфекції широко варіює — від легких до тяжких, несумісних із життям уражень нервової системи [1, 3, 6]. Розрізняють симптомну й асимптомну природжену CMV-інфекцію за наявністю клінічних проявів протягом першого місяця постнатального періоду. A.Y. Yamamoto зі співавт. провели скринінг 12 195 новонароджених. Природжена CMV-інфекція відзначалась в 1 % випадків, причому у 10 % таких дітей мав місце безсимптомний перебіг протягом неонатального періоду [27]. D. Yilmaz Çiftdogan і F. Vardar вказують: застосування сучасних методів діагностики дозволило встановити, що близько 90 % дітей із природженою CMV-інфекцією є асимптомними на першому місяці життя, однак в подальшому в них можуть розвиватися ознаки відставання у фізичному та психічному розвитку, а також нейросенсорна приглухуватість [11].
Отже, відсутність ранніх клінічних провів не означає, що у дітей з асимптомною нейроінфекцією немає нейровізуалізаційних і патоморфологічних ознак ураження головного мозку на момент народження, як і того, що в подальшому в них не будуть розвиватися клінічні прояви неврологічного дефіциту. Як зазначають J. López-Pisón зі співавт., 10–15 % випадків асимптомної в перший місяць позаутробного життя природженої CMV-інфекції асоційовані з підвищеним ризиком відтермінованих порушень здоров’я, здебільшого сенсоневральної приглухуватості, зниження гостроти зору і затримки психомоторного розвитку дитини, ознаки яких виявляються в середньому через 6–9 місяців [16]. У дослідженні DECIBEL за участю 179 дітей показана питома вага природженої CMV-інфекції на рівні 8 %, причому у 23 % випадків згодом розвивалося порушення слуху [14].
C.L. Townsend зі співавт. у популяційному дослідженні показали, що тяжкі клінічні наслідки і залишкові явища середньої тяжкості відзначаються в 11 % випадків природженої CMV-інфекції. Якщо у разі первинної інфекції у матері симптоми помітні вже в період новонародженості, то при реактивації CMV під час вагітності неврологічні розлади у вигляді затримки психічного розвитку дитини можуть діагностуватися запізніло, в дошкільному або шкільному віці [23].
Найчастіше у разі природженої CMV-інфекції відзначаються мікроцефалія, жовтяниця, гепатолієнальний синдром, інтерстиційний пневмоніт, вади серця, хоріоретиніт, зниження гостроти зору, нейросенсорна приглухуватість і затримка психічного розвитку дитини [15].
Тяжкість клінічних симптомів ураження нервової системи CMV-етіології залежить від терміну внутрішньоутробного інфікування. O. Picone зі співавт., дослідивши 238 вагітних з первинною CMV-інфекцією, показали, що тяжкі клінічні наслідки для нервової системи плода асоційовані переважно з зараженням до 14-го тижня гестації [19]. Здебільшого відзначаються ознаки порушення ембріогенезу мозку, лейкомаляції, кісто-утворення та паренхіматозної кальцифікації, а також нейросенсорна приглухуватість [21].
При ранньому інфікуванні, протягом першого триместру внутрішньоутробного періоду, коли відбувається закладка головного мозку, розвиваються тяжкі вади центральної нервової системи (ЦНС), включаючи аненцефалію, шизенцефалію, лісенцефалію та пахігірію [9]. При пізнішому зараженні, протягом 2–3-го триместру вагітності, відзначають більш легкі прояви: вентрикуломегалію, порушення мієлінізації білої речовини мозку, кісти в полюсах скроневих часток, гіпогенезію мозолистого тіла, перивентрикулярні кальцифікати й ураження кохлеовестибулярних нервів [20].
Водночас постнатальна CMV-інфекція, набута через грудне молоко, не чинить вираженого негативного впливу на подальший розвиток дитини і стан слухового аналізатора, як показали B. Vollmer зі співавт. у невеликому дослідженні (n = 22) [25].
В даній науковій публікації наведена показова історія хвороби дитини з природженою CMV-нейроінфекцією.
Пацієнт Г., хлопчик, 2015 року народження. Батьки пред’являють скарги на відставання дитини у моторному розвитку, відсутність мовлення, порушення зорового контакту, дисфункцію тазових органів (нетримання сечі), порушений м’язовий тонус у кінцівках, судомні напади.
З анамнезу відомо, що дитина народжена від 1-ї вагітності, яка перебігала з загрозою викидня на 20-му тижні, у зв’язку з чим були призначені прогестини. Пологи були фізіологічними, на 37-му тижні гестації. Маса дитини при народженні становила 3450 г, зріст дорівнював 52 см. За шкалою Апгар — 7 балів. Ранній період онтогенезу мав перебіг із затримкою психомоторного розвитку (голову почав тримати тільки з 9-місячного віку, не навчився сидіти і ходити, не відзначався розвиток мовлення), з приводу чого у віці 1,5 року був встановлений клінічний діагноз дитячого церебрального паралічу. Дебют епілептичних нападів у вигляді генералізованих тоніко-клонічних судомних пароксизмів відбувся в віці 1 міс. Тоді ж ідентифікували специфічні IgM до СMV у сироватці крові, однак противірусну терапію хворий не отримував. На фоні призначених протиепілептичних препаратів (вальпроєва кислота, леветирацетам) спостерігалась тимчасова ремісія з подальшим відновленням епінападів з переважанням простих і складних парціальних пароксизмів.
При фізикальному огляді шкірні покриви блідо-рожевого кольору, чисті. При пальпації відзначаються збільшені рухомі лімфатичні вузли в підщелепній, передньо- і задньошийних ділянках, пахвинній і паховій зонах. В легенях вислуховується везикулярне дихання з обох боків. Серцеві тони ритмічні, чисті, звучні. При пальпації живота печінка і селезінка виходять на 1 см з-під реберних дуг. Симптом Пастернацького негативний з обох боків.
Ультразвукове дослідження імунних органів та органів черевної порожнини підтвердило наявність генералізованої лімфаденопатії та гепатоспленомегалії.
При неврологічному огляді на момент звернення свідомість дитини ясна. Зоровий контакт відсутній, на звернене мовлення майже не реагує. Самостійної мовленнєвої активності немає. Інструкцій не виконує. Самостійно тримає голову, однак без допомоги не може сидіти. Обсяг активних рухів у верхніх та нижніх кінцівках різко скорочений, пасивні рухи можливі у повному обсязі. Сухожильні та періостальні рефлекси різко дифузно посилені, викликаються з розширених рефлексогенних зон. Позитивний симптом Бабінського з обох боків. Тонус м’язів посилений за спастичним типом як у верхніх, так і в нижніх кінцівках. Клонус стоп і колінних чашечок. Сила м’язів знижена в ногах до 2 балів, в руках — до 3 балів. Координаторні проби виконати неможливо через грубі рухові розлади в кінцівках. Роботу тазових органів не контролює. Самостійне пересування унеможливлено.
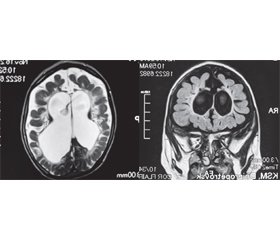
На ЕЕГ відзначається дифузне сповільнення біоелектричної активності кори головного мозку та реєструється епілептиформна активність, переважно в лобно-скроневих відділах, у вигляді множинних спайок і комплексів «пік — гостра хвиля». На МРТ головного мозку присутні типові радіологічні ознаки природженої CMV-інфекції (кортикальна атрофія, вентрикуломегалія, перивентрикулярний гліоз, поля демієлінізації в білій речовині півкуль, кісти в полюсах скроневих часток, гіпоплазія мозолистого тіла) [7, 8] (рис. 1).
За даними загального аналізу крові відзначалися легка тромбоцитопенія (110 формених елементів × 109/л), абсолютний і відносний лімфоцитоз та моноцитоз, нормальна ШОЕ.
Проведено ПЛР лейкоцитів крові з видоспецифічними праймерами HSV1/2, VZV, EBV, CMV, HHV-6, HHV-7, HHV-8, аденовірусів, кору, краснухи, ентеровірусів, TTV, парвовірусу В19, вірусів гепатиту В, С, D і G, Toxoplasma gondii, Borrelia burgdorferi, Chlamydia pneumoniae, Mуcoplasma pneumoniae в лабораторії нейробіохімії Інституту нейрохірургії імені А.П. Ромоданова. За результатами цих досліджень ідентифікували ДНК CMV у невеликій кількості — близько 10 тисяч вірусних частинок у пробі, що свідчило про реактивацію вірусу з персистуючого стану. У матері дитини виявили персистуючу CMV-інфекцію за даними ПЛР сечі, однак не сироватки крові, що вказувало на безсимптомне носійство і наштовхувало на думку про контактний механізм зараження дитини вірусом крізь плодові оболонки під час внутрішньоутробного періоду.
Імунологічне дослідження включало вивчення показників загального аналізу крові, субпопуляційного складу лімфоцитів із застосуванням лазерної проточної цитофлуориметрії (цитофлуориметр Epics Xl, США) і методу непрямої імунофлуоресценції з моноклональними антитілами до CD-маркерів з двома або трьома мітками (CD3+, CD3+CD4+, CD3+CD8+, CD3–CD19+, CD3–CD16+CD56+, CD3+CD16+CD56+) (реактиви Beckman Coulter, США). Фагоцитоз оцінювали за даними латекс-тесту з визначенням показника фагоцитозу, фагоцитарного індексу, кількості активних фагоцитів і фагоцитарної ємності крові. Сироваткові концентрації імуноглобулінів основних класів (М, G, А) визначали за результатами простої радіальної імунодифузії за Манчіні. Концентрацію класів IgE, IgD та субкласів IgG (IgG1, IgG2, IgG3, IgG4) в сироватці крові вимірювали за допомогою імуноферментного аналізу («Вектор-Бест», Російська Федерація). Активність мієлопероксидази нейтрофілів оцінювали імуноферментним методом в лабораторії нейроімунології Інституту нейрохірургії імені А.П. Ромоданова. Там також проводили НСТ-тест. Концентрацію манозозв’язуючого лектину в сироватці крові визначали методом ELISA в Німеччині за допомогою лабораторії доктора Редгера.
За результатами імунологічного дослідження виявлено ознаки вибіркового дефіциту IgA (сироваткова концентрація на рівні 0,26 г/л при нормі 0,6–2,5 г/л) за відсутності інших значущих порушень у проведеному обсязі імунологічних досліджень. Повторне дослідження виявило сироваткову концентрацію IgA на рівні 0,29 г/л, що підтверджувало попередню думку про вибірковий дефіцит даного класу антитіл. Цей імунодефіцит зустрічається в популяції з частотою 1 випадок на 500 мешканців і супроводжується зниженням резистентності до CMV [5]. Отже, дослідники дійшли висновку, що дитина через вибірковий дефіцит IgA була аномально сприйнятливою до вірусу, що потенційно могло уможливити і суттєво полегшити контактне зараження протягом внутрішньоутробного періоду онтогенезу. На принципово важливу роль природжених аномалій імунітету в розвитку CMV-інфекції плода вказали T. Tomasik зі співавт. [22]. Згідно з цим Y. Wada зі співавт. описали клінічний випадок прогресуючого перебігу хронічної реактивованої CMV-інфекції в дитини з вибірковим дефіцитом IgA, що зрештою призвело до розвитку інтерстиційного пневмоніту, ентероколіту, автоімунної гемолітичної анемії, гемофагоцитарного синдрому [26].
Отримані клінічні та параклінічні дані дозволили встановити такий діагноз пацієнту Г.: вибірковий дефіцит IgA, парціальна форма: енцефалопатія як наслідок природженої CMV-нейроінфекції з проявами кортикальної атрофії, вентрикуломегалії, гіпогенезії мозолистого тіла, перивентрикулярного гліозу, демієлінізації, кіст у полюсах скроневих часток: спастичний глибокий тетрапарез, тяжкий епілептичний синдром з частими поліморфними пароксизмами, глибока затримка психомовленнєвого розвитку, порушення функції тазових органів, неможливість самостійно пересуватися; хронічна реактивована постанатальна CMV-інфекція (ПЛР лейкоцити крові +) з картиною генералізованої лімфаденопатії, гепатолієнального синдрому, тромбоцитопенії, персистуючого лімфомоноцитозу.
Пацієнту призначена тривала терапія валіновим ефіром ганцикловіру в дозі 450 мг двічі на добу перора-льно для усунення вірусемії, сформованої CMV, згідно з результатами дослідження D.Y. Çiftdogan, F. Vardar [11] та чинними українськими рекомендаціями з лікування герпесвірусних інфекцій [2]. Для компенсації вибіркового дефіциту IgA і запобігання розвитку інших проявів цього імунодефіциту застосовували нормальний в/в імуноглобулін людини в дозі 400 мг/кг/міс. тривалим курсом [3]. З метою компенсації епілептичного синдрому під контролем ЕЕГ було належним чином збільшено дози застосовуваних протиепілептичних препаратів. Відновити неврологічний дефіцит було неможливо через запізніле звернення за медичною допомогою та некурабельність резидуального дефекту після природженої CMV-нейроінфекції у вигляді тяжкої енцефалопатії.
Дотепер опубліковано чимало досліджень і повідомлень про клінічні випадки, присвячених клініко-інструментальним ознакам природженої CMV-нейроінфекції в дітей, в деяких з яких детально обговорюються симптоми, подібні до тих, що відзначались в пацієнта Г.
V.M. Bosnjak зі співавт., вивчаючи дані 9 дітей з природженою CMV-нейроінфекцією, виділили такі неврологічні прояви: лісенцефалія, пахігірія, полімікрогірія, шизенцефалія, кальцифікація, гіпоплазія мозочка і мозолистого тіла як прояви раннього інфікування та мультифокальна демієлінізація білої речовини півкуль великого мозку і затримка ремієлінізації як наслідок пізнього внутрішньоутробного інфікування. Порушення психомоторного розвитку відзначалось у всіх дітей. У 5 пацієнтів мала місце картина дитячого церебрального паралічу, що могла стати причиною діагностичної помилки. Епілептичний синдром відзначався у 7 із 9 хворих, хоріоретиніт — у 3, а нейросенсорна приглухуватість — у 2 із них [9].
R. Pinillos-Pisón зі співавт., використовуючи виявлення ДНК CMV на фільтруючому папері, що застосовують як скринінговий тест, виділили такі прояви внутрішньоутробної CMV-інфекції: затримка антенатального розвитку, мікроцефалія, нейросенсорна приглухуватість, хоріоретиніт, сповільнення розумового розвитку, розлади поведінки (особливо аутистичного спектра), інтракраніальні кальцифікації, енцефалокластичні порушення, лейкоенцефалопатія, кортикальна дисплазія, мальформації скроневих часток і гіпокампів [20].
M.S. Van der Knaap зі співавт. за допомогою ПЛР ліквору підтвердили природжену CMV-нейроінфекцію у 12 із 22 дітей, у яких запідозрили цю патологію. Найхарактернішою ознакою була демієлінізація у глибинних відділах парієтальних часток, що іноді поєднувалася із патологією звивин. Наявність аномалій розвитку в передньому відділі скроневих часток у вигляді уражень білої речовини, кіст і розширення нижнього рогу бокових шлуночків збільшували ймовірність діагнозу природженої CMV-нейроінфекції [24].
T. Tomasik зі співавт. описали природжену CMV-інфекцію в одного з дизиготних близнюків. У дівчинки відзначалися мікроцефалія, атрофія мозку, гідроцефалія й агенезія мозолистого тіла. Рівень ДНК CMV у сечі становив 81,2 × 106/мл, у цереброспінальній рідині — 15,4 × 106/мл, у крові — 0,38 × 105/мл. Концентрація специфічних IgG у сироватці крові становила 308 Од/мл.
IgM не відзначались, що свідчило про ареактивність організму. У цієї дитини виявили синдром Тернера (моносомію за Х-хромосомою), що може пояснити зниження резистентності до опортуністичного вірусу і відсутність інфекції в іншого близнюка, який був хлопчиком [22].
D. Heldenberg, Z. Abudi повідомили про природжений CMV-менінгоенцефаліт у немовляти віком 6 тижнів з анорексією, збудливістю і конвульсіями. Вагітність і пологи були неускладненими. Відзначались IgM до CMV у сироватці крові дитини, які не могли бути отримані трансплацентарно. Покращання відбулося на тлі в/в терапії ацикловіром [13].
D. O’Rourke зі співавт. доповіли про мультифокальну лейкоенцефалопатію та кісти в передніх полюсах скроневих часток як прояв природженої CMV-нейроінфекції у дівчинки віком 1 рік [18].
J. López-Pisón зі співавт. повідомили про дитину віком 3 роки і 8 місяців з відтермінованими симптомами природженої CMV-нейроінфекції у вигляді затримки розвитку, аутизму, мікроцефалії і нейросенсорної приглухуватості. Нейровізуалізація показувала ознаки перивентрикулярної кальцифікації, лейкоенцефалопатії та білатеральних мальформацій у скроневих частках [16].
B. Milewska-Bobula зі співавт. провели лонгітудинальне проспективне дослідження психічного розвитку дітей з м’якими проявами природженої CMV-нейроінфекції (n = 38). В 32 % випадків відзначалася затримка розвитку мовлення, а в 3 % — порушення візуально-моторної інтеграції. В 37 % випадків мала місце підвищена емоційна чутливість, а в 16 % реєструвалися проблеми з адаптацією у школі [17].
C.L. Townsend зі співавт. вивчили наслідки природженої CMV-інфекції у дітей, народжених у Великій Британії та Ірландії (n = 156). В 31 % випадків відзначався нормальний розвиток дитини. М’які, середні і тяжкі наслідки реєструвались у 18, 24 і 14 % випадків відповідно. Смерть мала місце в 13 % випадків. Серед дітей, які вижили, в 27 % випадків розвивалась нейросенсорна приглухуватість [23].
Даний клінічний випадок наочно демонструє важливість своєчасного виявлення ознак CMV-інфекції для запобігання тяжким ураженням головного мозку в дітей. По-перше, матері дитини не було проведено належного скринінгу на TORCH-інфекції під час планування вагітності. Ідентифікація вогнища інфекції в урогенітальному тракті вказувала на ризик антенатального інфікування. Пригнічення репродуктивної активності CMV в урогенітальній зоні зменшило б ризик інфікування ембріона/плода. Скринінг на TORCH-інфекцію не проводився і під час вагітності, тому не було вжито заходів щодо запобігання інфікуванню плода. По-друге, хоча на першому місяці життя дитини були виявлені специфічні IgM до СMV, даному факту не надали належного значення і пацієнт не отримав необхідну противірусну терапію в ранній період хвороби. Діагностичну значущість ідентифікації IgM до СMV у крові при верифікації діагнозу природженої СMV-інфекції засвідчили D. Heldenberg, Z. Abudi [13]. Ці антитіла не проникають через плаценту і тому є результатом реакції імунної системи саме плода і новонародженого на інфекційний агент. D.Y. Çiftdogan і F. Vardar продемонстрували ефективність раннього призначення валганцикловіру в період новонародженості у разі природженої CMV-інфекції [11]. По-третє, пацієнта спостерігали з діагнозом дитячого церебрального паралічу, неправильно інтерпретуючи наявні клініко-радіологічні ознаки і не розуміючи, що CMV-інфекція в організмі все ще триває, а вірус перебуває в реактивованому стані, викликаючи характерний лімфопроліферативний синдром і зменшуючи можливості реабілітації.
R.D. Bradford зі співавт. показали, що віремія, сформована CMV, протягом першого місяця життя у немовлят з природженою CMV-інфекцією асоційована з розвитком нейросенсорної приглухуватості і дисемінованої CMV-інфекції у майбутньому, що вимагає своєчасного проведення противірусного лікування [10]. По-четверте, імунний статус дитині був оцінений лише в 5-річному віці, у стані глибокої інвалідності з ознаками необоротного ураження ЦНС, хоча CMV є добре відомим опортуністичним агентом; у зв’язку з цим імунологічні дослідження мають виконуватися одразу ж після появи перших проявів реактивованої інфекції в ранній період хвороби, що дозволяє своєчасно призначити імунотерапію. Як засвідчили Y. Wada зі співавт., відзначалося прогресування фенотипу вибіркового дефіциту IgA до більш тяжкої картини загального варіабельного імунодефіциту в дитини з хронічною реактивованою CMV-інфекцією через брак належного клінічного ведення [26].
Зараз необхідне суттєве покращення системи надання медичної допомоги в галузі профілактики та лікування природженої CMV-інфекції в дітей в Україні, для чого потрібна належна скоординована робота акушерів-гінекологів, неврологів, інфекціоністів і клінічних імунологів на засадах доказової медицини.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 26.05.2021
Рецензовано/Revised 08.06.2021
Прийнято до друку/Accepted 14.06.2021
Список литературы
1. Евтушенко С.К. и др. Неврология раннего детского возраста. К., 2016. 287 с.
2. Казмирчук В.Е., Мальцев Д.В. Рекомендации по лечению герпесвирусных инфекций человека. Український медичний часопис. 2012. № 5 (91). С. 94-107.
3. Мальцев Д.В. Герпесвірусні інфекції. К.: Центр учбової літератури, 2019. 272 с.
4. Мальцев Д.В. Иммунотерапия. Киев: Юстон, 2020. 663 с.
5. Мальцев Д.В. Ізольований дефіцит IgA: епідеміологія, клініка, діагностика і лікування. Клінічна імунологія, алергологія, інфектологія. 2016. № 1 (90). С. 5-15.
6. Мальцев Д.В. Останні досягнення у діагностиці та лікуванні герпесвірусних нейроінфекцій людини. Український неврологічний журнал. 2012. № 2 (23). С. 7-21.
7. Мальцев Д.В., Євтушенко С.К. Сучасні підходи до діагностики герпесвірусних нейроінфекцій. Міжнародний неврологічний журнал. 2016. № 3 (81). С. 32-45.
8. Мальцев Д.В., Казмірчук В.Є., Євтушенко С.К. До питання сучасної клініко-вірусологічної класифікації герпесвірусних нейроінфекцій. Международный неврологический журнал. 2012. № 2 (48). С. 14-28.
9. Bosnjak V.M., Daković I., Duranović V. et al. Malformations of cortical development in children with congenital cytomegalovirus infection — A study of nine children with proven congenital cytomegalovirus infection. Coll. Antropol. 2011. Vol. 35 (1). P. 229-234.
10. Bradford R.D., Cloud G., Lakeman A.D. et al. Detection of cytomegalovirus (CMV) DNA by polymerase chain reaction is associated with hearing loss in newborns with symptomatic congenital CMV infection involving the central nervous system. J. Infect. Dis. 2005. Vol. 191 (2). P. 227-233.
11. Çiftdogan D.Y., Vardar F. Effect on hearing of oral valganciclovir for asymptomatic congenital cytomegalovirus infection. J. Trop. Pediatr. 2011. Vol. 57 (2). P. 132-134.
12. Graça A., Silvério C., Ferreira J.P. et al. Congenital or neonatal cytomegalovirus infection? Acta Med. Port. 2004. Vol. 17 (4). P. 335-340.
13. Heldenberg D., Abudi Z. Congenital CMV meningoencephalitis treated with acyclovir. Harefuah. 1994. Vol. 126 (6). P. 322-323.
14. Korver A.M.H., de Vries J.J.C., Konings S. et al. DECIBEL study: Congenital cytomegalovirus infection in young children with permanent bilateral hearing impairment in the Netherlands. J. Clin. Virol. 2009. Vol. 46 (4). S. 27-31.
15. Llorente A.M., Castillo C.L. Congenital cytomegalovirus infection in fraternal twins: a longitudinal case study examining neurocognitive and neurobehavioral correlates. Appl. Neuropsychol. Child. 2012. Vol. 1 (1). P. 63-73.
16. López-Pisón J., Rubio-Rubio R., Ureña-Hornos T. et al. Retrospective diagnosis of congenital infection by cytomegalovirus in the case of one infant. Rev. Neurol. 2005. Vol. 40 (12). P. 733-736.
17. Milewska-Bobula B., Zebrowska J., Olszaniecka M. et al. Evaluation of intellectual development of children following congenital, mildly symptomatic cytomegalovirus (CMV) infection. A prospective study. Med. Wieku. Rozwoj. 2010. Vol. 14 (4). P. 370-373.
18. O’Rourke D., Bradley L., King M.D., Ryan S. Leukoencephalopathy with anterior temporal cysts due to congenital CMV infection diagnosed retrospectively. J. Neuroimaging. 2010. Vol. 20 (3). P. 292-293.
19. Picone O., Vauloup-Fellous C., Cordier A.G. et al. A series of 238 cytomegalovirus primary infections during pregnancy: description and outcome. Prenat. Diagn. 2013. Vol. 33 (8). P. 751-758.
20. Pinillos-Pisón R., Llorente-Cereza M.T., López-Pisón J. et al. Congenital infection by cytomegalovirus. A review of our 18 years’ experience of diagnoses. Rev. Neurol. 2009. Vol. 48 (7). P. 349-353.
21. Tardieu M., Tejiokem M., Nguefack S. Virus-induced lesions and the fetal brain: examples of the transmission of HIV-1 and CMV from mother to offspring. Handb. Clin. Neurol. 2013. Vol. 112. P. 1103-1108.
22. Tomasik T., Zawilińska B., Pawlik D. et al. Congenital cytomegaly in one twin — a case report. Med. Wieku. Rozwoj. 2012. Vol. 16 (3). Р. 252-260.
23. Townsend C.L., Forsgren M., Ahlfors K. et al. Long-term outcomes of congenital cytomegalovirus infection in Sweden and the United Kingdom. Clin. Infect. Dis. 2013. Vol. 56 (9). P. 1232-1239.
24. Van der Knaap M.S., Vermeulen G., Barkhof F. et al. Pattern of white matter abnormalities at MR imaging: use of polymerase chain reaction testing of Guthrie cards to link pattern with congenital cytomegalovirus infection. Radiology. 2004. Vol. 230 (2). P. 529-536.
25. Vollmer B., Seibold-Weiger K., Schmitz-Salue C. et al. Postnatally acquired cytomegalovirus infection via breast milk: effects on hearing and development in preterm infants. Pediatr. Infect. Dis. J. 2004. Vol. 23 (4). P. 322-327.
26. Wada Y., Sato T., Kitajima H., Kubo M. Chronic cytomegalovirus infection that present specific clinical course a case of a boy with common variable immunodeficiency. Nihon Rinsho Meneki Gakkai Kaishi. 1995. Vol. 18 (2). P. 247-255.
27. Yamamoto A.Y., Mussi-Pinhata M.M., Isaac M.L. et al. Congenital cytomegalovirus infection as a cause of sensorineural hearing loss in a highly immune population. Pediatr. Infect. Dis. J. 2011. Vol. 30 (12). P. 1043-1046.

/59.jpg)