Журнал «» Том 14, №5, 2021
Вернуться к номеру
Кардіоваскулярний ризик у пацієнтів з коморбідними станами: особливості корекції
Авторы: Тетяна Чистик
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Сучасна медицина приділяє багато уваги хворим з коморбідною патологією, зокрема з поєднанням захворювання серцево-судинної системи і хронічної хвороби нирок (ХХН). Загальновідомо, що смертність нефрологічних пацієнтів формується в основному за рахунок кардіоваскулярних подій. Тому сучасна тактика ведення осіб із ХХН базується на лікуванні самої патології нирок і зниженні кардіоваскулярних ризиків.
21–24 вересня у гібридному форматі online/offline відбувся ХХІІ Національний конгрес кардіологів України, у рамках якого були розглянуті актуальні питання діагностики й лікування артеріальної гіпертензії (АГ), порушення ритму серця, гострого коронарного синдрому, хронічної серцевої недостатності. Також обговорювалися питання корекції кардіоваскулярного ризику в коморбідних пацієнтів, можливості статинотерапії в епоху пандемії COVID-19 та інші.
З доповіддю «Особливості корекції кардіоваскулярного ризику в пацієнта з коморбідними станами» виступив заслужений лікар України, доктор медичних наук, професор, завідувач кафедри нефрології та нирково-замісної терапії НМАПО імені П.Л. Шупика Дмитро Дмитрович Іванов.
За даними Global Burden of Disease Study (2017), близько 10–12 % дорослого населення планети страждають від хронічної хвороби нирок. Смерть пацієнтів із ХХН у більшості випадків викликана серцево-судинними подіями, а її частота в 10–20 разів перевищує загальнопопуляційні показники. З огляду на це при веденні пацієнтів із ХХН і серцево-судинними захворюваннями важливо проводити терапію, спрямовану на гальмування прогресування хронічної ниркової недостатності (ХНН) і профілактику серцево-судинних подій (Neuen B.L., 2019).
Пацієнти з ХХН мають кардіоваскулярний ризик за наявності артеріальної гіпертензії, серцевої недостатності й ішемічної хвороби серця. Зростання ризику відзначається при швидкості фільтрації сечі менше за 60 мл/хв/1,73 м2 і підвищенні рівня співвідношення альбуміну/креатиніну (САК) понад 30 мг/моль.
Це знайшло відображення в останніх міжнародних рекомендаціях KDIGO-2020, згідно з якими виділяється 5 стадій ШКФ:
— G1: ШКФ ≥ 90 мл/хв/1,73 м2 — нормальна або висока;
— G2: ШКФ 60–89 мл/хв/1,73 м2 — незначно знижена;
— G3a: ШКФ 45–59 мл/хв/1,73 м2 — незначно або помірно знижена;
— G3b: ШКФ 30–44 мл/хв/1,73 м2 — помірно або виражено знижена;
— G4: ШКФ 15–29 мл/хв/1,73 м2 — виражено знижена;
— G5: ШКФ < 15 мл/хв/1,73 м2 — ниркова недостатність.
У нових рекомендаціях передбачено поділ 3-ї стадії ХХН за рівнем ШКФ на стадії 3а і 3б, оскільки нирковий і серцево-судинний прогнози не однакові в групах осіб з ХХН 3-ї стадії з ШКФ від 59 до 45 мл/хв/1,73 м2 і від 44 до 30 мл/хв/1,73 м2. Якщо в підгрупі осіб із ШКФ від 59 до 45 мл/хв/1,73 м2 дуже високі серцево-судинні ризики при помірних темпах прогресування ХХН, то в пацієнтів із рівнем ШКФ від 44 до 30 мл/хв/1,73 м2 ризик розвитку термінальної ХНН (ТХНН) виявляється вищим, ніж ризик летальних серцево-судинних ускладнень.
Ризики серцево-судинної смертності, розвитку ТХНН і прогресування ХХН у будь-якому діапазоні ШКФ істотно розрізняються залежно від рівня співвідношення альбуміну/креатиніну. У рекомендаціях KDIGO-2020 було запропоновано виділити такі категорії альбумінурії:
— А1 (САК < 3 мг/ммоль) — нормальна або незначно підвищена;
— А2 (САК 3–30 мг/ммоль) — помірно підвищена;
— А3 (САК > 30 мг/ммоль) — виражено підвищена.
Отже, використання категорій ШКФ і співвідношення альбуміну/креатиніну дозволяє стратифікувати хворих на ХХН за ризиком ниркових результатів (зниження ШКФ, прогресування альбумінурії, ТХНН) і кардіоваскулярних ускладнень.
Розрахунок швидкості клубочкової фільтрації здійснюється за допомогою спеціальних формул, з яких найбільш досконалою є формула CKD-EPI, що враховує расу, стать, вік і креатинін сироватки. Для розрахунку ШКФ за формулою CKD-EPI можна скористатися калькуляторами, поданими в Інтернеті, або спеціальними додатками для мобільних пристроїв.
Для зниження кардіоваскулярного ризику в пацієнтів із ХХН необхідний ретельний контроль артеріального тиску (АТ). У рекомендаціях Все-світньої асоціації нефрологів підкреслюється, що дорослих пацієнтів з високим артеріальним тиском і ХХН слід лікувати до досягнення цільового систолічного артеріального тиску (САТ) < 120 мм рт.ст. за його переносимості, з використанням стандартизованого офісного вимірювання АТ (рівень доказовості 2В). Тому лікування пацієнтів із ХХН необхідно здійснювати в контексті зниження АТ.
З цією метою застосовуються інгібітори ангіотензинперетворювального ферменту (іАПФ), блокатори рецепторів ангіотензину II (БРА), вазодилатуючі блокатори β-адренорецепторів або препарати α-, β-адреноблокуючої дії, селективні блокатори повільних кальцієвих каналів і діуретики. Однак вибір препаратів треба здійснювати на користь тих, які «доброзичливі» до нирок. Як свідчить клінічна практика, БРА мають певні переваги над іАПФ (крім інфаркту міокарда), лерканідипін забезпечує кращій прогноз, ніж інші блокатори кальцієвих каналів, торасемід призначають частіше, ніж тіазидний діуретик, моксонідин є препаратом вибору при недостатній відповіді, а небіволол має кращий профіль, ніж інші блокатори β-адренорецепторів.
Отже, у прикладній нефрології визначена формула БРІМОНЕЛ — БР(А)І(АПФ)МО(ксонідин)НЕ(біволол)Л(ерканідипін), що відображає привабливі особливості окремих молекул у подоланні АГ при захворюванні нирок.
При ХХН і серцево-судинному ризику також необхідно здійснювати ренопротекцію — систему заходів переважно фармакологічного контролю, що сприяє тривалому збереженню функції нирок. Для медикаментозної корекції призначаються препарати двох груп — блокатори ренін-ангіотензин-альдостеронової системи (РААС) та інгібітори натрійзалежного котранспортера глюкози 2-го типу (НЗКТГ-2). Інгібітори РААС розширюють еферентну артеріолу, за рахунок цього покращується гемодинаміка в клубочках нирок. Інгібітори НЗКТ-2, серед яких доведену ефективність має дапагліфлозин, викликають звуження аферентної артеріоли, унаслідок чого обмежується приплив надлишкової крові в клубочки нирок, що оптимізує їх функцію (Van Bommel E.J., 2017). Завдяки цьому інгібітори РААС і інгібітори НКЗТ-2 знижують тиск у клубочку й рівень альбумінурії (Heerspink H.I., 2011).
Клінічний випадок 1. Пацієнт, 26 років, скерованій сімейним лікарем до нефролога у зв’язку з підвищенням АТ до 148/90 мм рт.ст. і альбумінурією 40 мг, отримує олмесартан 20 мг на ніч. При обстеженні в нефролога виявлено САК 38 мг/ммоль, рШКФ 70 мл/хв. З урахуванням того, що 2–5-річний прогноз термінальної ХНН становить 0 %, було запропоновано продовжити лікування олмесартаном з подальшим спостереженням пацієнта.
Клінічний випадок 2. Пацієнт, 41 рік, скерований кардіологом до нефролога з приводу підвищення артеріального тиску до 145/84 мм рт.ст. і альбумінурії 150 мг. Кардіологом був призначений периндоприл 4 мг/амлодипін 5 мг.
Слід відзначити, що, згідно з міжнародними рекомендаціями, пацієнтам з артеріальною гіпертензією і ХХН периндоприл 10 мг/амлодипін 10 мг/індапамід 2,5 мг, периндоприл 10 мг/індапамід 10 мг, периндоприл 10 мг/індапамід 2,5 мг протипоказані при зниженні ШКФ < 60 мл/хв/1,73 м2, валсартан/амлодипін — при ШКФ < 30 мл/хв/1,73 м2.
У пацієнта при додатковому обстеженні виявлено САК 34 мг/ммоль, рШКФ 54 мл/хв, що відповідає 2–5-річному прогнозу ТХНН 3 %. Тому терапія була змінена на олмесартан 10 мг/лерканідипін 10 мг.
У дослідженні RED LEVEL (Robles N.R., 2016) порівнювали вплив на альбумінурію лерканідипіну в поєднанні з еналаприлом, комбінацією амлодипіну й еналаприлу. Через рік лікування дослідники виявили вірогідне зменшення альбумінурії тільки в групі пацієнтів, які отримували лерканідипін. Також комбінація лерканідипіну й еналаприлу забезпечувала збереження кліренсу креатиніну в пацієнтів, тоді як у групі амлодипін + еналаприл відзначалося його зниження. Автори дослідження дійшли висновку, що застосування комбінації амлодипіну й еналаприлу має переваги щодо тривалої нефропротекції в гіпертензивних пацієнтів.
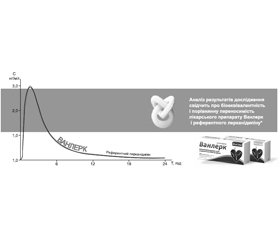
На українському фармацевтичному ринку лерканідипін представлений препаратом Ванлерк 20 мг (АТ «Київський вітамінний завод»). Ванлерк біоеквівалентний оригінальному лерканідипіну, що підтверджено результатами порівняльного рандомізованого перехресного дослідження (рис. 1).
У пацієнта з клінічного випадку 2 також була скарга на еректильну дисфункцію. За наявності такої скарги слід виявити, чи пов’язана вона з АГ, чи виникла на тлі прийому антигіпертензивних препаратів. Найбезпечнішим препаратом для контролю АТ у пацієнтів з еректильною дисфункцією є небіволол. Для покращення життя в таких пацієнтів можна призначати аванафіл (Аваналав) 100 мг. Це підтверджено у власному дослідженні КАЯК, у якому вивчались два параметри — рівень АТ і якість життя в 30 пацієнтів з АГ та еректильною дисфункцією. Призначались інгібітори РААС і Аваналав 50 мг тричі на тиждень або 100 мг 2 рази на тиждень. Результати дослідження показали, що Аваналав забезпечує зниження АТ на 4/2 мм рт.ст. і ефективну ліквідацію еректильної дисфункції.
Клінічний випадок 3. Пацієнт скерований кардіологом, має клінічний діагноз: ішемічна хвороба серця, серцева недостатність 2 із збереженою фракцією викиду, АГ 2–3-го ступеня, ХХН 4-ї стадії. Артеріальний тиск — 150/98 мм рт.ст. Отримує еналаприл 10 мг двічі на день, амлодипін 10 мг двічі на день і торасемід 10 мг.
У пацієнта при ХХН 4-ї стадії швидкість клубочкової фільтрації менше ніж 30 мл/хв/1,73 м2 (ХХН 4–5-ї стадії), тому слід відмовитися від призначення блокаторів РААС, зважаючи на їхній негативний вплив на ШКФ. У цьому випадку в нефрологічній практиці формула БРІМОНЕЛ замінюється на МОНЕЛ — МО(ксонідин)НЕ(біволол)Л(ерканіди-пін).
Пацієнту була проведена корекція терапії з призначенням еналаприлу 10 мг двічі, лерканідипіну 10 мг двічі, торасеміду 10 мг і моксонідину 0,2 двічі-тричі на день. Прийом препаратів проводиться кожні дві години, що не дуже зручно, однак дозволяє збільшити додіалізний період.
Існує досвід застосування політаблетки Remission Clinic Bergamo, до складу якої входили раміприл 5–10 мг/добу, лосартан 50–100 мг/добу, верапаміл 80–120 мг/добу та аторвастатин 10–20 мг/добу, яка приймалася протягом 4 років. Подвійна блокада ренін-ангіотензинової системи (РАС) для захисту нирок від швидкого прогресування до кінцевої стадії хронічної ниркової недостатності в поєднанні з гіполіпідемічною терапією і модифікацією способу життя дозволила домогтися достовірного уповільнення прогресування ХХН. Унікальність цього досвіду полягає в 4-компонентній схемі лікування (мультимодальна стратегія), у той час як подвійна блокада РАС комбінацією іАПФ/блокатор рецепторів ангіотензину II або БРА/прямий інгібітор реніну добре відома й давно успішно застосовується на практиці.
У власному дослідженні «Унікум» проводилася оцінка ефективності 4-компонентної терапії комбінацією препаратів Ірбетан, Небівал, Магнікор, Лівостор (АТ «Київський вітамінний завод») у 42 пацієнтів з АГ і ХХН протягом 3 місяців. Результати дослідження продемонстрували зниження протеїнурії з 3 до 0,3 г/л, АТ — до 120/80 мм рт.ст., зменшення ХНН на 27 % проти монотерапії іАПФ. Крім того, покращилися інші показники — АТ, рівень ліпопротеїдів низької щільності, індекс атерогенності та ШКФ.
Також не слід забувати, що лікування АГ повин-но залежати від рівня ШКФ. При рШКФ понад 60 мл/хв терапія проводиться без обмежень, з урахуванням індивідуальних реакцій, 45–60 мл/хв — необхідне зниження дози індапаміду й периндоприлу або їх відміна, 30–44 мл/хв — фізична активність, корекція доз препаратів і відміна інгібіторів НЗКТГ-2, менше за 30 мл/хв — відміна інгібіторів РААС, призначення симпатоміметиків і фуросеміду. Тобто чим нижче ШКФ, тим менше можливостей для призначення препаратів. Тільки лерканідипін може призначатися при будь-яких значеннях ШКФ, навіть при термінальній нирковій недостатності. Дози препаратів при зниженні функції зменшуються для інгібіторів РААС, збільшуються для діуретиків, моксонідин і урапідил призначаються як препарати, що знижують АТ.
Отже, призначаючи пацієнтам з АГ і ХХН антигіпертензивну терапію, ми націлені на просте лікування, досягнення нормотензії без побічних ефектів, емоційне й сексуальне задоволення, що в сукупності значно покращує якість життя.

/11.jpg)