Біль у нижній частині спини (БНЧС) вражає понад 70 % населення розвинених країн світу і є серйозною соціально-економічною проблемою [1, 2]. БНЧС належить до найпоширеніших захворювань, поступаючись за частотою звернень до лікарів лише ураженням верхніх дихальних шляхів, вражаючи все більше молодого працездатного населення віком від 35 до 55 років [3–5].
На окрему увагу заслуговує хронічний БНЧС, що є головним соціально-економічним тягарем внаслідок збільшення кількості років, які пацієнти живуть з інвалідністю [6]. Останній визначається як біль, що виникає протягом 3 місяців у нижній частині спини між нижнім краєм останнього ребра і горизонтальною сідничною складкою [7]. У всьому світі хронічний БНЧС вражає близько 23 % населення і рецидивує протягом 12 місяців у 24–80 % осіб [8]. Відомо багато причин БНЧС, зокрема, він може бути наслідком захворювання або травми, ознакою системного захворювання, сепсису або злоякісного новоутворення. БНЧС має різну природу: механічний (97 %), немеханічний (приблизно 1 %) спінальний біль, біль у результаті вісцеральних захворювань (2 %) [9].
Механічний неспецифічний біль у нижній частині спини виникає при ураженні хребта, міжхребцевих дисків або оточуючих м’яких тканин, включно з болем при напруженні м’язів попереково-крижової ділянки, грижі диска, поперековому спондильозі, спондилолістезі, спондилолізі, компресійних переломах хребців. До станів, що спричиняють БНЧС немеханічної етіології, належать неоплазії, множинна мієлома, метастатична карцинома, лімфома, пухлини спинного мозку, ретроперитонеальні пухлини, первинні пухлини хребців, інфекційні ураження, остеомієліт, септичний дисцит, анкілозуючий спондилоартрит, хвороба Педжета, псоріатичний спондиліт тощо. БНЧС у результаті ураження вісцеральних органів виникає при таких захворюваннях, як простатит, ендометріоз, хронічні запальні захворювання таза, хвороби нирок (нефролітіаз, пієлонефрит, перинефральний абсцес), аневризма аорти, патологія шлунково-кишкового тракту (панкреатит, холецистит, виразкова хвороба) [2, 3, 10, 11].
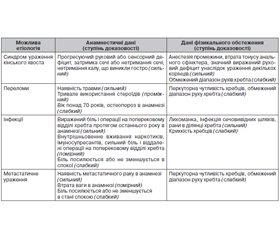
Оцінку БНЧС слід починати з анамнезу й фізикального огляду пацієнта, результати якого визначають подальшу діагностичну й лікувальну тактику [10]. Важливо виключити наявність «червоних прапорців», що вказують на системне захворювання або наявність гострих станів, які вимагають додаткової оцінки перед початком емпіричного лікування [8, 12–14] (тaбл. 1).
Надзвичайно важливим є проведення диференціальної діагностики при визначенні причини БНЧС. Зокрема, основні причини механічного БНЧС подані в табл. 2 (запозичено з [8], [11], [15]).
Метою огляду пацієнта з БНЧС насамперед є визначення джерела болю, щоб не пропустити серйозні стани, які лежать в основі БНЧС. Потрібно часто диференціювати механічний неспецифічний біль у нижній частині спини з болем немеханічної природи. Зокрема, від 15 до 30 % випадків БНЧС можна пояснити ураженням крижово-клубового суглоба [16, 17]. Синдром крижово-клубового суглоба спричиняє БНЧС, який іррадіює в нижні кінцівки, таз, куприково-стегнову ділянку, сідниці й живіт — ділянки, куди може віддавати біль радикулярного походження [18]. Значна кількість етіологічних чинників може призводити до ураження крижово-клубового суглоба. Перекриття синдрому ураження крижово-клубового суглоба з іншими різноманітними причинами БНЧС, а також численні причини дисфункції крижово-клубових суглобів роблять цей стан не тільки тяжким для встановлення діагнозу, але й складним для лікування [19]. Ключ до визначення етіології ураження крижово-клубового суглоба часто дають розташування й особливості патологічних змін у суглобі. Основними рентгенографічними ознаками сакроілеїту є ерозії кісток, зміни суглобової поверхні, субхондральний склероз та анкілоз [20]. Сакроілеїт, викликаний спондилоартритом, ентеропатичною артропатією, зазвичай є двобічним і симетричним, однак також можуть спостерігатися однобічні й асиметричні зміни, особливо при псоріатичному артриті й реактивному артриті, як правило, на початку захворювання [20]. Результати магнітно-резонансної томографії (МРТ) під час гострого сакроілеїту включають наявність внутрішньосуглобової рідини, субхондральний набряк кісткового мозку, накопичення контрасту в суглобі й довкола нього, набряк м’яких тканин. У разі хронічного захворювання спостерігаються зміни кісткового мозку, ерозія кісток, субхондральний склероз та анкілоз, облітерація суглобової щілини [21]. Незважаючи на те, що рентгенографічний сакроілеїт є характерною рисою анкілозуючого спондиліту (АС), дані, типові для сакроілеїту, можна побачити при багатьох інших захворюваннях [22].
/13.jpg)
Пацієнтів з рентгенографічними ознаками сакроілеїту й болем у спині зазвичай скеровують до ревматологів для виключення анкілозуючого спондиліту — нечастого в первинній медичній допомозі ревматологічного захворювання, при якому між консультацією і встановленням діагнозу часто минає багато часу. Однак лікарям-спеціалістам необхідно зважати на наявність інших захворювань, що нагадують АС, до яких належать хвороба Педжета, сакроілеїт при саркоїдозі, сакроілеїт інфекційної природи, дифузний ідіопатичний скелетний гіперостоз (ДІСГ), конденсуючий остеїт клубової кістки (КОКС). Саме тому лікарі повинні знати клінічні й візуалізаційні відмінності між цими захворюваннями [22].
Симптоми АС (такі як біль у хребті, скутість і втома) є неспецифічними й часто виникають при інших станах [23, 24]. Однак такі характерні особливості, як погіршення в другій половині ночі, що викликає скутість при прокиданні, і полегшення при фізичних навантаженнях мають високу чутливість для АС. Для АС також притаманний мігруючий біль у ділянці сідниць, що посилюється при тривалому сидінні, полегшення болю після прийому гарячого душу або застосування грілки. Пацієнти з АС також відмічають біль у грудях при видиху внаслідок запалення реберно-грудинних з’єднань, біль у ступнях у ділянці п’ятки через запальні зміни в місцях прикріплення зв’язок і сухожилків до кісток (часто в ділянці ахіллова сухожилка), біль у щелепах як у спокої, так і при жуванні. Крім того, має значення наявність інших неспецифічних симптомів, таких як субфебрильна температура, увеїт, почервоніння очей, здуття живота, діарея та інші симптоми з боку шлунково-кишкового тракту, особливо якщо виникнення вищезазначених симптомів збігається з болем у спині, це може свідчити про те, що біль має запальний характер [21, 25]. АС слід диференціювати з дифузним ідіопатичним скелетним гіперостозом, що являє собою системне захворювання, при якому дифузний кальциноз охоплює зв’язки, сухожилки та м’які тканини [26]. У клінічній картині домінує зменшення рухливості хребта й порушення постави, які можуть бути неправильно інтерпретовані як анкілозуючий спондиліт. При ДІСГ поряд з дифузним кальцинозом та окостенінням на рентгенограмах можуть виявлятися вакуум, звужуючий склероз і анкілоз (від часткового до повного), суглобовий простір без ерозій [26]. ДІСГ також може вражати інші частини осьового відділу хребта, як правило, грудний відділ хребта, спостерігається окостеніння передньої поздовжньої зв’язки. ДІСГ не обмежується осьовим скелетом, у пацієнтів спостерігається навколосуглобовий гіперостоз кистей, колін і ліктів, а також сухожилка чотириголового м’яза. Виявлення цих змін може бути корисним для диференціації ДІСГ від АС та інших спондилітів [22].
Конденсуючий остеїт клубової кістки — ще один поширений стан, що викликає симптоми, подібні до сакроілеїту, уражає 0,9–2,5 % загальної популяції [27]. Цей стан однаковою мірою трапляється в чоловіків і жінок [27]. У клінічній картині осьовий біль у попереку домінує над скутістю [27]. При фізикальному огляді сенсорних або рухових змін немає [27]. КОКС може виникати в жінок під час вагітності, також може проявлятися хронічним болем у спині, а іноді й болем у ділянці стегна. Крім того, КОКС може бути клінічно асимптомним і діагностуватися лише рентгенологічно [28]. До інших клінічних ознак, що свідчать на користь діагнозу КОКС, належать: відсутність системного запалення, втрати ваги, анемії, нормальні показники маркерів запалення, відсутність запалення очей [29]. Крім того, КОКС не асоціюється з якимись певними антигенами HLA [27]. Рентгенологічно КОКС діагностується як трикутник склерозу в клубовій кістці, що прилягає до нижньої частини крижово-клубового суглоба, у той же час немає ерозій або звуження суглобового простору [30]. КОКС зазвичай буває двобічним і симетричним [27], однак може бути однобічним [29]. На МРТ при КОКС спостерігається склероз клубової кістки, можливо, прилеглих крижів, але без звуження суглобового простору або ерозій. Лікування, як правило, консервативне, зрідка в рефрактерних випадках потрібна хірургічна резекція уражень [27].
Інфекційний сакроілеїт зустрічається вкрай рідко і становить лише 1–4 % кісткових і суглобових інфекцій [31], переважно вражає дітей і молодих осіб [31]. Бруцельоз — це зоонозна інфекція, спричинена дрібними грамнегативними бактеріями, які називаються бруцелами, серед яких до 5 [32] різних видів заражають людей [33]. Зараження відбувається після контакту, проковтування або вдихання організмів від заражених тварин, включно з великою рогатою худобою, козами й вівцями [33]. Артралгії, міалгії і біль у спині часто виникають під час лихоманки, що буває гострою, хронічною або рецидивуючою [33]. При бруцельозі серед суглобів найчастіше страждає крижово-клубовий суглоб [31]. Рентгенографічні зміни при інфекційному сакроілеїті виникають приблизно через два тижні від початку захворювання. Ерозії можуть бути наявними при збільшенні суглобового простору [31]. Комп’ютерна томографія більш чутлива для виявлення ерозій і змін суглобового простору, що розширюється під час інфекції, а МРТ має ще більшу чутливість для діагностики бруцельозу суглобів, демонструючи наявність внутрішньосуглобової рідини, набряк кісткового мозку й присутність навколосуглобових уражень, особливо на ранній стадії захворювання. На МРТ добре видно субхондральний склероз, ерозії та анкілоз при хронічній інфекції [34]. У той же час сцинтиграфія кісток має високу чутливість, хоча й низьку специфічність для ідентифікації інфекції крижово-клубового суглоба [31].
Сакроілеїт також має місце при саркоїдозі, що є системним хронічним гранулематозним захворюванням, яке зазвичай вражає шкіру, легені й опорно-рухову систему. Одним з рідкісних проявів кісткового саркоїдозу є ураження крижово-клубових суглобів. Ураження крижово-клубової кістки при саркоїдозі може перебігати без типового анамнезу запального болю в спині [35]. Ураження крижово-клубових суглобів у пацієнтів із саркоїдозом може бути наслідком саркоїдного остеїту або гранулематозної інфільтрації суглобів. Рентгенологічні дані сакроілеїту при саркоїдозі подібні до даних при АС, і для з’ясування діагнозу часто потрібні додаткові візуалізаційні дослідження. МРТ дуже чутлива до кісткових змін при саркоїдозі, і хоча вона не є специфічною [35], може допомогти у виборі місця біопсії. Біопсія крижово-клубового суглоба при саркоїдозі демонструє неказеозні гранульоми в синовії [36]. Навіть за наявності змін в біоптаті, типових для саркоїдозу, необхідно виключати туберкульозну етіологію ураження [22].
Хвороба Педжета, також відома як деформуючий остеїт, є поширеним захворюванням кісток, при якому можуть бути ознаки сакроілеїту. Дана хвороба асоціюється з генами HLA-DR2 і SQSTM1 [37], а також у виникненні захворювання відіграють роль чинники навколишнього середовища. При даній патології найчастіше страждають кістки черепа, таза й трубчасті кістки. При хворобі Педжета рентгенологічно досить часто спостерігається одно- або двобічне зрощення крижово-клубових суглобів [38].
Отже, відповідно до сучасних уявлень, візуалізація, без сумніву, має важливе значення для диференціальної діагностики, вона надає точну морфологічну інформацію, впливає на прийняття терапевтичних рішень. Однак лікар повинен мати критичне мислення при призначенні нейровізуалізаційних методів дослідження у пацієнтів з БНЧС, оскільки, відповідно до даних літератури, від 40 до 59 % пацієнтів, які пройшли обстеження, не мали жодних показань до візуалізації [39, 40].
Зважаючи на вищезазначене, необхідно користуватися сучасними рекомендаціями при призначенні візуалізаційних методів дослідження: уникати візуалізації (магнітно-резонансної томографії, комп’ютерної томографії або рентгенографії) з приводу гострого болю в попереку без конкретних показань; не робити зображень поперекового відділу хребта у відділенні невідкладної допомоги для дорослих з нетравматичним болем у спині, якщо пацієнт не має серйозного або прогресуючого неврологічного дефіциту або підозри на наявність серйозного основного захворювання (наприклад, інфекції хребта, синдром кінського хвоста або рак з кістковими метастазами); не здійснювати візуалізації при болях у попереку протягом перших шести тижнів, якщо немає «червоних прапорців»; не рекомендовано вдосконалену візуалізацію (наприклад, магнітно-резонансну томографію) хребта протягом перших шести тижнів пацієнтам з неспецифічними гострими болями в попереку за відсутності «червоних прапорців» [10].
Відповідно до сучасних даних літератури, медикаментозна терапія є найбільш рекомендованою інтервенцією, що застосовується для лікування хронічного БНЧС. Зокрема, нестероїдні протизапальні засоби (НПЗЗ), ацетамінофен, антидепресанти, міорелаксанти, опіоїди продемонстрували ефективність у лікуванні хронічного БНЧС [41, 42]. Опитування, проведене в США за участю 700 дорослих віком до 70 років із хронічним БНЧС, виявило, що 37 % опитаних приймали принаймні один медикаментозний знеболюючий засіб за останні 30 днів, 19 % респондентів вживали опіоїди, 10 % приймали НПЗЗ, 8,5 % приймали міорелаксанти, а 7 % використовували габапентиноїди, антидепресанти й снодійні засоби вживали 18 і 5 % відповідно [43]. Зокрема, як ліки першої лінії для терапії хронічного БНЧС пацієнти часто використовують знеболюючий протизапальний препарат ацетамінофен (парацетамол), що пов’язано з його широкою доступністю, відносно сприятливим профілем безпеки. У той же час хворі з порушенням функції печінки та ті, які споживають надмірну кількість алкоголю, мають ризик розвитку серйозних побічних ефектів і ускладнень при тривалому застосуванні ацетамінофену [44, 45]. Доведено, що комбінація ібупрофену й ацетамінофену забезпечує більш швидке й ефективне знеболювання порівняно з монотерапією ібупрофеном у відкритому дослідженні при профілі безпеки, подібному до такого при монотерапії ібупрофеном [46]. Відзначено також, що комбіноване застосування ацетамінофену й трамадолу забезпечує синергічну, швидку й ефективну короткочасну аналгезію для пацієнтів із хронічним БНЧС [47]. У той же час систематичний огляд ефективності ацетамінофену демонструє відсутність переваг щодо застосування останнього як знеболюючого препарату і щодо якості життя пацієнтів із БНЧС [48].
У більшості клінічних рекомендацій НПЗЗ, що чинять знеболюючу й протизапальну дію через інгібування ферментів циклооксигенази, відзначаються як препарати першої або другої лінії для лікування БНЧС. Однак при застосуванні цих препаратів слід враховувати їх можливий негативний вплив на шлунково-кишковий тракт, печінку, серцево-судинну й ниркову системи, особливо в літніх людей. Саме тому рекомендовано застосовувати НПЗЗ у найнижчій ефективній дозі протягом найкоротшого періоду часу в поєднанні із супутнім гастропротекторним лікуванням [49]. Відомо, що інгібітори циклооксигенази-2 (ЦОГ-2) вибірково впливають на фермент ЦОГ-2 і викликають менший ризик кровотечі порівняно з традиційними НПЗЗ [50]. У той же час інгібітори ЦОГ-2, як і інші НПЗЗ, підвищують ризик тромботичних серцево-судинних подій [51]. Однак ризик цих подій може бути результатом складної взаємодії між молекулою препарату, дозою і вихідним ризиком серцево-судинних захворювань [52]. Для целекоксибу ризик виявився залежним від дози і був очевидним серед пацієнтів з високим ризиком серцево-судинних захворювань [52, 53]. Питання тривалого застосування целекоксибу в пацієнтів із хронічним БНЧС потребує подальшого уточнення. Наявні дані літератури щодо безпеки застосування целекоксибу в пацієнтів з колоректальними аденомами. Зокрема, під час проведеного метааналізу з комплексною оцінкою співвідношення ризику/користі встановлено, що тривале застосування целекоксибу в дозі ≤ 400 мг/добу потенційно може розглядатися як безпечний варіант хіміопрофілактики в пацієнтів з колоректальними аденомами при застосуванні 400 мг один раз на день, особливо для хворих з високим ризиком розвитку аденоми, але з низьким ризиком серцево-судинних захворювань. Однак необхідні більш тривалі дослідження целекоксибу в дозі ≤ 400 мг один раз або двічі на день, щоб повністю з’ясувати справжній баланс між ризиком і користю цього засобу, зокрема при лікуванні пацієнтів із хронічним БНЧС [54]. В оновленому кокранівському огляді, спираючись на численні дослідження, у яких оцінювалася ефективність застосування НПЗЗ для лікування хронічного БНЧС, встановлено статистично значущі переваги від застосування НПЗЗ, що полягали в зменшенні інтенсивності болю й зниженні рівня інвалідизації пацієнтів із хронічним БНЧС [55]. З огляду на те, що хронічний БНЧС часто містить як ноцицептивні, так і нейропатичні компоненти, застосування різних засобів монотерапії продемонструвало лише часткову ефективність. Саме тому використання індивідуальної мультимодальної терапії, що поєднує ліки з різними механізмами дії, є раціональним підходом. На жаль, досліджень, що вивчають ефективність і безпечність комбінованої терапії, недостатньо [41]. Зокрема, у плацебо-контрольованому дослідженні проведено порівняння безпечності й ефективності поєднаного застосування целекоксибу й прегабаліну і застосування цих засобів у монотерапії для лікування хронічного БНЧС різного походження. Встановлено, що монотерапія целекоксибом зменшувала вираженість болю на 12,4 %, монотерапія прегабаліном — на 10,4 %, а їх комбінація — на 51,8 %. Побічні ефекти були подібними під час монотерапії або комбінованого лікування. Отже, було продемонстровано, що поєднання прегабаліну й целекоксибу є більш ефективним, ніж монотерапія, і відносно безпечним у лікуванні пацієнтів із хронічним БНЧС [56]. В іншому дослідженні порівняли ефективність застосування НПЗЗ целекоксибу з трамадолом і встановили, що целекоксиб протягом 6 тижнів продемонстрував кращі результати в лікуванні пацієнтів із хронічним БНЧС [57]. На фармацевтичному ринку України з’явився новий препарат групи нестероїдних протизапальних засобів, інгібітор ЦОГ-2 Лекокса виробництва компанії World Medicine.
ЛЕКОКСА (LEKOXA)
Склад: діюча речовина: целекоксиб; 1 капсула тверда містить целекоксибу 100 мг або 200 мг.
Фармакотерапевтична група. Протизапальні й антиревматичні засоби. Коксиби. Код АТХ M01A H01.
Механізм дії. Целекоксиб має знеболювальні, протизапальні й жарознижувальні властивості. Вважається, що механізм його дії пов’язаний з інгібуванням синтезу простагландинів, переважно шляхом інгібування циклооксигенази-2.
Показання. Симптоматичне лікування остеоартриту, ревматоїдного артриту й анкілозивного спондиліту (див. розділ «Особливості застосування»). Лікування гострого болю в дорослих пацієнтів (див. розділ «Особливості застосування»). Лікування первинної дисменореї (див. розділ «Особливості застосування»).
Спосіб застосування та дози. Лікарський засіб призначений для перорального застосування. Капсули можна приймати незалежно від вживання їжі.
Остеоартрит. Лікарський засіб застосовувати в дозі 200 мг 1 раз на добу або в дозі 100 мг 2 рази на добу.
Ревматоїдний артрит. Лікарський засіб застосовувати в дозі 100–200 мг 2 рази на добу.
Анкілозуючий спондиліт. Лікарський засіб застосовувати в дозі 200 мг, яку слід приймати одразу (прийом 1 раз на добу) або ділити (прийом 2 рази на добу).
Якщо протягом 6 тижнів не спостерігається позитивного ефекту, дозу можна збільшити до 400 мг на добу.
Інформація про спосіб та особливості застосування препарату, склад, взаємодію з іншими препаратами, фармакологічні властивості, а також повний перелік протипоказань і побічних реакцій міститься в інструкції для медичного застосування препарату Лекокса від 23.03.2021 № 548, РП № UA 18644/01/01, 18644/01/02.
Наявні дані літератури щодо лікування хронічного БНЧС свідчать про те, що НПЗЗ продемонстрували статистично значуще, але клінічно незначне покращання порівняно з плацебо. Короткочасне застосування НПЗЗ вважається відносно безпечним, у той час як тривале використання призводить до розвитку значних побічних ефектів [42].
Міорелаксанти часто призначають при лікуванні БНЧС із підозрою на міофасціальне походження. Систематичний огляд ефективності міорелаксантів у терапії пацієнтів з БНЧС виявив лише короткочасні аналгетичні переваги останніх [58]. За умови нейропатичного болю немає жодних доказів, які б підтримували використання міорелаксантів [59]. Крім того, слід пам’ятати, що міорелаксанти мають значний потенціал щодо можливого розвитку сонливості й залежності. Отже, немає доказів користі тривалого застосування міорелаксантів для лікування пацієнтів з БНЧС, ці препарати слід застосовувати протягом короткого періоду часу в пацієнтів з вираженими й частими м’язовими спазмами, що супроводжують БНЧС [60].
Габапентин і прегабалін зазначені як препарати першої лінії для лікування нейропатичного болю в більшості рекомендацій [61]. Габапентиноїди мають знеболювальну активність через дію на субодиниці альфа-2-дельта-2 вольтажзалежних кальцієвих каналів, що розташовані на пресинаптичних рецепторах аферентних нейронів. Зважаючи на те, що нейропатичні механізми відіграють роль у причинно-наслідкових зв’язках щодо виникнення попереково-крижового корінцевого болю і нейрогенної переміжної кульгавості, пацієнтам часто призначають габапентиноїди для лікування цих станів. Систематичні огляди, у яких проаналізовано результати клінічних випробувань щодо ефективності габапентиноїдів при хронічному БНЧС із корінцевим компонентом або без нього, не показали вірогідної переваги габапентиноїдів порівняно з плацебо або іншими аналгетиками [62]. Слід також зважати на можливі побічні ефекти на тлі застосування даних препаратів у вигляді сплутаності свідомості, запаморочення, втоми й порушення зору [62]. Рекомендоване застосування цих препаратів у терапевтичних дозах до 4 тижнів з подальшим припиненням у разі відсутності ефекту [60].
Трициклічні антидепресанти й інгібітори зворотного захвату серотоніну і норадреналіну часто призначають пацієнтам із хронічним БНЧС з метою знеболювання, усунення депресії, занепокоєння й безсоння [60]. У недавньому систематичному аналізі фармакотерапії БНЧС не виявлено переваг від застосування антидепресантів порівняно з плацебо щодо знеболюючої дії. Однак у разі використання дулоксетину встановлено вірогідний знеболюючий вплив і функціональне покращання в пацієнтів із хронічним БНЧС порівняно з плацебо, у той же час були також виявлені підвищені ризики відміни препарату, пов’язані з побічними ефектами [48]. Відповідно до сучасних уявлень можна застосовувати трициклічні антидепресанти й інгібітори зворотного захвату серотоніну та адреналіну пацієнтам з нейропатичним БНЧС з поступовою відміною через 2–4 тижні у разі відсутності терапевтичного ефекту [60].
Наркотичні аналгетики належать до ліків, що відпускаються за рецептом і часто використовуються при хронічному БНЧС [43], у той же час тривале їх застосування асоціюється з підвищеним ризиком зловживання й передозування. У систематичних оглядах літератури виявлено докази короткочасної їх ефективності (помірної — для болю й невеликої — для функції) порівняно з плацебо [48, 63], водночас встановлено, що вони не-однозначно впливали на якість життя пацієнтів, покращуючи лише фізичний стан, без впливу на психічний [64]. Відповідно до даних літератури наркотичні аналгетики можна безпечно застосовувати для хронічного рефрактерного БНЧС у ретельно відібраних пацієнтів за умови обмеженого дозування з урахуванням відсутності вагомих доказів користі від тривалої опіоїдної терапії і високої імовірності виникнення серйозних побічних ефектів [60, 65, 66]. В окремих дослідженнях продемонстрована ефективність знеболювання при застосуванні нових наркотичних аналгетиків (цебранопадолу) зі значним і клінічно значущим покращанням болю порівняно з плацебо (порівняно з тапентадолом), а також покращанням сну й функціональності в пацієнтів з хронічним БНЧС, при цьому також спостерігалася низька частота побічних ефектів [67].
На сьогодні потребує подальшого дослідження застосування в терапії хронічного БНЧС таких засобів, як канабіноїди, кетамін і ботулотоксин, ефективність яких уже було оцінено в клінічних дослідженнях. Зокрема, відповідно до даних окремих авторів, застосування абоботулотоксину А в лікуванні хронічного БНЧС сприяло вірогідному зменшенню болю й покращанню якості життя в пацієнтів порівняно з плацебо [68]. В іншому дослідженні ін’єкції ботулотоксину типу А в паравертебральні м’язи не виявилися ефективними для полегшення хронічного БНЧС, хоча негативний результат пов’язують з обмеженою кількістю включених пацієнтів і низькими дозами ботулотоксину [69]. Більш високі дози (> 200 одиниць на сеанс із 40–50 одиницями на одне місце введення) можуть зменшити інтенсивність БНЧС і покращити якість життя пацієнтів. Знеболюючий ефект ботулотоксину типу А опосередкований хімічною денервацією місцевих м’язів і пригніченням вивільнення нейромедіаторів болю й запалення. Добра клінічна відповідь на першу ін’єкцію передбачає відповідь на повторне введення ботулотоксину. У той же час пацієнти, які приймають опіоїди, не реагують так само добре, як пацієнти, які раніше не отримували опіоїди, на введення ботулотоксину типу А [60]. Стосовно додавання кетаміну до стероїдів у лікуванні БНЧС окремими авторами виявлено переваги такої терапії у вигляді зменшення болю й інвалідизації пацієнтів, хоча в даному дослідженні не було групи плацебо [70]. Однак слід зазначити, що епідуральне введення кетаміну може дати нейротоксичний ефект [60].
Призначення бісфосфонатів для лікування хронічного БНЧС приводило до значного зменшення болю й покращання функції [71]. Слід зазначити, що новіші бісфосфонати потребують менш частого введення й приводять до зменшення інтенсивності БНЧС у короткостроковій перспективі, можуть збільшити мінеральну щільність кісткової тканини. Водночас при їх введенні спостерігаються реакції гострої фази у вигляді лихоманки, грипоподібних симптомів, артралгії [72].
Застосування канабіноїдів виявилося ефективним у лікуванні рефрактерного БНЧС у поєднанні зі стимуляцією спинного мозку [73]. Також канабідіол у вигляді ін’єкції в запалені міжхребцеві диски послаблює дегенерацію у відповідь на індуковану травму, а тому може використовуватись у лікуванні дегенеративних захворювань міжхребцевого диска [74]. У той же час не слід забувати про побічні ефекти канабіноїдів, такі як запаморочення, сонливість, дефіцит уваги, сухість у роті, головний біль, мігрень, нудота, блювання, серцебиття, забудькуватість, затримка сечі, втома, утруднення рівноваги, міалгії, слабкість, припливи [60].
З комплексного підходу до лікування хронічного БНЧС не варто виключати нефармакологічні підходи до лікування, такі як фізіотерапія, психотерапія [1].
Отже, відповідно до сучасних настанов щодо лікування хронічного БНЧС, який триває понад 3 місяці, застосовуються наступні рекомендації [62, 75–78]:
1. За необхідності проводяться діагностичні обстеження й розробляється комплексний план лікування й реабілітації у співпраці лікарів різних спеціальностей.
2. Є корисним інтенсивне фізичне навантаження як частина міждисциплінарної реабілітації для зменшення частоти рецидивів.
3. Нестероїдні протизапальні препарати, опіоїди й топірамат більш ефективні, ніж плацебо, при короткочасному лікуванні неспецифічних хронічних болів у попереку (доказ A).
4. Ацетамінофен, антидепресанти (за винятком дулоксетину), лідокаїнові пластири й черезшкірна електрична стимуляція нервів не завжди ефективніші, ніж плацебо, при лікуванні хронічного болю в попереку. Дулоксетин може пом’якшувати хронічний біль у попереку краще, ніж плацебо, і його ефективність при хронічному болю у попереку можна порівняти з НПЗЗ і трамадолом (доказ В).
5. Габапентин і топірамат можуть пом’якшувати невропатичний біль.
6. Інтенсивне навчання пацієнтів, що включає поради залишатися активними, уникати обтяжливих рухів і якомога швидше повернутися до нормальної діяльності, а також обговорення частого доброякісного характеру болю в попереку є ефективним у пацієнтів з неспецифічним болем (доказ В).
Отже, призначення адекватної та ефективної фармакотерапії для лікування пацієнтів з хронічним БНЧС часто є справжнім викликом для лікарів. Саме тому терапія болю в спині повинна базуватися на розумінні патофізіологічних механізмів, що лежать в основі розвитку останнього, враховувати якість, інтенсивність болю, а не лише мати симптоматичну спрямованість. У разі призначення лікування необхідно враховувати терапію супутніх коморбідних станів. Усе вищезазначене дасть змогу оптимізувати лікування хронічного БНЧС.
Конфлікт інтересів. Стаття підготовлена за підтримки фармакологічної компанії World Medicine.
Отримано/Received 13.10.2021
Рецензовано/Revised 27.10.2021
Прийнято до друку/Accepted 02.11.2021
Список литературы
1. Malmivaara A., Pohjolainen T., Hirvensalo E., Jousimaa J. Настанова 00435. Біль у попереку 2017. Настанови на засадах доказової медицини. Створені DUODECIM Medical Publications, Ltd. Адаптовані для України групою експертів МОЗ України. 2017. URL: guidelines.moz.gov.ua.
2. Speed C. ABC of rheumatology Low back pain. BMJ. 2004. P. 1119-21. doi: 10.1136/bmj.328.7448.1119.
3. Manfrè L., Van Goethem J. Low Back Pain. 2020. Feb 15. In: Hodler J., Kubik-Huch R.A., von Schulthess G.K., editors. Diseases of the Brain, Head and Neck, Spine 2020–2023: Diagnostic Imaging. Cham (CH): Springer, 2020. Chapter 18. https://www.ncbi.nlm.nih.gov/books/NBK554336. doi: 10.1007/978-3-030-38490-6_18.
4. Deyo R.A., Weinstein JN. Low back pain. N. Engl. J. Med. 2001. 344. P. 363-70. doi: 10.1056/NEJM200102013440508.
5. Hoy D., March L., Brooks P. et al. The global burden of low back pain: estimates from the global burden of disease 2010 study. Ann. Rheum. Dis. 2014. 73. P. 968-74. doi: 10.1136/annrheumdis-2013-204428.
6. Vos T., Allen C., Arora M., Barber R.M., Brown A., Carter A. et al. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the global burden of disease study 2015. Lancet. 2016. 388(10053). P. 1545-602. doi: 10.1016/S0140-6736(16)31678-6.
7. Deyo R.A., Dworkin S.F., Amtmann D. et al. Report of the NIH task force on research standards for chronic low back pain. Phys. Ther. 2015. 95(2). e1-18. doi: 10.2522/ptj.2015.95.2.e1.
8. Hoy D., Brooks P., Blyth F., Buchbinder R. The epidemiology of low back pain. Best Pract. Res. Clin. Rheumatol. 2010. 24(6). 769-81. doi: 10.1016/j.berh.2010.10.002.
9. Mattle H., Mumenthaler M. Fundamentals of Neurology: An Illustrated Guide. 2nd ed. Berlin: Thieme, 2017. 456 p.
10. Will J.S., Bury D.C., Miller J.A. Mechanical Low Back Pain. Am. Fam. Physician. 2018. 98(7). P. 421-428. PMID: 30252425.
11. Patrick N., Emanski E., Knaub M.A. Acute and chronic low back pain. Med. Clin. North Am. 2014. 98(4). P. 777-789. doi: 10.1016/j.mcna.2014.03.005.
12. Casazza B.A. Diagnosis and treatment of acute low back pain. Am. Fam. Physician. 2012. 85(4). P. 343-350. PMID: 22335313.
13. McIntosh G., Hall H. Low back pain (acute). BMJ Clin. Evid. 2011. 1102. PMID: 21549023; PMCID: PMC3217769.
14. Henschke N., Maher C.G., Refshauge K.M. et al. Prevalence of and screening for serious spinal pathology in patients presenting to primary care settings with acute low back pain. Arthritis Rheum. 2009. 60(10). P. 3072-3080. doi: 10.1002/art.24853.
15. Balagué F., Mannion A.F., Pellisé F., Cedraschi C. Non-specific low back pain. Lancet. 2012. 379(9814). P. 482-491. doi: 10.1016/S0140-6736(11)60610-7.
16. Coccolini F., Stahel P.F., Montori G. et al. Pelvic trauma: WSES classification and guidelines. World J. Emerg. Surg. 2017. 12. 5. doi: 10.1186/s13017-017-0117-6.
17. Dydyk A.M., Forro S.D., Hanna A. Sacroiliac Joint Injury. [Updated 2021 Jul 12]. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan. https://www.ncbi.nlm.nih.gov/books/NBK557881.
18. Ivanov A.A. Lumbar fusion leads to increases in angular motion and stress across sacroiliac joint: a finite element study. Spine. 2009. 34(5). 162-9. doi: 10.1097/BRS.0b013e3181978ea3.
19. Hansen H., Manchikanti L., Simopoulos T.T. et al. A systematic evaluation of the therapeutic effectiveness of sacroiliac joint interventions. Pain Physician. 2012. 15(3). E247-78. PMID: 22622913.
20. Bower A., Flemming D. Chapter 7: the Sacroiliac Joint. Arthritis in Black and White. Philadelphia: Elsevier, 2012.
21. Montandon C., Costa M.A.B., Carvalho T.N. et al. Sacroiliitis: imaging evaluation. Radiol. Bras. 2007. 40(1). 53-60.
22. Antonelli M.J., Magrey M. Sacroiliitis mimics: a case report and review of the literature. BMC Musculoskelet Disord. 2017. 18(1). 170. doi: 10.1186/s12891-017-1525-1.
23. Sykes M.P., Doll H., Sengupta R., Gaffney K. Delay to diagnosis in axial spondyloarthritis: are we improving in the UK? Rheumatology (Oxford). 2015. 54(12). 2283-4. doi: 10.1093/rheumatology/kev288.
24. National Institute for Health and Care Excellence (UK). Spondyloarthritis in over 16s: diagnosis and management. London: National Institute for Health and Care Excellence (UK), 2017. PMID: 28350428.
25. Bashir M.T., Iversen L., Burton C. Clinical features in primary care electronic records before diagnosis of ankylosing spondylitis: a nested case-control study. BMC Fam. Pract. 2020. 21(1). 78. doi: 10.1186/s12875-020-01149-2.
26. Olivieri I., D’Angelo S., Palazzi C., Padula A., Mader R., Khan M.A. Diffuse idiopathic skeletal hyperostosis: differentiation from ankylosing spondylitis. Curr. Rheumatol. Rep. 2009. (5). 321-8. doi: 10.1007/s11926-009-0046-9.
27. Mitra R. Osteitis Condensans Ilii. Rheumatol. Int. 2010. 30(3). 293-6. doi: 10.1007/s00296-009-1100-7.
28. Cidem M., Capkin E., Karkucak M., Karaca A. Osteitis condensans ilii in differential diagnosis of patients with chronic low back pain: a review of the literature. Mod. Rheumatol. 2012. 22(3). 467-9. doi: 10.1007/s10165-011-0513-9.
29. Thompson M. Osteitis condensans ilii and its differentiation from ankylosing spondylitis. Ann. Rheum. Dis. 1954. 13(2). 147-56. doi: 10.1136/ard.13.2.147.
30. Tuite M.J. Sacroiliac joint imaging. Semin. Musculoskelet. Radiol. 2008. 12(1). 72-82. doi: 10.1055/s-2008-1067939.
31. Abid H., Chaabouni S., Frikha F. et al. Contribution of imaging in the diagnosis of infectious sacroiliitis: about 19 cases. Pan. Afr. Med. J. 2014. 17. 171. doi: 10.11604/pamj.2014.17.171.2716.
32. Galińska E.M., Zagórski J. Brucellosis in humans — etiology, diagnostics, clinical forms. Ann. Agric. Environ. Med. 201. 20(2). 233-8. PMID: 23772567.
33. Rubach M.P., Halliday J.E., Cleaveland S., Crump J.A. Brucellosis in low-income and middle-income countries. Curr. Opin. Infect. Dis. 2013. 26(5). 404-12. doi: 10.1097/QCO.0b013e3283638104.
34. Bozgeyik Z., Aglamis S., Bozdag P.G., Denk A. Magnetic resonance imaging findings of musculoskeletal brucellosis. Clin. Imaging. 2014. 38(5). 719-23. doi: 10.1016/j.clinimag.2014.04.007.
35. Binicier O., Sari I., Sen G., Onen F., Akkoc N., Manisali M., Akar S. Axial sarcoidosis mimicking radiographic sacroiliitis. Rheumatol. Int. 2009. 29(3). 343-5. doi: 10.1007/s00296-008-0677-6.
36. Briongos-Figuero L.S., Ruiz-de-Temiño Á., Pérez-Castrillón J.L. Sarcoidosis and sacroiliitis, a case report. Rheumatol. Int. 2012. 32(9). 2949-50. doi: 10.1007/s00296-011-2100-y.
37. Seton M. Paget disease of bone: diagnosis and drug therapy. Cleve Clin. J. Med. 2013. 80(7). 452-62. doi: 10.3949/ccjm.80a.12142.
38. Bezza A., Lechevalier D., Monréal M., el Maghraoui A., Magnin J., Eulry F. Sacro-iliac involvement in he course of Paget disease. Report of 6 cases. Presse Med. 1999. 19. 28(22). 1157-9. PMID: 10414238.
39. Rego M.H., Nagiah S. Over-imaging in uncomplicated low back pain: a 12-month audit of a general medical unit. Intern. Med. J. 2016. 46(12). 1437-1439. doi: 10.1111/imj.13279.
40. Avoundjian T., Gidwani R., Yao D. et al. Evaluating Two Measures of Lumbar Spine MRI Overuse: Administrative Data Versus Chart. Review. J. Am. Coll. Radiol. 2016. 13(9). 1057-66. doi: 10.1016/j.jacr.2016.04.013.
41. Romanò C.L., Romanò D., Lacerenza M. Antineuropathic and antinociceptive drugs combination in patients with chronic low back pain: a systematic review. Pain. Res. Treat. 2012. 2012. 154781. doi: 10.1155/2012/154781.
42. Peck J., Urits I., Peoples S. et al. Comprehensive Review of Over the Counter Treatment for Chronic Low Back Pain. Pain Ther. 2021. 10(1). 69-80. doi: 10.1007/s40122-020-00209-w.
43. Shmagel A., Ngo L., Ensrud K., Foley R. Prescription Medication Use Among Community-Based U.S. Adults With Chronic Low Back Pain: A Cross-Sectional Population Based Study. J. Pain. 2018. 19(10). 1104-1112. doi: 10.1016/j.jpain.2018.04.004.
44. McCrae J.C., Morrison E.E., MacIntyre I.M., Dear J.W., Webb D.J. Long-term adverse effects of paracetamol — a review. Br. J. Clin. Pharmacol. 2018. 84(10). 2218-2230. doi: 10.1111/bcp.13656.
45. Machado G.C., Maher C.G., Ferreira P.H. et al. Efficacy and safety of paracetamol for spinal pain and osteoarthritis: systematic review and meta-analysis of randomised placebo controlled trials. BMJ. 2015. 31. 350. h1225. doi: 10.1136/bmj.h1225.
46. Ostojic P., Radunovic G., Lazovic M., Tomanovic-Vujadinovic S. Ibuprofen plus paracetamol versus ibuprofen in acute low back pain: a randomized open label multicenter clinical study. Acta Reumatol. Port. 2017. 42(1). 18-25. PMID: 27978532.
47. Tetsunaga T., Tetsunaga T., Tanaka M. et al. Effect of Tramadol/Acetaminophen on Motivation in Patients with Chronic Low Back Pain. Pain Res. Manag. 2016. 2016. 7458534. doi: 10.1155/2016/7458534.
48. Chou R., Deyo R., Friedly J. et al. Systemic Pharmacologic Therapies for Low Back Pain: A Systematic Review for an American College of Physicians Clinical Practice Guideline. Ann. Intern. Med. 2017. 4. 166(7). 480-492. doi: 10.7326/M16-2458.
49. Qaseem A., Wilt T.J., McLean R.M. et al. Noninvasive Treatments for Acute, Subacute, and Chronic Low Back Pain: A Clinical Practice Guideline From the American College of Physicians. Ann. Intern. Med. 2017. 4. 166(7). 514-530. doi: 10.7326/M16-2367.
50. Aschenbrenner D.S. Cardiovascular Risk of Celecoxib no Worse Than That of Ibuprofen or Naproxen. Am. J. Nurs. 2018. 118(10). 19. doi: 10.1097/01.NAJ.0000546372.43432.fb. PMID: 30260880.
51. Kearney P.M., Baigent C., Godwin J., Halls H., Emberson J.R., Patrono C. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. BMJ. 2006 Jun 3. 332(7553). 1302-8. doi: 10.1136/bmj.332.7553.1302.
52. Silverstein F.E., Faich G., Goldstein J.L. et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA. 2000. 13. 284(10). 1247-55. doi: 10.1001/jama.284.10.1247.
53. Dulai P.S., Singh S., Marquez E., Khera R., Prokop L.J., Limburg P.J., Gupta S., Murad M.H. Chemoprevention of colorectal cancer in individuals with previous colorectal neoplasia: systematic review and network meta-analysis. BMJ. 2016. 5. 355. i6188. doi: 10.1136/bmj.i6188.
54. Veettil S.K., Nathisuwan S., Ching S.M. et al. Efficacy and safety of celecoxib on the incidence of recurrent colorectal adenomas: a systematic review and meta-analysis. Cancer Manag. Res. 2019. 11. 561-571. doi:10.2147/CMAR.S180261.
55. Enthoven W.T., Roelofs P.D., Deyo R.A., van Tulder M.W., Koes B.W. Non-steroidal anti-inflammatory drugs for chronic low back pain. Cochrane Database Syst. Rev. 2016. 10. 2(2). CD012087. doi: 10.1002/14651858.CD012087.
56. Romanò C.L., Romanò D., Bonora C., Mineo G. Pregabalin, celecoxib, and their combination for treatment of chronic low-back pain. J. Orthop. Traumatol. 2009. 10(4). 185-91. doi: 10.1007/s10195-009-0077-z.
57. O’Donnell J.B., Ekman E.F., Spalding W.M., Bhadra P., McCabe D., Berger M.F. The effectiveness of a weak opioid medication versus a cyclo-oxygenase-2 (COX-2) selective non-steroidal anti-inflammatory drug in treating flare-up of chronic low-back pain: results from two randomized, double-blind, 6-week studies. J. Int. Med. Res. 2009. 37(6). 1789-802. doi: 10.1177/147323000903700615.
58. Abdel Shaheed C., Maher C.G., Williams K.A., McLachlan A.J. Efficacy and tolerability of muscle relaxants for low back pain: Systematic review and meta-analysis. Eur. J. Pain. 2017. 21(2). 228-237. doi: 10.1002/ejp.907.
59. Cohen S.P. Benzodiazepines for neuropathic back pain: when the cure is worse than the disease. Pain. 2010. 149(3). 424-425. doi: 10.1016/j.pain.2010.03.038.
60. Bhatia A., Engle A., Cohen S.P. Current and future pharmacological agents for the treatment of back pain. Expert Opin. Pharmacother. 2020. 21(8). 857-861. doi: 10.1080/14656566.2020.1735353.
61. Moulin D., Boulanger A., Clark A.J. et al. Canadian Pain Society. Pharmacological management of chronic neuropathic pain: revised consensus statement from the Canadian Pain Society. Pain Res. Manag. 2014. 19(6). 328-35. doi: 10.1155/2014/754693.
62. Shanthanna H., Gilron I., Rajarathinam M. et al. Benefits and safety of gabapentinoids in chronic low back pain: A systematic review and meta-analysis of randomized controlled trials. PLoS Med. 2017. 15. 14(8). e1002369. doi: 10.1371/journal.pmed.1002369.
63. Chaparro L.E., Furlan A.D., Deshpande A., Mailis-Gagnon A., Atlas S., Turk D.C. Opioids compared with placebo or other treatments for chronic low back pain: an update of the Cochrane Review. Spine (Phila Pa 1976). 2014. 1. 39(7). 556-63. doi: 10.1097/BRS.0000000000000249.
64. Thornton J.D., Goyat R., Dwibedi N., Kelley G.A. Health-related quality of life in patients receiving long-term opioid therapy: a systematic review with meta-analysis. Qual. Life Res. 2017. 26(8). 1955-1967. doi: 10.1007/s11136-017-1538-0.
65. Abdel Shaheed C., Maher C.G., Williams K.A., Day R., McLachlan A.J. Efficacy, Tolerability, and Dose-Dependent Effects of Opioid Analgesics for Low Back Pain: A Systematic Review and Meta-analysis. JAMA Intern. Med. 2016. 1. 176(7). 958-68. doi: 10.1001/jamainternmed.2016.1251.
66. Petzke F., Klose P., Welsch P., Sommer C., Häuser W. Opioids for chronic low back pain: An updated systematic review and meta-analysis of efficacy, tolerability and safety in randomized placebo-controlled studies of at least 4 weeks of double-blind duration. Eur. J. Pain. 2020. 24(3). 497-517. doi: 10.1002/ejp.1519.
67. Christoph A., Eerdekens M.H., Kok M., Volkers G., Freynhagen R. Cebranopadol, a novel first-in-class analgesic drug candidate: first experience in patients with chronic low back pain in a randomized clinical trial. Pain. 2017. 158(9). 1813-1824. doi: 10.1097/j.pain.0000000000000986.
68. Machado D., Kumar A., Jabbari B. Abobotulinum Toxin A in the Treatment of Chronic Low Back Pain. Toxins (Basel). 2016. 8(12). 374. Published 2016 Dec 15. doi:10.3390/toxins8120374.
69. Cogné M., Petit H., Creuzé A., Liguoro D., de Seze M. Are paraspinous intramuscular injections of botulinum toxin a (BoNT-A) efficient in the treatment of chronic low-back pain? A randomised, double-blinded crossover trial. BMC Musculoskelet Disord. 2017. 15. 18(1). 454. doi: 10.1186/s12891-017-1816-6.
70. Amr Y.M. Effect of addition of epidural ketamine to steroid in lumbar radiculitis: one-year follow-up. Pain Physician. 2011. 14(5). 475-81. Erratum in: Pain Physician. 2018. 21(5). 505. PMID: 21927052.
71. Pappagallo M., Breuer B., Lin H.M. et al. A pilot trial of intravenous pamidronate for chronic low back pain. Pain. 2014. 155(1). 108-117. doi: 10.1016/j.pain.2013.09.016.
72. Sakai A., Ikeda S., Okimoto N. et al. Clinical efficacy and treatment persistence of monthly minodronate for osteoporotic patients unsatisfied with, and shifted from, daily or weekly bisphosphonates: the BP-MUSASHI study. Osteoporos Int. 2014. 25(9). 2245-53. doi: 10.1007/s00198-014-2756-8.
73. Mondello E., Quattrone D., Cardia L. et al. Cannabinoids and spinal cord stimulation for the treatment of failed back surgery syndrome refractory pain. J. Pain Res. 2018. 6. 11. 1761-1767. doi: 10.2147/JPR.S166617.
74. Silveira J.W., Issy A.C., Castania V.A. et al. Protective effects of cannabidiol on lesion-induced intervertebral disc degeneration. PLoS One. 2014. 17. 9(12). e113161. doi: 10.1371/journal.pone.0113161.
75. Saragiotto B.T., Machado G.C., Ferreira M.L. et al. Paracetamol for low back pain. Cochrane Database Syst. Rev. 2016. 7. 2016(6). CD012230. doi: 10.1002/14651858.CD012230.
76. Roelofs P.D., Deyo R.A., Koes B.W., Scholten R.J., van Tulder M.W. Non-steroidal anti-inflammatory drugs for low back pain. Cochrane Database Syst. Rev. 2008. 23(1). CD000396. doi: 10.1002/14651858.CD000396.
77. Urquhart D.M., Hoving J.L., Assendelft W.W., Roland M., van Tulder M.W. Antidepressants for non-specific low back pain. Cochrane Database Syst. Rev. 2008. 23. 2008(1). CD001703. doi: 10.1002/14651858.CD001703.
78. Engers A., Jellema P., Wensing M., van der Windt D.A., Grol R., van Tulder M.W. Individual patient education for low back pain. Cochrane Database Syst. Rev. 2008. 23. 2008(1). CD004057. doi: 10.1002/14651858.CD004057.

/12.jpg)
/13.jpg)