Архив офтальмологии Украины Том 10, №1, 2022
Вернуться к номеру
Ризик виникнення післяопераційного гемофтальму у хворих з діабетичною ретинопатією та цукровим діабетом 2-го типу
Авторы: Риков С.О., Литвиненко С.С.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
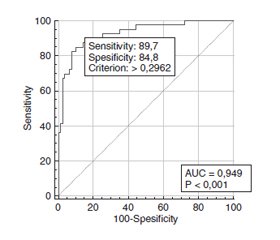
Актуальність. Пошкодження судин, що розвивається при діабетичній ретинопатії (ДР), є прямим наслідком стійкої гіперглікемії за умов цукрового діабету 2-го типу (ЦД2) та супроводжується як спонтанним гемофтальмом, так і гемофтальмом після виконання сучасних вітреоретинальних втручань з приводу ДР та діабетичної макулопатії. Мета: оцінити ризики виникнення післяопераційного гемофтальму у хворих з діабетичною ретинопатією та цукровим діабетом 2-го типу. Матеріали та методи. У дослідженні взяли участь 118 пацієнтів (118 очей) з ЦД2 та ДР, які були розподілені на три групи: 1-ша — з початковою непроліферативною ДР (НПДР; 28 очей), 2-га — з помірною або тяжкою НПДР (49 очей) та 3-тя — з проліферативною ДР (ПДР; 41 око). Вік пацієнтів становив від 44 до 84 років, чоловіків було 52 (44,1 %), жінок — 66 (55,9 %). Усім пацієнтам була виконана закрита субтотальна вітректомія 25+ з тампонадою газоповітряною сумішшю, пілінгом внутрішньої пограничної мембрани та панретинальною лазерною коагуляцією. Пацієнтів обстежували за стандартним протоколом клінічних та офтальмологічних досліджень. Для побудови математичних моделей використано пакет EZR v. 1.54 (графічний інтерфейс до R statistical software v. 4.0.3, R Foundation for Statistical Computing, Відень, Австрія). Результати. Протягом трьох місяців після вітректомії післяопераційний гемофтальм розвинувся у 33,1 % пацієнтів. Шляхом побудови однофакторних моделей логістичної регресії було встановлено, що на ризик виникнення післяопераційного гемофтальму позитивно впливали (p < 0,05): вік (ВШ = 1,18; 95% ВІ 1,10–1,26), тривалість ЦД2 (ВШ = 1,06; 95% ВІ 1,01–1,18), наявність доопераційного гемофтальму (ВШ = 5,66; 95% ВІ 1,05–30,6) та рівень HbA1с у крові (ВШ = 1,40; 95% ВІ 1,20–1,64). Також була побудована багатофакторна логістична регресійна модель прогнозу післяопераційного гемофтальму, до якої увійшли вік, стадія ДР, а також ступінь компенсації ЦД2 за рівнем HbA1с у крові та вміст HbA1с у крові. Поріг прийняття рішення моделі становив Ycrit = 0,296, при цьому чутливість дорівнювала 89,7 % (95% ВІ 75,8–97,1 %), специфічність — 84,8 % (95% ВІ 75,0–91,9 %). Висновки. 1. Установлено, що на ризик виникнення гемофтальму після сучасних вітреоретинальних втручань у пацієнтів з ДР, діабетичною макулопатією та ЦД2 позитивно впливали (p < 0,05): вік (ВШ = 1,18; 95% ВІ 1,10–1,26), тривалість ЦД2 (ВШ = 1,06; 95% ВІ 1,01–1,18), наявність доопераційного гемофтальму (ВШ = 5,66; 95% ВІ 1,05–30,6) та вміст у крові HbA1с (ВШ = 1,40; 95% ВІ 1,20–1,64). 2. До багатофакторної логістичної регресійної моделі прогнозу післяопераційного гемофтальму увійшли чотири факторні ознаки: вік, стадія ДР, а також ступінь компенсації ЦД2 за вмістом у крові HbA1с та вміст у крові HbA1с. Поріг прийняття рішення моделі становив Ycrit = 0,296, при цьому чутливість дорівнювала 89,7 % (95% ВІ 75,8–97,1 %), специфічність — 84,8 % (95% ВІ 75,0–91,9 %).
Background. The vascular disruption, which develops in diabetic retinopathy (DR), is a direct consequence of the persistent hyperglycemia on the background of type 2 diabetes mellitus (DM2) and is accompanied both by an idiopathic hemophthalmos and a hemophthalmos after advanced vitreoretinal surgeries for DR or diabetic maculopathy. The study was aimed to assess risks of post-operative hemophthalmos emergence in cases of diabetic retinopathy and type 2 diabetes mellitus. Materials and methods. The study included 118 patients (118 eyes) with DM2 and DR. They were divided into 3 groups. Group I consisted of patients with mild non-proliferative DR (NPDR; 28 eyes); II group included moderate to severe NPDR (49 eyes); group III included patients with proliferative DR (PDR; 41 eyes). The patients’ age varied between 44 and 84 years; 52 men (44.1 %) and 66 women (55.9 %). All patients underwent 25+ closed subtotal vitrectomy with gas as air tamponade, internal limiting membrane peeling, and panretinal photocoagulation. EZR v.1.54 package was used to build mathematical models (graphic interface for R statistical software v.4.0.3, R Foundation for Statistical Computing, Vienna, Austria). Results. Within 3 months after vitrectomy, a post-operative hemophthalmos developed in 33.1 % of cases. Through a one-factor logistic regression modelling, it was found that the risk of post-operative hemophthalmos was positively correlated (p < 0.05) with: age (OR = 1.18; 95% IR 1.10–1.26), DM2 duration (OR = 1.06; 95% IR 1.01–1.18), presence of pre-surgical hemophthalmos (OR = 5.66; 95% IR 1.05–30.6), and blood level of HbA1c (OR = 1.40; 95% IR 1.20–1.64). Moreover, a multi-factor logistic regression model for post-operative hemophthalmos prognosis was developed, which included age, DR stage, improvement ratio of the DM2 status as per blood level of HbA1c, and HbA1c blood level. The model decision threshold was Ycrit = 0.296, with sensitivity level of 89.7 % (95% IR 75.8–97.1 %), specificity level of 84.8 % (95% IR 75.0–91.9 %). Conclusions. 1. It was determined that the risk of hemophthalmos emergence after advanced vitreoretinal surgery for DR, DMP, and DM2 was positively correlated (p < 0.05) with: age (OR = 1.18; 95% IR 1.10–1.26), DM2 duration (OR = 1.06; 95% IR 1.01–1.18), presence of pre-surgical hemophthalmos (OR = 5.66; 95% IR 1.05–30.6), and blood level of HbA1c (OR = 1.40; 95% IR 1.20–1.64). 2. The multi-factor logistic regression model of hemophthalmos prognosis after vitreoretinal surgeries included four factor features: age and DR stage, as well as improvement ratio of the DM2 status as per blood level of HbA1c, and HbA1c blood level. The model decision threshold was Ycrit = 0.296, with sensitivity level of 89.7 % (95% IR 75.8–97.1%), specificity level of 84.8 % (95% IR 75.0–91.9 %).
закрита субтотальна вітректомія; післяопераційний гемофтальм; прогноз; діабетична ретинопатія; діабетична макулопатія; цукровий діабет 2-го типу
closed subtotal vitrectomy; post-operative hemophthalmos; prognosis; diabetic retinopathy; diabetic maculopathy; type 2 diabetes mellitus
Вступ
Матеріали та методи
Результати та обговорення
/27_2.jpg)
/28_2.jpg)
Висновки
- Kowall B., Rathmann W., Stang A., Bongaerts B., Kuss O., Herder C. et al. Perceived risk of diabetes seriously underestimates actual diabetes risk: The KORA FF4 study. PLoS One. 2017. 12(1). e0171152. doi: 10.1371/journal.pone.0171152.
- Ulyte A., Bähler C., Schwenkglenks M., von Wyl V., Gruebner O., Wei W. et al. Measuring diabetes guideline adherence with claims data: systematic construction of indicators and related challenges. BMJ Open. 2019. 9(4). e027138. doi: 10.1136/bmjopen-2018-027138.
- Nentwich M.M., Ulbig M.W. Diabetic retinopathy — ocular complications of diabetes mellitus. World J. Diabetes. 2015 Apr 15. 6(3). 489-99. doi: 10.4239/wjd.v6.i3.489.
- Harding J.L., Pavkov M.E., Magliano D.J., Shaw J.E., Gregg E.W. Global trends in diabetes complications: a review of current evidence. Diabetologia. 2019. 62(1). 3-16. doi: 10.1007/s00125-018-4711-2.
- Thomas R.L., Halim S., Gurudas S., Sivaprasad S., Owens D.R. IDF diabetes atlas: a review of studies utilising retinal photography on the global prevalence of diabetes related retinopathy between 2015 and 2018. Diabetes Res. Clin. Pract. 2019. 157. 107840. doi: 10.1016/j.diabres.2019.107840.
- Nørgaard M.F., Grauslund J. Automated screening for diabetic retinopathy — a systematic review. Ophthalmic Res. 2018. 60(1). 9-17. doi: 10.1159/000486284.
- Treumer F., Roider J. Glaskörperblutung. Wie lange kann man abwarten? [Vitreous body hemorrhage. How long can one wait?]. Ophthalmologe. 2020. 117(9). 866-70. German. doi: 10.1007/s00347-020-01112-7.
- Schmidt-Erfurth U., Garcia-Arumi J., Gerendas B.S., Midena E., Sivaprasad S., Tadayoni R. et al. Guidelines for the management of retinal vein occlusion by the european society of retina specialists (EURETINA). Ophthalmologica. 2019. 242(3). 123-62. doi: 10.1159/000502041.
- Marques R.E., Sousa D.C., Leal I., Faria M.Y., Marques-Neves C. Complete ILM peeling versus inverted flap technique for macular hole surgery: a meta-analysis. Ophthalmic Surg. Lasers Imaging Retina. 2020. 51(3). 187-A2. doi: 10.3928/23258160-20200228-08.
- Taskintuna I., Elsayed M.E., Taskintuna K., Ahmad K., Khandecar R., Schatz P. et al. Comparison of outcomes of four different treatment modalities for diabetic vitreous haemorrhage. Sci. Rep. [Internet]. 2020. 10(3674). doi.org/10.1038/s41598-020-60378-8.
- Ding Y., Yao B., Hang H., Ye Hui. Multiple factors in the prediction of risk of recurrent vitreous haemorrhage after sutureless vitrectomy for non-clearing vitreous haemorrhage in patients with diabetic retinopathy [Internet]. BMC Ophthalmol. 2020. doi.org/10.1186/s12886-020-01532-8.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading Diabetic Retinopathy from Stereoscopic Color Fundus Photographs — An Extension of the Modified Airlie House Classification: ETDRS Report Number 10. Ophthalmology. 2020 Apr. 127(4S). S99-S119. doi: 10.1016/j.ophtha.2020.01.030.
- Pankiv V.I. Cukrovyy diabet: diagnostichny kriteryy, etiologia i patogenez [Diabetes mellitus: diagnostic criteria, etiology and pathogenesis]. International Journal of Endocrinology. 2013. 8(56). 53-64.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant. 2013. 48. 452-8.
- Kim K.E., Yang P.S., Jang E., Kim S., Joung B. Antithrombotic medication and the risk of vitreous hemorrhage in atrial fibrillation: Korean national health insurance service national cohort. Yonsei Med. J. 2019. 60(1). 65-72. doi: 10.3349/ymj.2019.60.1.65.
- Lin H.-C., Yang C.-M., Chen S.-N., Hsieh Y.-T. Vitrectomy with internal limiting membrane peeling versus nonsurgical treatment for diabetic macular edema with massive hard exudates. PLoS One. 2020. 15(7). e0236867. doi.org/10.1371/journal.pone.0236867.
- Forrester J.V., Kuffova L., Delibegovic M. The role of inflammation in diabetic retinopathy. Front Immunol. 2020. 11. 583687. doi: 10.3389/fimmu.2020.583687.
- Kaštelan S., Orešković I., Bišćan F., Kaštelan H., Gverović A.A. Inflammatory and angiogenic biomarkers in diabetic retinopathy. Biochem. Med. (Zagreb). 2020. 30(3). 030502. doi: 10.11613/BM.2020.030502.
- Bapputty R., Talahalli R., Zarini S., Samuels I., Murphy R., Gubitosi-Klug R. Montelukast prevents early diabetic retinopathy in mice. Diabetes. 2019. 68(10). 2004-15. doi: 10.2337/db19-0026.
- Menini S., Iacobini C., Vitale M., Pugliese G. The inflammasome in chronic complications of diabetes and related metabolic disorders. Cells. 2020. 9(8). 1812. doi: 10.3390/cells9081812.
- Gupta A., Bhatnagar S. Vasoregression: a shared vascular pathology underlying macrovascular and microvascular pathologies? OMICS. 2015. 19(12). 733-53. doi: 10.1089/omi.2015.0128.
- Lutty G.A. Diabetic choroidopathy. Vision Res. 2017. 139. 161-67. doi: 10.1016/j.visres.2017.04.011.
- Williams D., Argáez C. Acute, sustained, intraocular pressure increases following anti-vascular endothelial growth factor treatment for retinal conditions: a review of clinical evidence and guidelines [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2019. Available from: https://www.ncbi.nlm.nih.gov/books/NBK545133/
- Senthil S., Dada T., Das T., Kaushik S., Puthuran G.V., Philip R. et al. Neovascular glaucoma — a review. Indian J. Ophthalmol. 2021. 69(3). 525-534. doi: 10.4103/ijo.IJO_1591_20.
- Vaz-Pereira S., Morais-Sarmento T., Esteves Marques R. Optical coherence tomography features of neovascularization in proliferative diabetic retinopathy: a systematic review. Int. J. Retina Vitreous. 2020. 6. 26. doi: 10.1186/s40942-020-00230-3.
- Mahalingam P., Topiwalla T.T., Ganesan G. Vitreous rebleed following sutureless vitrectomy: Incidence and risk factors. Indian J. Ophthalmol. 2018. 66(4). 558-61. doi: 10.4103/ijo.IJO_770_17.

/27.jpg)
/28.jpg)