Вступ
Інфекції сечової системи (ІСС) займають провідні позиції в структурі інфекційних захворювань, поступаючись лише респіраторним інфекціям. Щорічно у світі реєструється близько 150 мільйонів випадків ІСС, на лікування яких витрачається приблизно 6 мільярдів доларів на рік [1–4]. В Україні поширеність ІСС становить близько 40 %, серед них домінуючою ІСС є пієлонефрит. У США реєструється близько 8 мільйонів амбулаторних візитів з приводу ІСС та понад 100 000 госпіталізацій щорічно, частіше за все з приводу пієлонефриту. Більше того, близько 15 % усіх амбулаторно призначених антибіотиків у США припадає на ІСС [4, 5].
Лікування ІСС лімітується формуванням стійкості до антибактеріальних препаратів (АБП) [6]. Згідно зі звітом CDC (Centers for Disease Control and Prevention), у США реєструється близько 2 млн інфекцій та 25 000 смертельних випадків внаслідок антибіотикорезистентних інфекцій [7]. Згідно з даними рапорту Antimicrobial resistance surveillance in Europe 2022 (аналіз даних за 2020 рік), більше ніж 54 % виділених штамів E.coli були резистентними принаймні до одного АБП. У 2020 році найбільший відсоток резистентності встановлено до амінопеніцилінів (54,6 %), фторхінолонів (23,8 %), 3-ї генерації цефалоспоринів (14,9 %) і аміноглікозидів (10,9 %). Резистентність до карбапенемів становила 0,2 % (рис. 1). 87,4 % штамів, резистентних до цефалоспоринів 3-ї генерації, були продуцентами β-лактамаз розширеного спектра дії (ESBLs) [8].
/15.jpg)
Резистентність до цефалоспоринів 3-ї генерації і карбапенемів загалом була вищою у K.pneumoniae, ніж у E.coli. У той час як у більшості країн резистентність до карбапенемів залишалася рідкою для штамів E.coli, 30 % країн рапортують про більше ніж 25 % резистентності у K.рneumoniae. Резистентність до фторхінолонів у штамів E.coli варіювала в діапазоні від 10 до 48,2 % поміж країнами; до цефалоспоринів 3-ї генерації — від 5,8 до 41,4 %; аміноглікозидів — від 5,5 до 34,2 % (рис. 2) [8].
В Україні, згідно з опублікованими даними рапорту Antimicrobial resistance surveillance in Europe 2022, штами E.сoli мали такі рівні резистентності: до амінопеніцилінів — 71,4 %, цефалоспоринів 3-ї генерації — 53,3 %, фторхінолонів — 41,9 %, аміноглікозидів — 35,7 %, карбапенемів — 4,4 %. Комбінована резистентність становила 17,5 % (рис. 3) [8].
За підрахунками, до 2050 року антибіотикорезистентність (АБР) щороку спричинить близько 10 мільйонів смертельних випадків, що призведе до зменшення внутрішнього валового продукту на 2–3,5 % у всьому світі, що коштуватиме до $ 100 трлн [9].
Причини АБР складні та багатокомпонентні, вони охоплюють питання санітарії та гігієни, практику тваринництва, інформованість громадськості та її діяльність, а також дії системи охорони здоров’я. Однак невідповідне призначення АБП є ключовим фактором для виникнення АБР, що обумовлено попитом пацієнтів, вартістю АБП, відсутністю знань про відповідну тактику антибактеріальної терапії у конкретному випадку та/або затримкою лабораторних результатів. Неналежне використання (зловживання або надмірне використання) знижує ефективність АБП і призводить до селекції та поширення резистентних штамів [9].
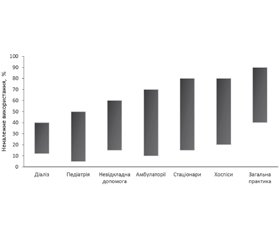
Тільки у 2015 році приблизно 269 мільйонів АБП було видано аптеками амбулаторно у США, тобто кожен п’ятий з шести людей щорічно отримує щонайменше один антибіотик. Близько 30 % цих призначень були непотрібними. Щорічно амбулаторно та в стаціонарах США виписується 47 мільйонів непотрібних рецептів антибіотиків [9] (рис. 4).
Ще у 2013 році CDC опублікувала ініціативний документ Antibiotic Resistance Threats in the United States, у якому відображено 4 стратегії для боротьби з антибіотикорезистентністю:
1. Запобігання інфекціям запобігає поширенню резистентності.
2. Відстеження АБР.
3. Оптимізація призначень та використання антибіотиків.
4. Розробка нових препаратів та діагностичних процедур.
Мета дослідження: визначити плазмідні гени антибіотикорезистентності ESBLs та PMQR серед уропатогенів, виділених від пацієнтів з додіалізною хронічною хворобою нирок (ХХН) та пієлонефритом.
Матеріали та методи
Дизайн дослідження
У дослідження було включено 105 дорослих хворих з додіалізною ХХН та пієлонефритом, які були госпіталізовані до нефрологічного відділення Харківської міської клінічної лікарні швидкої допомоги, Україна. Діагноз епізоду пієлонефриту встановлювався згідно з критеріями Європейської асоціації урологів [10].
Критерії включення в дослідження: наявність задокументованої ХХН I–IV стадій за критеріями KDIGO [11]; швидкість клубочкової фільтрації (ШКФ) визначалась за формулою CKD-EPI; підтверджений епізод пієлонефриту з лихоманкою, больовим синдромом, симптомами інтоксикації, наявністю або відсутністю дизурії.
Критерії виключення: онкологічні захворювання, неконтрольована артеріальна гіпертензія, серцева недостатність III–IV класу за HYHA; прийом більше однієї дози антибіотика упродовж 72 годин перед госпіталізацією; неврологічні захворювання; активні захворювання сполучної тканини та системи крові.
Бактеріальні штами
Для бактеріологічного дослідження відбиралась середня порція сечі у стерильний контейнер, яка оброблялась у відділенні медичної біології Харківської міської клінічної лікарні швидкої медичної допомоги протягом 2 годин після збору. Зразки сечі інокулювали на кров’яний агар або хромогенне середовище ChromID CPS (bioMerieux, Франція), після чого позитивні випадки інкубували при 37 °C протягом 24 годин, а негативні випадки — при 37 °C протягом 48 годин. Зразки вважалися клінічно значущими, якщо кількість колонієутворюючих одиниць (КУО) становила ≥ 105 КУО/мл сечі. У бактерій, які виросли у відповідній кількості, у подальшому оцінювалась морфологія колоній, забарвлення за Грамом, рухливість та біохімічні реакції.
Визначення чутливості до антибіотиків
Антимікробну чутливість ізолятів визначали методом дискової дифузії Кірбі — Бауера на чашках з агаром Мюллера — Хінтона. За розміром зони навколо кожного антимікробного диска ізолят інтерпретували як чутливий, проміжний або резистентний згідно з критеріями CLSI [12]. Визначали чутливість до наступних антибіотиків: ампіцилін, амоксицилін/клавуланат, цефтріаксон, цефепім, ципрофлоксацин, левофлоксацин, нітроксолін, фурамаг, амікацин, гентаміцин, нітрофурантоїн, меропенем (ТОВ «Аспект»), ко-тримоксазол, фурагін, фосфоміцин (HIMEDIA Laboratories, Pvt. Ltd., Мумбаї, Індія).
Визначення плазмідних генів антибіотикорезистентності
Повну екстракцію ДНК проводили для всіх зразків методом теплового шоку. Скринінг на наявність плазмідних генів резистентності ESBLs та PMQR проводили за допомогою аналізу секвенування полімеразної ланцюгової реакції (ПЛР). Праймери для визначення генів резистентності подані в табл. 1. Продукти ПЛР аналізували електрофорезом у агарозному гелі та фарбували етидієм броміду. Плазмідна ДНК, використана як маркер молекулярної маси, була гідролізована ферментом puc19 HpaII [13].
Статистика
Статистичний аналіз проводили з використанням пакета для статистичних досліджень для соціальних наук (SPSS), версія 20. Категоріальні дані (стать, стан та чутливість до антибіотиків) були наведені у вигляді кількості та відсотка. Відсотки в різних категоріях порівнювали за допомогою критерію хі-квадрат. Статистичний аналіз проводили з використанням пропорцій чутливих, стійких та проміжних продуктів. Різниця вважалася значущою, якщо ймовірність того, що випадковість пояснює результати, була зменшена до менше ніж 5 % (p ≤ 0,05). Для кожного потенційного фактора ризику коефіцієнти шансів і 95% довірчі інтервали були розраховані за допомогою багатофакторного аналізу.
Етика
Кожен пацієнт був поінформований про збір даних, і від кожного учасника було отримано письмову інформовану згоду. Протокол дослідження затверджено етичною комісією Харківської академії післядипломної освіти (протокол № 2 від 22.02.2013). Анонімність гарантована під час і після дослідження. Дослідження неінвазивне і повністю відповідає Гельсинській декларації як заяві про етичні принципи медичних досліджень за участю людей, затверджені Всесвітньою медичною асоціацією.
Результати
Серед 105 обстежених пацієнтів було 14 (13,3 %) чоловіків та 91 (86,7 %) жінка, середній вік 56,9 ± 1,7 року з діапазоном від 21 до 86 років. Серед них 21 (20 %), 28 (26,7 %), 27 (25,7 %) та 29 (27,6 %) осіб мали ХХН І, ІІ, ІІІ та IV ст. відповідно. Хворих госпіталізували з такими симптомами: лихоманка, нудота, блювання, больовий синдром у реберно-хребтовому куті. Пацієнти були розділені на дві групи лікування: група 1 (n = 56) — пацієнти, які отримували цефалоспорини (цефтріаксон, цефепім), та група 2 (n = 49) — пацієнти, які отримували фторхінолони (ципрофлоксацин, левофлоксацин).
Із 105 пацієнтів 84 (80 %) мали позитивну бактеріологічну культуру. Серед них виділено 115 різних мікроорганізмів, із яких 34 (29,6 %) були грампозитивними та 81 (70,4 %) — грамнегативними бактеріальними штамами. Більшість ізолятів (n = 73) були отримані від пацієнтів віком від 18 до 65 років, тоді як 42 ізоляти — від пацієнтів віком понад 65 років. Загалом Escherichia coli була найпоширенішим мікроорганізмом (53/115, 46,1 %), тоді як серед грампозитивних бактерій домінуючими збудниками були штами Enterococcus spp. та Staphylococcus spp. (табл. 2).
/19.jpg)
Крім цього, серед 81 грамнегативного штаму в 39 (48,1 %) виділені різні типи плазмідних генів резистентності, серед яких 27 (69,2 %) були продуцентами бета-лактамаз розширеного спектра (ESBLs), а 12 (30,8 %) були позитивними на опосередковані плазмідами гени стійкості до фторхінолонів. Більшість генів ідентифіковано у штамів P.mirabilis, E.coli та Serratia spp. із поширеністю 62,5; 52,8 та 50 % відповідно. Крім того, серед 28 (52,8 %) плазмідпозитивних ізолятів E.сoli 20 (71,4 %) і 8 (28,5 %) мали гени ESBL та детермінанти PMQR відповідно. З п’яти штамів P.mirabilis 4 (80 %) та 1 (20 %) були позитивні на ESBL та гени PMQR відповідно. Два з восьми штамів P.aeruginosa (25 %) мали гени PMQR. Частота генів ESBL та PMQR в ізолятах K.pneumoniae становила 66,7 та 33,3 % відповідно. Найпоширенішими генами серед ESBL була β-лактамаза типу blaTEM, серед PMQR — ефлюкс-насос QepA (табл. 3).
Результати бактеріологічних досліджень
Найвища стійкість серед ESBL-продукуючих штамів спостерігалася до ампіциліну (92,6 %), амоксициліну/клавуланату (66,7 %), цефотаксиму (59,3 %), фторхінолонів (51,9 %) та гентаміцину (40,8 %). Крім того, лише меропенем (96,3% чутливість), фосфоміцин (92,6%) і нітроксолін (85,2%) проявили високу інгібуючу активність проти ESBL-продукуючих бактерій. Рівні резистентності серед PMQR-позитивних штамів були такими: ампіцилін — 100 %, амоксицилін/клавуланат — 66,7 %, ципрофлоксацин — 66,7 %, левофлоксацин — 58,3 %, аміноглікозиди — 50 %. Найактивнішим протимікробним засобом проти PMQR-продуцентів був меропенем (100% чутливість). Показники чутливості до АБП in vitro PMRG-негативних штамів бактерій були вірогідно вищими. Рівні чутливості ізольованих уропатогенів залежно від експресії різних типів PMRG наведені на рис. 5.
Бактеріологічна ефективність лікування у пацієнтів, інфікованих бактеріями з пламідними генами резистентності, була нижчою, ніж у пацієнтів з PMRG-негативними штамами, на контрольному візиті (тест ефективності лікування), бактеріологічна ефективність АБТ в PMRG-негативній групі становила 94,6 % (70/74), тоді як в PMRG-позитивній групі — 64,5 % (20/31) (рис. 6).
Обговорення та висновки
Хронічна хвороба нирок, безперечно, залишається серйозною проблемою суспільства. Близько 850 млн людей страждають від різних варіантів захворювань нирок. Один з 10 дорослих має ХХН. Прогнозується, що до 2040 року ХХН буде четвертою причиною смерті у світі. Вартість діалізу та трансплантації у високорозвинених країнах становить 2–3 % річного бюджету [14].
ХХН асоціюється зі значними серйозними інфекційними ускладненнями, що зустрічаються в 3–4 рази частіше, ніж у загальній популяції. Інфекції є важливою причиною захворюваності та смертності серед пацієнтів із нирковою недостатністю і другою провідною причиною смерті після серцево-судинних подій. Зростаюча резистентність до антибактеріальних препаратів істотно погіршує і так жахливі прогнози.
Згідно з даними рапорту Antimicrobial resistance surveillance in Europe 2022 [8], більше ніж 54 % виділених штамів E.coli були резистентними принаймні до одного АБП. У 2020 році найбільший відсоток резистентності встановлено до амінопеніцилінів (54,6 %), фторхінолонів (23,8 %), цефалоспоринів 3-ї генерації (14,9 %) і аміноглікозидів (10,9 %). Резистентність до карбапенемів становила 0,2 %. 87,4 % штамів, резистентних до цефалоспоринів 3-ї генерації, були продуцентами β-лактамаз розширеного спектра дії. У нашому дослідженні рівень резистентності штамів був вищим, і ми отримали такі дані щодо антибактеріальної чутливості: до ампіциліну — 23,5 %, цефалоспоринів 3-ї генерації — 71,6 %, ципрофлоксацину — 70,4 %, левофлоксацину — 76,5 %, гентаміцину — 70,4 %, меропенему — 100 %. Виявлення плазмідних генів резистентності становило 48,1 %. Отримані дані підтверджують, що лікування інфекцій у пацієнтів з ХХН лімітовано та ускладнюється формуванням стійкості до антибактеріальних препаратів.
Використання антибактеріальних препаратів широкого спектра дії є основним фактором ризику колонізації і поширення резистентних Enterobacteriaceae, включаючи E.coli. Значна поширеність ESBLs-продукуючих штамів, підвищення резистентності до основних груп АБП також призводять до збільшення використання карбапенемів, що, у свою чергу, може збільшити селекцію та сприяти поширенню резистентних до карбапенемів Enterobacteriaceae. Згідно з європейським рапортом, рівень резистентності до карбапенемів залишається невисоким (0,0–0,8 %) [8]. У нашому дослідженні рівень чутливості до карбапенемів був високим (100 %), лише для штамів з генами ESBL — 96,3 %.
Нераціональне використання АБП є ключовим фактором для виникнення АБР, що обумовлено попитом пацієнтів, вартістю АБП, відсутністю знань про відповідну тактику антибактеріальної терапії у конкретному випадку та/або затримкою лабораторних результатів. Неналежне використання (зловживання або надмірне використання) знижує ефективність АБП і призводить до селекції та поширення резистентних штамів [9].
Як ми зазначали вище, тільки у 2015 році приблизно 269 мільйонів АБП було видано аптеками амбулаторно у США, тобто кожен п’ятий з шести людей щорічно отримує щонайменше один антибіотик. Близько 30 % цих призначень були непотрібними. Щорічно амбулаторно та в стаціонарах США виписується 47 мільйонів непотрібних рецептів антибіотиків [9]. Якщо в європейських та американських медичних центрах відсоток непотрібних призначень антибіотиків сягає 50 % і навіть більше, то нескладно припустити, який відсоток нецільової АБТ можна очікувати в нашій країні, де в будь-якій аптеці можна купити будь-який антибіотик. У нашому дослідженні було підтверджено вірогідний вплив попереднього використання АБП (упродовж 1 року) з колонізацією штамами з плазмідними генами антибіотикорезистентності (OR 1,41; 95% CI: 0,60–3,33).
Також було підтверджено зниження бактеріологічної ефективності терапії у пацієнтів з PMRG-позитивними патогенами (94,6 % vs. 64,5 %), що є передумовою для подовження лікування, рецидивуючого перебігу захворювання, необхідності повторного використання антибіотиків, призначення більш сильних препаратів та АБП резерву, що, у свою чергу, призведе до погіршення функції нирок та прогресування ХХН.
Беручи до уваги все вищесказане, ми можемо припустити, що виділення та виявлення ESBL- та PMQR-продукуючих уропатогенів є важливим для вибору найефективнішого антибіотика для емпіричного лікування. Оскільки більшість генів ESBL і PMQR переносять плазміди, ці гени можуть легко передаватися серед госпіталізованих пацієнтів. Це основний фактор збільшення поширеності штамів як з ESBL-, так і з PMQR-генами. Крім того, терапевтичні альтернативи для лікування пацієнтів із ІСШ з резистентними уропатогенами та/або тяжкохворих пацієнтів із численними супутніми захворюваннями, особливо пацієнтів, які перебувають у стаціонарі, обмежені. Існує серйозна нестача науково обґрунтованих досліджень, які б керували вибором емпіричної антибіотикотерапії для багатьох пацієнтів у цих умовах. Необхідні подальші клінічні дослідження для створення рекомендацій щодо ведення пацієнтів з плазмідопосередкованою резистентністю та розширення кількості доступних варіантів емпіричної терапії цих мультирезистентних інфекцій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 08.02.2022
Рецензовано/Revised 15.02.2022
Прийнято до друку/Accepted 20.02.2022

/15.jpg)
/16.jpg)
/17.jpg)
/18.jpg)
/18_2.jpg)
/19.jpg)
/20_2.jpg)
/20.jpg)