Журнал «Травма» Том 23, №2, 2022
Тваринні моделі іммобілізаційних контрактур. Огляд методів та тенденцій
Резюме
Контрактури — це хронічна втрата рухливості суглобів, викликана структурними змінами в кісткових тканинах, включаючи м’язи, зв’язки та сухожилля. Вони розвиваються, коли ці зазвичай еластичні тканини заміщуються нееластичними тканинами. Найчастішою причиною контрактур є іммобілізація. Контрактура є складною клінічною проблемою, оскільки характер травми часто не корелює зі ступенем функціонального порушення, що ускладнює прогнозування ризику розвитку патології. Вивчення причинних факторів контрактури на пацієнтах не може бути поширеною клінічною практикою з певних причин, пов’язаних як з етичною стороною проблеми, так і з відсутністю часового фактора спостереження. Моделі на тваринах дозволяють вивчати патогенез захворювання та оцінювати стратегії лікування. Тим не менш, не було розроблено жодної тваринної моделі для оцінки ліктьового суглоба, що необхідно для повного вивчення та розуміння клінічних проблем, характерних для цього складного суглоба. У роботі наведені основні методи моделювання іммобілізаційних контрактур на тваринах. Існує 2 основні підходи до моделювання контрактур суглобів — травматичний та нетравматичний. Травматичні, тобто хірургічні методи фіксації за допомогою спиць, крючків, пластинок тощо, дають надійну фіксацію, але часто супроводжуються ускладненнями у вигляді набряків, запалення, інфікування зони втручання, а також заважають чистоті експерименту, коли необхідно виключити ушкодження тканин навколо суглоба. Нетравматичнї методи моделювання контрактур, тобто за допомогою виключно зовнішніх засобів фіксації, виключають деякі негативні впливи хірургічних методів, але супроводжуються недостатньою надійністю впродовж тривалого часу. Також зовнішня фіксація може викликати набряки, подразнення шкіри, інші негативні прояви. Обидва методи моделювання конт-рактур потребують постійного контролю в процесі проведення експерименту для нівелювання можливих ускладнень та запобігання їм.
Contractures are chronic loss of joint mobility caused by structural changes in bone tissue, including muscles, ligaments and tendons. They develop when these normally elastic tissues are replaced by inelastic tissues. The most common cause of contractures is immobilization. Contracture is a complex clinical problem because the nature of the injury often does not correlate with the degree of functional impairment, which makes it difficult to predict the risk of pathology. The study of the causative factors of contracture in patients may not be a common clinical practice for certain reasons, both related to the ethical side of the problem and the lack of time factor of observation. Animal models allow to study the pathogenesis of the disease and allow to evaluate treatment strategies. However, no animal model has been developed to assess the elbow joint, which is necessary to fully study and understand the clinical problems associated with this complex joint. The paper presents the main methods of modeling immobilization contractures in animals. There are 2 main approaches to modeling joint contractures — traumatic and non-traumatic. Traumatic, is surgical methods of fixation with needles, hooks, plates, etc. give a reliable fixation, but are often accompanied by complications such as edema, inflammation, infection of the area of intervention, as well as interfere with the purity of the experiment, when it is necessary to exclude tissue damage around the joint. Non-traumatic methods of modeling contractures, is with the help of exclusively external means of fixation exclude some of the negative effects of surgical methods, but are accompanied by insufficient reliability for a long time. Also, external fixation can cause swelling, skin irritation and other negative manifestations. Both methods of modeling contractures require constant monitoring during the experiment to level and prevent possible complications.
Ключевые слова
тваринна модель; іммобілізаційна контрактура
animal model; immobilization contracture
Контрактури — це хронічна втрата рухливості суглобів, викликана структурними змінами в кісткових тканинах, включаючи м’язи, зв’язки та сухожилля. Вони розвиваються, коли ці зазвичай еластичні тканини заміщуються нееластичними тканинами. Це призводить до укорочення та затвердіння цих тканин, що зрештою викликає ригідність, деформацію суглоба та повну втрату руху навколо суглоба. Контрактури є остаточним загальним шляхом для багатьох станів. Найчастішою причиною контрактур є іммобілізація [32].
Термін «суглобові контрактури» використовується для опису втрати пасивного діапазону рухів діартрозоподібних суглобів, найбільш поширеного та рухомого типу суглобів. До діартрозних відносять суглоби кінцівок та хребта. Суглобові контрактури визначаються як втрата діапазону рухів (ROM) і можуть впливати на повсякденну діяльність, а також на якість життя [3, 9, 12, 26].
Суглобові контрактури впливають на основні функції рухомих суглобів, обмежуючи рух та рухливість, що призводить до негативного впливу на основну повсякденну активність та здоровий спосіб життя [5].
Ліктьовий суглоб анатомічно та біомеханічно один із найскладніших в організмі. Три окремі кістки утворюють складну взаємодію суглобів, що забезпечує точний та всебічний рух передпліччя та кисті. Через високий рівень природної конгруентності [8] ліктьовий суглоб особливо схильний до тугорухомості після травматичного ушкодження [6]. Незначні зміни натягу зв’язок, анатомії кістки або конгруентності хряща можуть призвести до швидкого виникнення контрактури суглоба. Тугорухливість у ліктьовому суглобі переноситься погано; відносно незначна контрактура може призводити до великих функціональних недоліків у найпростішій повсякденній та професійній діяльності [14]. Незважаючи на клінічну значимість і високу частоту контрактур ліктьового суглоба, він є одним із найменш вивчених суглобів з усієї ортопедії.
Контрактура є складною клінічною проблемою, оскільки характер травми часто не корелює зі ступенем функціонального порушення, що ускладнює прогнозування ризику розвитку патології.
На жаль, вивчення причинних факторів контрактури на пацієнтах не може бути поширеною клінічною практикою з певних причин, пов’язаних як з етичною стороною проблеми, так і з відсутністю часового фактора спостереження.
Навпаки, моделі на тваринах дозволяють вивчати патогенез захворювання та оцінювати стратегії лікування. Тим не менш, не було розроблено жодної тваринної моделі для оцінки ліктьового суглоба, що необхідно для повного вивчення та розуміння клінічних проблем, характерних для цього складного суглоба. Попередні моделі на тваринах, що оцінюють конт-рактури в інших суглобах (тобто колінному), були зосереджені виключно на капсулі і не враховували внесок інших суглобових структур в обмеження рухливості суглоба. У багатьох дослідженнях було доведено, що процеси, які спостерігали при контрактурах в колінному суглобі, можна переносити і на процеси в ліктьовому [20]. Отже, розглянемо способи моделювання конт-рактур на тваринах, не прив’язуючись до конкретного суглоба.
Тваринні моделі контрактури суглобів можна поділити на травматичні, з фіксацією за допомогою хірургічних доступів, та нетравматичні, тобто із зовнішньою фіксацією [40].
Розглянемо основні принципи, які застосовуються при кожному типі фіксації кінцівок.
Моделі з хірургічною фіксацією кінцівки
Модель з пластиковою пластиною та металевим гвинтом. Y. Hagiwara et al. [10] використовували дорослих самців щурів Sprague-Dawley. Дослідники вивчали еластичність тканин та структурні характеристики передньої та задньої синовіальних оболонок у моделі іммобілізованого коліна щура. Жорстка пластикова пластина, імплантована підшкірно, з’єднувала проксимальний відділ стегна і дистальний відділ великогомілкової кістки далеко від колінного суглоба і міцно утримувалася на місці одним металевим гвинтом на кожному кінці (рис. 1, а). Капсула колінного суглоба і сам суглоб залишилися недоторканими. Внутрішньосуглобові структури цієї моделі не ушкоджуються, гематоми не утворюються. Таким чином, при аналізі експериментальних результатів немає необхідності враховувати фіброз та спайки внутрішньосуглобових гематом. Фіксація є досить стабільною для тривалої іммобілізації. Недоліком цієї моделі може бути виникнення інфекції.
/62.jpg)
Дана модель є класичною, і її використовували багато дослідників для вивчення змін у тканинах суглобів, що виникають при іммобілізації. Так, Y. Sogi et al. [33] вивчали вплив крововиливу в суглоб у поєднанні з іммобілізацією суглоба на дегенерацію суглобового хряща моделі іммобілізованого колінного суглоба у щурів. A. Baranowski et al. [2] використовували дану модель для дослідження впливу лозартану та аторвастатину на ранній розвиток контрактури суглобів, оцінювали зміну числа міофібробластів та розподіл кісткового сіалопротеїну. A. Kaneguchi et al. [18] застосували дану модель для вивчення ефекту протизапального лікування у ремобілізаційному періоді відновлення після іммобілізації суглобів у щурів.
E. Chimoto et al. [7] та Y. Onada et al. [30] також використовували дорослих самців щурів Sprague-Dawley та аналогічну модель фіксації у своїх дослідженнях впливу капсули на обмеження діапазону рухів після іммобілізації та впливу внутрішньосуглобового крововиливу на суглобову капсулу іммобілізованих колінних суглобів відповідно.
Модель з віддаленими кортикальними вікнами і свердлінням спицею Кіршнера. M. Hayashi et al. [11] використовували новозеландських білих кроликів зі зрілим скелетом в експерименті для вивчення здатності лікування стабілізатором тучних клітин після травми суглоба зменшувати молекулярні прояви фіброзу суглобової капсули. Для оголення стегнової кістки використовували один латеральний розріз стегна, а рухливу шкіру відтягували дистально, щоб оголити медіальну та латеральну частини дистального відділу стегнової кістки. Виконували медіальну та латеральну парапателярні артротомії, намагаючись не зачепити колатеральні зв’язки. За допомогою остеотома видаляли кортикальні вікна площею 5 мм2 із позасуглобової частини медіального та латерального виростків стегна. Потім коліно іммобілізували при згинанні на 150° за допомогою спиці Кіршнера діаметром 1,6 мм, яку просвердлювали через великогомілкову кістку, проводили підшкірно позаду коліна і згинали навколо стегнової кістки (рис. 1, б). Їх результати показали, що фіброз суглобової капсули був значно вищим у групі з оперованою контрактурою порівняно з неоперованою контрольною групою, а фіброз суглобової капсули в групі, що отримувала кетотифен, був значно меншим порівняно з групою з оперованою контрактурою. Через видалення кісткового кортикального шару моделі формується травматичний внутрішньокапсульний гемартроз.
Даний метод фіксації колінного суглоба кролика став класичним і широко використовується дослідниками. Так, D. You et al. [37] використав дану модель для визначення можливого зв’язку між більш раннім часом початку лікування кетотифеном фумаратом та зменшенням посттравматичної контрактури суглобів. Y. Zhang et al. у низці своїх робіт використовували дану модель для вивчення впливу міграції макрофагів на регуляцію виникнення фіброзу суглобової капсули [38, 39].
Модель з використанням дроту Кіршнера та смоли.
M. Hayashi et al. [11] використовували в експерименті дорослих японських білих кроликів з метою вивчення ефективного методу профілактики контрактур. Для зовнішньої фіксації дві спиці Кіршнера діаметром 1,5 мм вводили у великий вертлюг стегнової кістки, ще одну — у дистальну частину великогомілкової кістки. Потім ці три спиці були з’єднані одна з одною спицею Кіршнера діаметром 1,8 мм з використанням стоматологічної пластмаси, фіксуючи їх зовні, щоб утримувати коліно при згинанні під кутом 45°. М. Nagai та співавт. [24] використовували аналогічний метод для фіксації згинання колінного суглоба приблизно на (140 ± 5)° у самців щурів Wistar для вивчення внеску біартикулярних міогенних компонентів в обмеження діапазону рухів після іммобілізації колінного суглоба щура (рис. 2). У цій моделі не ушкоджуються внутрішньосуглобові структури, а кут згинання легко контролюється.
Дана модель часто використовується в дослідженнях щодо формування, лікування та вивчення змін у тканинах суглобів [1, 16, 17, 28, 34, 36].
Останніми роками для мінімізації травматичності при хірургічних втручаннях була розроблена мініінвазивна технологія армування контрактур у дрібних тварин. S. Jiang et al. [15] об’єднали метод поділу м’язових проміжків з мінірозрізами під час хірургічної процедури. Через два мінірозрізи шкіри на латеральній поверхні стегна та гомілки було виконано поділ м’язових проміжків для оголення поверхні кістки. Колінний суглоб щура поступово іммобілізували за допомогою попередньо сконструйованої внутрішньої фіксації при згинанні коліна приблизно на 135° без втручання в основні нерви або кровоносні судини. Правильність встановлення системи підтверджували рентгенографічним або мікро-КТ-аналізом (рис. 3).
Для вивчення контрактур, спричинених виключно іммобілізацією при ушкодженнях без ураження структур суглоба, важливі нетравматичні моделі. Розглянемо деякі з них, які стали загальновизнаними.
Моделі із зовнішньою фіксацією
Модель з гіпсовою пов’язкою. M. Okita et al. [28] та J. Nakano et al. [25] гіпсовими пов’язками фіксували білатеральні гомілковостопні суглоби щурів у повному згинанні, S. Kojima et al. [19] за допомогою гіпсових пов’язок моделювали контрактури колінних суглобів щурів. У всіх експериментах використовували щурів-самців Wistar.
Гіпсові пов’язки накладали від тазового поясу до гомілковостопного суглоба з максимальним розгинанням у тазостегновому суглобі, максимальним згинанням у колінному суглобі та максимальним пі-дошовним згинанням у гомілковостопному суглобі. Ділянку гіпсування оголювали від дистального відділу кісточки до стопи, щоб переконатися у відсутності набряку та гіперемії. Іммобілізація гіпсом — проста і клінічно широко застосовувана методика. Тим не менш, цей метод має низку ускладнюючих факторів одночасно: складно контролювати рівень герметичності, якщо фіксувати гіпс надто туго, набряк у дистальному кінці іммобілізованого сегмента може викликати остеофасціальний компартмент-синдром; при слабкому гіпсуванні підтримувати модель буде непросто. Крім того, велика маса гіпсу ускладнює пересування тварини.
Незважаючи на деякі недоліки цієї моделі, вона доволі часто використовується в експериментах. A. Kaneguchi et al. [16] вивчали вплив ходьби на біговій доріжці під час ремобілізації на діапазон рухів (ROM) та гістопатологію у колінних суглобах щурів, які були іммобілізовані протягом 3 тижнів у зігнутому положенні за допомогою гіпсової пов’язки.
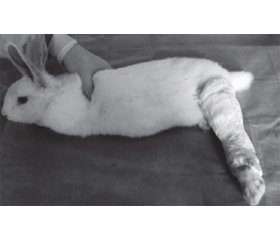
Y. Zhou et al. [41] використовували гіпсування для моделювання розгинальної контрактури на кроликах (рис. 4).
Популярність даної моделі контрактур пов’язана у першу чергу з відносно легким застосуванням та низькою ціною.
Модель із застосуванням дерев’яної шини. R. Okazaki et al. [27] для фіксації нижньої кінцівки кролика у повністю розігнутому положенні від проксимального відділу стегна до дистального кінця прив’язали кінцівку скловолоконною стрічкою до прямої дерев’яної шини. Цей метод іммобілізації простий у виконанні, але може бути нестабільним, і його складно обслуговувати протягом тривалого часу.
Модель має багато модифікацій, у яких як шини використовують різні матеріали — пластик, металеві пластини з фіксаторами тощо. Але через специфіку фіксації у розігнутому положенні використовуються нечасто.
Модель із застосуванням сталевої сітки та футболки. P.C. Benedini-Elias et al. [4] використовували спеціальний пристрій для іммобілізації з легким матеріалом. Пристрій ділиться на дві частини: нижню і верхню. Нижня частина, розділена на передній і задній відділи, виготовлена із сітки з нержавіючої сталі, покритої скотчем. Нижня частина з’єднується скобами з верхньою частиною, яка схожа на футболку з тканини вісколікри (рис. 5). Для підтримки якості та положення пристрою навколо живота тварини між сорочкою та сіткою з нержавіючої сталі закріплюється стрічка. Крім того, на верхніх частинах обох плечей були розміщені дві смужки 0,5 см, які виконували роль підтяжок. Переваги цього пристрою полягають у легкому матеріалі та низькій вартості, але він може бути недостатньо стабільним для тривалої іммобілізації.
Продовженням теми зовнішніх жорстких систем фіксації можна вважати низку розробок, основаних на сучасних технологіях.
L.K. Moore et al. [23] на основі зліпків розробили ортези-розкладачки, надруковані на 3D-принтері. За допомогою цієї модельної системи можливо генерувати як оборотні, так і необоротні контрактури колінного та гомілковостопного суглобів (рис. 6).
Цікавою виявилася модель, розроблена дослідниками Університету Вашингтона S.P. Lake et al. [20]. Була зроблена модель посттравматичної контрактури ліктьового суглоба на тваринах, оцінено потенціал моделі для вивчення етіології тугорухливості суглобів та лікування травм ліктьового суглоба. З огляду на значну кількість посилань (94 посилання на момент написання цього аналізу) можна вважати, що авторам вдалося розробити достатньо вдалу та обґрунтовану модель для вивчення посттравматичних контрактур.
Найбільш важливими характеристиками моделі, яка б максимально відповідала ліктю людини, було визнано такі: 1) функціональний діапазон рухів (ROM) суглоба; 2) анатомічна схожість кісткової архітектури та м’яких тканин; 3) хапальне використання верхніх кінцівок. Важливими критеріями були ліктьові суглоби з окремими променевою і ліктьовою кістками, три різних суглобових зчленування (променево-ліктьове, плече-ліктьове, плече-променеве), пронація/супінація на додаток до згинання/розгинання, наявність капсульної тканини і здатність використовувати кінцівку в довільному положенні. Після тривалих пошуків та консультацій для моделі був обраний щур Long-Evans. Загальний аналіз передньої кінцівки та аналіз зображень з використанням КТ показали анатомічну схожість кісток, зчленувань та м’яких тканин (рис. 7). Одним з найважливіших факторів була здатність пронувати і зупиняти передпліччя, що відрізняє щурів Long-Evans від інших порід, включаючи щурів Sprague-Dawley та Wistar (інші щури, які часто використовуються для досліджень). Щури Long-Evans мають пронацію близько 90° та супінацію близько 60°, вони регулярно супінують під час годування, пронують під час дотягування та обертаються при інших діях у клітці [31, 35]. У той час як всі досліджувані тварини демонстрували згинання/розгинання, здатність до пронації/супінації зустрічалася набагато рідше. Оскільки рух як при згинанні/розгинанні, так і при пронації/супінації життєво важливий для повноцінного використання ліктьового суглоба у людей, обрана тварина мала бути здатною до обох.
У даному експерименті автори ушкоджували капсулу суглоба, це відповідало меті їх дослідження. Але саме нас цікавить метод мобілізації передньої кінцівки. Він полягав у наступному.
Шматок трубчастої еластичної сітки (Nich Marketers Inc., Gulf Breeze, FL) відрізали до 3 дюймів і поміщали навколо верхньої частини тулуба кожного щура (рис. 8, а). Отвір для доступу був вирізаний у правій частині сітки, щоб можна було використовувати неушкоджену праву кінцівку без обмежень. Шматок пов’язки Vetrap, що самоклеїться, розміром 5 × 50 см тричі обгортали навколо однієї і тієї ж частини тулуба, послідовно вирізуючи отвори для доступу, щоб права кінцівка не сковувалася (рис. 8, б). Композитна пов’язка була ретельно стиснута та обрізана, щоб забезпечити постійну іммобілізацію та звести до мінімуму дискомфорт. Якщо були очевидні ознаки дистресу або якщо пов’язка ослабла або забруднилася, тварин анестезували ізофлураном і замінювали пов’язки. Якщо симптоми зберігалися, тварин залишали розбинтованими та уважно спостерігали протягом 24–48 годин, перш ніж повторно накладати іммобілізаційні пов’язки. Кожного разу, коли тварин перев’язували, будь-які виразки або порізи обробляли порошком/кремом з антибіотиком (нітрофуразон, сульфадіазин срібла) та/або антисептичним кремом. Іммобілізаційні пов’язки замінювалися раз на два тижні.
Відмітимо, що ця методика зовнішньої іммобілізації є найбільш прийнятною та легкою у використанні, отже, може бути застосована як при хірургічних доступах з наступною іммобілізацією, так і без травматичних ушкоджень.
Висновки
У роботі ми намагалися освітити основні методи моделювання іммобілізаційних контрактур на тваринах. За даними літературних джерел визначили, що існує 2 основні підходи моделювання контрактур суглобів — травматичний та нетравматичний. Травматичні, тобто хірургічні методи фіксації за допомогою спиць, крючків, пластинок тощо забезпечують надійну фіксацію, але часто супроводжуються ускладненнями у вигляді набряків, запалення, інфікування зони втручання, а також заважають чистоті експерименту, коли необхідно виключити ушкодження тканин навколо суглоба.
Нетравматичні методи моделювання контрактур, тобто за допомогою виключно зовнішніх засобів фіксації, виключають деякі негативні впливи хірургічних методів, але супроводжуються недостатньою надійністю впродовж тривалого часу. Також зовнішня фіксація може викликати набряки, подразнення шкіри, інші негативні прояви.
Обидва методи моделювання контрактур потребують постійного контролю в процесі проведення експерименту для нівелювання можливих ускладнень та запобігання їм.
Таким чином, можна дійти висновку, що дійсно існує багато методів моделювання контрактур суглобів у тварин, у тому числі доволі екзотичних. Але це тільки дає поштовх для подальшого пошуку методів моделювання контрактур.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 25.03.2022
Рецензовано/Revised 02.04.2022
Прийнято до друку/Accepted 10.04.2022
Список литературы
1. Baranowski A., Schlemmer L., Förster K., Mattyasovszky S.G., Ritz U., Wagner D., Rommens P.M., Hofmann A. A novel rat model of stable posttraumatic joint stiffness of the knee. J. Orthop. Surg. Res. 2018. 13(1). 185. doi: 10.1186/s13018-018-0894-y.
2. Baranowski A., Schlemmer L., Förster K., Slotina E., Mickan T., Truffel S., Klein A., Mattyasovszky S.G., Hofmann A., Ritz U., Rommens P.M. Effects of losartan and ator-vastatin on the development of early posttraumatic joint stiffness in a rat model. Drug Des. Devel. Ther. 2019. 13. 2603-2618. doi: 10.2147/DDDT.S204135.
3. Bartoszek G., Fischer U., Grill E., Muller M., Nadolny S., Meyer G. Impact of joint contracture on older persons in a geriatric setting: A cross-sectional study. Z. Gerontol. Geriatr. 2015. 48. 625-632. doi: 10.1007/s00391-015-0895-y.
4. Benedini-Elias P.C., Morgan M.C., Gomes A.R., Mattiello-Sverzut A.C. Changes in postnatal skeletal muscle development induced by alternative immobilization model in female rat. Anat. Sci. Int. 2009. 84(3). 218-25. doi: 10.1007/s12565-009-0016-3.
5. Campbell M., Dudek N., Trudel G. Essentials of Physical Medicine and Rehabilitation: Musculoskeletal Disorders, Pain, and Rehabilitation. Philadelphia, Pa, USA: Elsevier Saunders; 2014. Joint contractures; pp. 651-655.
6. Charalambous C.P., Morrey B.F. Posttraumatic elbow stiffness. J. Bone Joint Surg. Am. 2012. 94(15). 1428-37. doi: 10.2106/JBJS.K.00711.
7. Chimoto E., Hagiwara Y., Ando A., Itoi E. Progression of an arthrogenic motion restriction after immobilization in a rat experimental knee model. Ups. J. Med. Sci. 2007. 112(3). 347-55. doi: 10.3109/2000-1967-207.
8. Cohen M.S., Schimmel D.R., Masuda K., Hastings H. 2nd, Muehleman C. Structural and biochemical evaluation of the elbow capsule after trauma. J. Shoulder Elbow Surg. 2007. 16(4). 484-90. doi: 10.1016/j.jse.2006.06.018.
9. Engstrand C., Krevers B., Nylander G., Kvist J. Hand function and quality of life before and after fasciectomy for Dupuytren contracture. J. Hand Surg. Am. 2014. 39. 1333-1343. 10.1016/j.jhsa.2014.04.029.
10. Hagiwara Y., Saijo Y., Chimoto E., Akita H., Sasano Y., Matsumoto F., Kokubun S. Increased elasticity of capsule after immobilization in a rat knee experimental model assessed by scanning acoustic microscopy. Ups. J. Med. Sci. 2006. 111(3). 303-13. doi: 10.3109/2000-1967-054.
11. Hayashi M., Sekiya H., Takatoku K., Kariya Y., Hoshino Y. Experimental model of knee contracture in extension: its prevention using a sheet made from hyaluronic acid and carboxymethylcellulose. Knee Surg. Sports Traumatol. Arthrosc. 2004. 12(6). 545-51. doi: 10.1007/s00167-004-0512-x.
12. Heise M., Müller M., Fischer U., Grill E. Quality of life in older individuals with joint contractures in geriatric care settings. Qual Life Res. 2016. 25. 2269-2281. 10.1007/s11136-016-1262-1.
13. Hildebrand K.A., Sutherland C., Zhang M. Rabbit knee model of post-traumatic joint contractures: the long-term natural history of motion loss and myofibroblasts. J. Orthop. Res. 2004. 22(2). 313-20. doi: 10.1016/j.orthres.
14. Jawa A., Jupiter J.B., and Ring D., eds. Pathogenesis and classification of elbow stiffness. Оperative elbow surgery, ed. D. Stanley and I. Trail. 2012, Elsevier.
15. Jiang S., Yi X., Luo Y., Yu D., Liu Y., Zhang F., Zhu L., Wang K. A Mini-Invasive Internal Fixation Technique for Studying Immobilization-Induced Knee Flexion Contracture in Rats. J. Vis. Exp. 2019 May 20. 147. doi: 10.3791/59260.
16. Kaneguchi A., Ozawa J., Minamimoto K., Yamaoka K. Active exercise on immobilization-induced contractured rat knees develops arthrogenic joint contracture with pathological changes. J. Appl. Physiol. 2018. 124(2). 291-301. doi: 10.1152/japplphysiol.00438.2017.
17. Kaneguchi A., Ozawa J., Minamimoto K., Yamaoka K. Morphological and biomechanical adaptations of skeletal muscle in the recovery phase after immobilization in a rat. Clin. Biomech. (Bristol, Avon). 2020 May. 75. 104992. doi: 10.1016/j.clinbiomech.2020.104992.
18. Kaneguchi A., Ozawa J., Yamaoka K. Anti-inflammatory Drug Dexamethasone Treatment During the Remobilization Period Improves Range of Motion in a Rat Knee Model of Joint Contracture. Inflammation. 2018 Aug. 41(4). 1409-1423. doi: 10.1007/s10753-018-0788-5.
19. Kojima S., Hoso M., Watanabe M., Matsuzaki T., Hibino I., Sasaki K. Experimental joint immobilization and remobilization in the rats. J. Phys. Ther. Sci. 2014. 26(6). 865-71. doi: 10.1589/jpts.26.865.
20. Lake S.P., Castile R.M., Borinsky S., Dunham C.L., Havlioglu N., Galatz L.M. Development and use of an animal model to study post-traumatic stiffness and contracture of the elbow. J. Orthop. Res. 2016. 34(2). 354-64. doi: 10.1002/jor.22981.
21. Monument M.J., Hart D.A., Befus A.D., Salo P.T., Zhang M., Hildebrand K.A. The mast cell stabilizer ketotifen reduces joint capsule fibrosis in a rabbit model of post-traumatic joint contractures. Inflamm. Res. 2012. 61(4). 285-92. doi: 10.1007/s00011-011-0409-3.
22. Monument M.J., Hart D.A., Salo P.T., Befus A.D., Hildebrand K.A. Posttraumatic elbow contractures: targeting neuroinflammatory fibrogenic mechanisms. J. Orthop. Sci. 2013. 18(6). 869-77. doi: 10.1007/s00776-013-0447-5.
23. Moore L.K., Lee C.S., Agha O., Liu M., Zhang H., Dang A.B.C., Dang A., Liu X., Feeley B.T. A novel mouse mo-del of hindlimb joint contracture with 3D-printed casts. J. Orthop. Res. 2022 Mar 10. doi: 10.1002/jor.25313.
24. Nagai M., Aoyama T., Ito A., Iijima H., Yamaguchi S., Tajino J., Zhang X., Akiyama H., Kuroki H. Contributions of biarticular myogenic components to the limitation of the range of motion after immobilization of rat knee joint. BMC Musculoskelet Disord. 2014. 15. 224. doi: 10.1186/1471-2474-15-224.
25. Nakano J., Sekino Y., Hamaue Y., Sakamoto J., Yoshimura T., Origuchi T., Okita M. Changes in hind paw epidermal thickness, peripheral nerve distribution and mechanical sensitivity after immobilization in rats. Physiol. Res. 2012. 61(6). 643-7. doi: 10.33549/physiolres.932362.
26. Niedzielski L.S., Chapman M.T. Changes in burn scar contracture: utilization of a severity scale and predictor of return to duty for service members. J. Burn Care Res. 2015. 36. e212-219. 10.1097/BCR.0000000000000148.
27. Okazaki R., Sakai A., Uezono Y., Ootsuyama A., Kunugita N., Nakamura T., Norimura T. Sequential changes in transforming growth factor (TGF)-beta1 concentration in synovial fluid and mRNA expression of TGF-beta1 receptors in chondrocytes after immobilization of rabbit knees. J. Bone Miner. Metab. 2001. 19(4). 228-35. doi: 10.1007/s007740170025.
28. Okita M., Nakano J., Kataoka H., Sakamoto J., Origuchi T., Yoshimura T. Effects of therapeutic ultrasound on joint mobility and collagen fibril arrangement in the endomysium of immobilized rat soleus muscle. Ultrasound Med. Biol. 2009. 35(2). 237-44. doi: 10.1016/j.ultrasmedbio.2008.09.001.
29. Okita M., Yoshimura T., Nakano J., Motomura M., Eguchi K. Effects of reduced joint mobility on sarcomere length, collagen fibril arrangement in the endomysium, and hyaluronan in rat soleus muscle. J. Muscle Res. Cell Motil. 2004. 25(2). 159-66. doi: 10.1023/b:jure.0000035851.12800.39.
30. Onoda Y., Hagiwara Y., Ando A., Watanabe T., Chimoto E., Suda H., Yabe Y., Saijo Y., Itoi E. Joint haemorrhage partly accelerated immobilization-induced synovial adhesions and capsular shortening in rats. Knee Surg. Sports Traumatol. Arthrosc. 2014. 22(11). 2874-83. doi: 10.1007/s00167-013-2659-9.
31. Sacrey L.A., Alaverdashvili M., Whishaw I.Q. Similar hand shaping in reaching-for-food (skilled reaching) in rats and humans provides evidence of homology in release, collection, and manipulation movements. Behav. Brain Res. 2009. 204(1). 153-61. doi: 10.1016/j.bbr.2009.05.035.
32. Seidel B.J., Chang L., Lau T.M. Contractures. Originally published: September 20, 2014. Last updated: July 30, 2020. https://now.aapmr.org/contractures/#references.
33. Sogi Y., Yabe Y., Hagiwara Y., Tsuchiya M., Onoda Y., Sekiguchi T., Itaya N., Yoshida S., Yano T., Suzuki K., Onoki T., Itoi E. Joint hemorrhage accelerates cartilage degeneration in a rat immobilized knee model. BMC Musculoskelet Disord. 2020. 21(1). 761. doi: 10.1186/s12891-020-03795-0.
34. Trudel G., Uhthoff H.K. Contractures secondary to immobility: is the restriction articular or muscular? An experimental longitudinal study in the rat knee. Arch Phys. Med. Rehabil. 2000. 81(1). 6-13. doi: 10.1016/s0003-9993(00)90213-2.
35. Whishaw I.Q., Gorny B., Foroud A., Kleim J.A. Long-Evans and Sprague-Dawley rats have similar skilled reaching success and limb representations in motor cortex but different movements: some cautionary insights into the selection of rat strains for neurobiological motor research. Behav. Brain Res. 2003. 145(1-2). 221-32. doi: 10.1016/s0166-4328(03)00143-8.
36. Wong K., Trudel G., Laneuville O. Intra-articular collagenase injection increases range of motion in a rat knee flexion contracture model. Drug Des. Devel. Ther. 2017. 12. 15-24. doi: 10.2147/DDDT.S144602.
37. You D., Maarouf N., Hildebrand K., Soo A., Schneider P. An in vivo rabbit joint injury model to measure trauma-induced coagulopathy and the effect of timing of administration of ketotifen fumarate on posttraumatic joint contracture. OTA Int. 2022. 5(1 Suppl). e177. doi: 10.1097/OI9.0000000000000177.
38. Zhang Y., Liu Z., Wang K., Lu S., Fan S., Xu L., Cai B. Macrophage migration inhibitory factor regulates joint capsule fibrosis by promoting TGF-β1 production in fibroblasts. Int. J. Biol. Sci. 2021. 17(7). 1837-1850. doi: 10.7150/ijbs.57025.
39. Zhang Y., Lu S., Fan S., Xu L., Jiang X., Wang K., Cai B. Macrophage migration inhibitory factor activates the inflammatory response in joint capsule fibroblasts following post-traumatic joint contracture. Aging (Albany NY). 2021. 13(4). 5804-5823. doi: 10.18632/aging.202505.
40. Zhou Y., Zhang Q.B., Zhong H.Z., Liu Y., Jing J.H., Wu J.X. Research progress on animal model of joint contracture. Austin Surg. Case Rep. 2016. 1(02). 1006.
41. Zhou Y., Zhang Q.B., Zhong H.Z., Liu Y., Li J., Lv H., Jing J.H. Rabbit Model of Extending Knee Joint Contracture: Progression of Joint Motion Restriction and Subsequent Joint Capsule Changes after Immobilization. J. Knee Surg. 2020. 33(1). 15-21. doi: 10.1055/s-0038-1676502.
/64.jpg)
/65.jpg)

/62.jpg)
/62_2.jpg)
/63.jpg)
/64_2.jpg)