Хронічна хвороба нирок (ХХН) має значний вплив на глобальне здоров’я. Вона є причиною як захворюваності, так і смертності в усьому світі, крім того, ХХН — це великий економічний тягар як для пацієнта, так і для країни [1, 2].
ХХН є серйозною проблемою громадського здоров’я, вона вражає 13,4 % дорослого населення і є причиною 1,2 млн смертей на рік [1, 3]. ХХН наявна у 12 % населення України [4]. У Сполучених Штатах значна поширеність ХХН: близько 1 із 7 осіб, старших від 30 років, хворіє на ХХН. Від ХХН у світі страждають понад 800 млн осіб [5]. Поширеність ХХН у світі становить 10–16 % від загальної чисельності населення. В осіб похилого віку вона сягає 30 % [4]. ХХН була визнана прихованою епідемією [1].
З 2002 року термін ХХН об’єднує різноманіття нозологічних форм з високою імовірністю прогресування хронічного патологічного процесу в нирках з подальшим приєднанням хронічної ниркової недостатності, що потребує нирково-замісної терапії (перитонеальний діаліз, гемодіаліз або трансплантація нирки) [4].
ХХН — це зниження функції нирок, що корелює зі швидкістю клубочкової фільтрації (ШКФ) менше за 60 мл/хв/1,73 м2 і/або маркерами ураження нирок тривалістю не менше за 3 місяці, що характеризується структурними і/або функціональними нирковими змінами за даними клінічних, лабораторних, інструментальних, морфологічних досліджень, які дають підставу для виключення гострого патологічного процесу в нирках [1, 4, 6–9] (див. табл. 1).
Для ХХН було запропоновано нові терміни:
1. Діабетична хвороба нирок = діабет + ХХН (раніше — діабетична нефропатія (KDOQI, 2007, 2012)).
2. Гіпертонічна хвороба нирок, що є наслідком артеріальної гіпертензії.
3. Ішемічна хвороба нирок, що є наслідком розвитку атеросклерозу [4].
Пацієнти з ХХН схильні до гіпертонії, серцево-судинних захворювань, фіброзу, а також мінерально-кісткового розладу. На даний час лише діаліз або трансплантація нирки є ефективним лікуванням ХХН [5, 10, 11].
Фіброз при ХХН, як правило, прогресує. Фіброзом вважають надмірне скупчення матриксних компонентів сполучної тканини. Фіброз може вражати підшлункову залозу, нирки, шкіру, легені, очі, серце й печінку. Це остаточний патологічний процес дезадаптивної репарації, що характеризується утворенням і накопиченням позаклітинного матриксу, переважно в локальних мезенхімальних клітинах [11] (див. табл. 2).
Мезенхімальні клітини, такі як фібробласти й міофібробласти, відіграють важливу роль у виникненні й розвитку фіброзу. Цей процес тісно пов’язаний із запаленням і регенерацією тканин, що зазвичай відбуваються під час і після запальної відповіді, і ініціюється різними типами ушкодження тканин. Патологічний фіброзний процес ремоделювання часто є причиною дисфункції органів. Фіброз пов’язаний з високою захворюваністю й смертністю [11, 12].
При ХХН майже завжди спостерігаються порушення мінерального гомеостазу. В організмі людини рівень кальцію і фосфору підтримується балансом між депонуванням у кістковій тканині, реабсорбцією в нирках і всмоктуванням у кишечнику [13]. Порушення мінерального балансу, а саме гіпервітаміноз D3, гіперкальціємія і гіперфосфатемія, може впливати на процеси старіння, що часто спостерігається при дефіциті протеїну Klotho. Моделі на тваринах показали, що підтримка мінерального гомеостазу шляхом збільшення рівнів протеїну Klotho гальмує старіння [14, 15].
ХХН може ускладнюватись рідкісним і небезпечним для життя синдромом — кальцифілаксією (кальцифіко-уремічна артеріолопатія), для якої характерна поява дрібних кальцифікацій судин, що призводить до оклюзії кровоносних судин і некрозу тканин. Термін «кальцифілаксія» вперше використав Ганс Сельє у 1961 році, це рідкісний патологічний стан, при якому спостерігається медіальна кальцифікація артерій і артеріол, а також проліферація інтими й фіброз [16–18].
Основними заходами запобігання прогресуванню ХХН і відстрочення несприятливих наслідків є рання діагностика й лікування. Дефіцит ранніх, неінвазивних біомаркерів негативно впливає на здатність швидко виявляти й лікувати ХХН. Лікування ХХН на ранніх стадіях може покращити функцію нирок і/або сповільнити прогресування ХХН [1].
У клінічній практиці порушення функції нирок і досі оцінюють за креатиніном, цистатином С у сироватці крові й альбумінурією, а також за величиною рШКФ, яку визначають за допомогою різних рівнянь. Між креатиніном, цистатином С і рШКФ існує нелінійна кореляція: відносно невелике початкове підвищення цих маркерів визначається як значне зниження рШКФ [1, 8].
Наприклад, у близько 30 % пацієнтів з діабетичною хворобою нирок спостерігається нормальний рівень альбуміну в сечі. Або він може бути відсутній при гіпертензивних або тубулоінтерстиційних захворюваннях нирок. Альбумінурія виникає до того, як починає знижуватись рШКФ. У той час як концентрація креатиніну в сироватці починає збільшуватися, коли пошкоджено приблизно 40–50 % паренхіми нирки [1].
Тому діагностика ранніх стадій ХХН недостатньо ефективна. Вивчено кілька альтернативних маркерів, а саме β2-мікроглобулін, KIM-1 (молекула ураження нирок 1), NGAL (ліпокалін, пов’язаний з нейтрофільною желатиназою) і L-FABP (білок, що зв’язує жирні кислоти печінки) [1, 9, 19–31].
У прогресуванні ХХН важливу роль відіграє ураження проксимальних канальців [1]. Тому найбільший інтерес викликають маркери ураження проксимальних канальців нирок. Окрім KIM-1, NGAL і L-FABP є менш вивчені маркери, такі як уромодулін (UMOD), протеїн Klotho і посттрансляційні модифікації фетуїну А (FtА) (див. табл. 3).
Що нам відомо про ці маркери?
UMOD. Є дані, що вперше цей протеїн описав Карло Ровіда в 1873 році [32]. Пізніше, у 1950 році, він був відкритий і науково описаний Хорсваллом і Таммом: при дослідженні вірусної гемаглютинації в сечі вони виявили білок, який пригнічував вірусну гемаглютинацію. У 1985 році він був повторно відкритий Декером і Мучмором як імуномодулюючий глікопротеїн, а в 1987 році Pennica et al. ідентифікували первинну структуру UMOD, яка показала, що UMOD аналогічний протеїну Тамма — Хорсвалла [33–36].
Він є найбільш поширеним білком у сечі здорової людини. UMOD — кислий білок з масою 90 кДа, який має низьку ізоелектричну точку (pI 5,00). Синтезується виключно уроепітелієм, що вистилає товстий висхідний відділ петлі Генле (Tal) і дистальні канальці [33, 35–41]. UMOD бере участь у регуляції апікальних транспортних систем у Tal і початковому сегменті дистального звивистого канальця, впливаючи на реабсорбцію солі [33, 35, 38, 42–44].
Переважна кількість UMOD екскретується із сечею, в інтерстиції нирок експресія UMOD незначна [36, 45, 46]. У просвіті сечовивідних шляхів мономери UMOD утворюють гомополімерні нитки, що інкапсулюють і агрегують уропатогени (фімбрована кишкова паличка 1-го типу) і виводять назовні із сечею [33]. UMOD — важливий регуляторний протеїн уродженого імунітету, який може зв’язувати фрагменти комплементу [47–50].
UMOD є структурно гомополімерним глікопротеїном, що запобігає адгезії бактеріального патогену. C-термінальний модуль прозорої зони UMOD опосередковує його полімеризацію. Відсутня детальна інформація про N-кінцевий регіон гілки UMOD. Передбачається, що вона має домен з вісьмома цистеїнами [51, 52].
Крім класичного апікального вивільнення, UMOD сортується меншою мірою на базолатеральний домен канальцевих епітеліальних клітин, де вивільняється в інтерстиції, і звідти потрапляє в кровотік [36, 38, 53, 54]. Циркулююча форма UMOD є переважно мономерною, як було показано Micanovic et al. (див. рис. 1).
Концентрація UMOD у сироватці крові порівняно із сечею набагато нижча (20–50 нг/мл проти 20–50 мкг/мл відповідно) [36]. UMOD сироватки (sUmod) може відображати функціональну масу нефрона [38, 55, 56]. У циркулюючого UMOD є лінійна кореляція з рШКФ пацієнтів із ХХН, що може допомогти в діагностиці ранніх стадій пошкодження нирок, коли рівень креатиніну ще в межах норми [38, 57–61]. За даними наукових досліджень, період напіввиведення UMOD із сечею становить приблизно 16 годин, але діапазон коливань великий — від 3 год до 7 днів [38]. У полімеризації і переробці UMOD важливу роль відіграє гепсин [44].
UMOD — багатофункціональний білок, що відіграє важливу роль не тільки в сечовому, але й у системному гомеостазі. Є припущення, що UMOD є ще одним гормоноподібним пептидом, який формує системний імунітет і запальний сигнальний баланс, а також є регулятором окиснювального стресу [36, 38, 62, 63]. Останні дослідження in vitro показують, що UMOD пригнічує функцію моноцитів, вірусну гемаглютинацію та антиген-опосередковану проліферацію Т-клітин [64]. Він бере участь у регуляції хемотаксису, фагоцитозу й апоптозу, позитивно впливає на трансепітеліальну міграцію нейтрофілів (через специфічні рецептори клітинної поверхні) [64, 65].
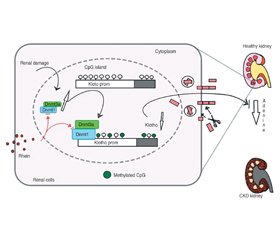
Проведені дослідження дозволяють припускати, що UMOD бере участь у захисті сечовивідних шляхів від інфекцій і утворення каменів [66–68], у регуляції транспорту солі, розвитку пошкодження нирок і роботі вродженого імунітету [41, 69–71]. Рідкісні місенс-мутації гена UMOD — найчастіша причина автосомно-домінантної тубулоінтерстиціальної хвороби нирок, для якої характерні ураження канальців, розвиток інтерстиціального фіброзу й відсутність пошкодження клубочків, з приєднанням ниркової недостатності. Механізм пошкодження й розвитку фіброзу пов’язаний з накопиченням внутрішньоклітинних агрегатів мутантного UMOD у Tal [33, 36, 40, 72–76].
У просвіті канальців UMOD утворює високомолекулярні нитки, які входять до складу гіалінових циліндрів. UMOD схильний до посиленого глікування (сягає 30–40 % від його молекулярної маси). Структурні й функціональні зміни білка можуть бути причиною захворювань нирок і сечовивідних шляхів. Зміна профілю глікозування UMOD робить його потенційним біомаркером здоров’я нирок [36, 77–80]. Рівні UMOD у сечі й сироватці відображають кількість інтактних нефронів [38].
Протеїн Klotho. Професор Makoto Kuro-O з групою вчених у 1997 р. відкрив ген Klotho, що гальмував старіння. Його назвали на честь богині давньогрецької міфології, яка пряла нитку життя. Через рік Y. Matsumura et al. на 13q12 хромосомі в людини ідентифікували ген α-Клото (Klotho) [15, 81, 82].
Дослідження показали, що модельована гіперекспресія гена Klotho інгібує фенотипові прояви старіння й підвищує тривалість життя осіб. Ген Klotho є одним з генів «антистаріння» [82, 83].
Пізніше було виявлено, що білок Klotho має три ізоформи: α, β і γ [84, 85]. На 4-й хромосомі знаходиться неповна копія гена Klotho зі схожою нуклеотидною послідовністю, що отримала назву β-Klotho [82].
Ген β-Klotho кодує однопрохідний трансмембранний протеїн, що переважно експресується в підшлунковій залозі, білій жировій тканині й печінці й бере участь у регуляції синтезу жовчних кислот за допомогою фактора росту фібробластів (FGF) [82]. γ-Klotho (клото/лактаза-флоризин) — лактозоподібний протеїн, який можна знайти в нирках, бурій жировій тканині й структурах ока. Функція білка γ-Klotho досі не з’ясована [85, 86].
Ген Klotho експресується переважно в дистальних звивистих канальцях нирок та епітеліальних клітинах судинного сплетення в головному мозку. Цей ген визначається і в інших органах, але в низьких концентраціях [15].
Клітини, які експресують ген Klotho: уроепітелій дистальних канальців нирок, епітеліальні клітини судинного сплетення, а також клітини гіпофіза, підшлункової, передміхурової, паращитоподібної залоз, плаценти, серця, аорти, сечового міхура, скелетної мускулатури, товстої і тонкої кишки, яєчників і яєчок [15, 82].
Ген Klotho має 5 екзонів, 4 інтрони й кодує протеїн Klotho, у якого є дві форми — секреторна й трансмембранна [82, 87]. Шляхом альтернативного сплайсингу РНК утворюються два транскрипти, що кодують секреторну й мембрану форми протеїну Klotho [15].
Мембрана форма протеїну Klotho має трансмембраний, внутрішньоклітинний і позаклітинний домени. Матричні металопротеїнази родини ADAM (A Disintegrin And Metalloproteinase) відщеплюють 10-й і 17-й позаклітинні домени, які потрапляють в позаклітинний простір. Це і є розчинна форма протеїну Klotho [15].
Ген Klotho кодує трансмембранний пептид Klotho, що є обов’язковим корецептором FGF-23 — гормону, який необхідний для регуляції концентрації паратиреоїдного гормону, фосфору й вітаміну D [83, 88]. Шляхом стимулювання екскреції ниркового фосфату й зниження рівня сироваткового дигідроксивітаміну D3 Klotho індукує від’ємний фосфатний баланс [84, 89, 90].
Є три члени родини Klotho — трансмембранні протеїни різної довжини. Розчинні форми Klotho можуть бути отримані шляхом протеолітичного розщеплення трансмембранної форми β-секретазами [91].
У людини трансмембранна форма протеїну Klotho знаходиться в клітинній мембрані й апараті Гольджі, вона складається з 1012 амінокислот, має молекулярну вагу ~ 130 кДа і включає 3 домени: позаклітинний домен і трансмембранний домен з коротким цитоплазматичним доменом на С-кінці, а також має сигнальну послідовність на N-кінці [82, 91]. Позаклітинний домен має дві ділянки внутрішніх повторів (KL1і KL2) гомологічних послідовностей β-глюкозидази зі збігом послідовностей від 20 до 40 %, короткий внутрішньоклітинний домен має протяжність у 10 амінокислот [82, 91].
Є припущення, що між ділянками KL1 і KL2 розміщений сайт, який бере участь у розщепленні трансмембранної форми. У людини переважає секреторна форма протеїну, що складається з 549 амінокислот. Секреторна форма є циркулюючим гуморальним фактором [82] (див. рис. 2).
Дані проведених досліджень виявили, що в дорослих віком 20 років і старших концентрація протеїну Klotho в сироватці крові мала діапазон від 239 до 1266 пг/мл [15].
Є припущення, що протеїн Klotho гальмує старіння через пригнічення внутрішньоклітинного інсуліну/інсуліноподібного фактора росту 1 сигнального шляху. Зменшення оксидантного стресу при збільшенні рівня протеїну Klotho через пригнічення шляху p53/p21 є механізмом, що уповільнює старіння й онкогенез [15, 92, 93].
Існує кілька потенційних механізмів, які сприяють антифіброзному ефекту Klotho при ХХН, наприклад інгібування передачі сигналів внутрішньоклітинного сигнального шляху Wnt, FGF23 і трансформуючого фактора росту (TGF-β) [5, 11, 94–97].
У дистальних канальцях нирок спостерігається його найбільша експресія [88]. Циркулюючі рівні Klotho (розчинний α-Klotho) з’являються завдяки позаклітинному домену протеїну Klotho, їх вважають сурогатним маркером експресії Klotho в нирках і функціонального числа нефронів [83, 88].
Розчинний Klotho впливає на функцію ендотелію, оксидантний стрес, старіння й апоптоз клітин [88]. У пацієнтів із ХХН, ішемічною хворобою серця, цукровим діабетом підтверджено зниження експресії гена Klotho й секреції протеїну Klotho [82]. Рівні сироваткового протеїну Klotho з віком зменшуються [15].
FtА. Уперше FtА описав Педерсен у 1944 році й дав йому назву від латинського слова fetus через велику його кількість у фетальній сироватці теляти [98]. Пізніше багатофункціональний фосфорильований глікопротеїн (відомий ще як альфа-2-Гереманс-Шмід) був відкритий Шмідтом, Геремансом і Бюргі в 1961 році [99–102]. Він являє собою білок, що складається з довгого ланцюга А (282 амінокислоти) і короткого ланцюга В (27 амінокислот), з’єднаних коротким ланцюгом з 40 амінокислот, масою від 52 до 60 кДа [99, 101–103].
У період внутрішньоутробного розвитку виявляється експресія FtА в усіх основних органах і судинному сплетенні [98, 99]. У сироватці крові концентрація FtА коливається від 0,4 до 1,0 г/л [98, 100]. FtА синтезується переважно (> 95 %) в печінці (і має назву гепатокін), може синтезуватись в нирках, накопичується у великій кількості в кальцифікованій кістці, крові й спинномозковій рідині [98, 99, 103].
FtА має вплив на енергетичний гомеостаз, ріст клітин, адипоцити й процес запалення (може бути як позитивним, так і негативним білком гострої фази), взаємодіє з рецептором інсуліну, пригнічуючи його тирозинкіназу [99, 100, 104–113]. Є непрямим регулятором запалення, кальцифікації, поляризації макрофагів і фіброзу в тканинах [98, 108, 114–119].
У кінці 1970-х років Лебретон з колегами відкрили, що FtА є одним з основних негативних білків гострої фази. З’являються короткі ізоформи транскрипційного фактора C/EBP, які не можуть підтримувати базальну активність промотора печінки, на відміну від довгих ізоформ C/EBP, які переважають в гепатоцитах у спокійному стані [98].
FtА відіграє важливу роль у профілактиці ниркового літогенезу й ішемічної хвороби серця за рахунок пригнічення надмірної мінералізації [99, 120–124]. Через здатність пригнічувати апоптоз і посилювати фагоцитоз апоптотичних залишків FtА зменшує мінералізаційний стрес [98, 125–128].
Також FtА є транспортним білком для фосфату й кальцію, що відіграє важливу роль у мінералізації кісток, через зв’язування дрібних кластерів фосфату і кальцію, тим самим запобігаючи їх росту, агрегації і випадінню мінералів, поглинанню клітинами цих розчинних білково-мінеральних колоїдів, відомих як частинки кальципротеїну (складаються з мономерів кальципротеїну) [98, 104, 105, 129–133].
Місце зв’язування мінералів у FtА розміщується в N-кінцевому цистатиноподібному домені CY1 [98]. Невеликі комплекси фосфату кальцію (кластери Познера) є кращим лігандом FtА, ніж іонний кальцій [98]. Дослідження in vivo та in vitro виявили прямий вплив підвищеного рівня фосфату на функцію ендотелію [134].
Для насичених жирних кислот FtА є адаптерним білком (ендогенний ліганд), за допомогою якого вони активують Toll-подібний рецептор 4 [105, 108]. FtА відіграє важливу роль у зв’язуванні мінералів, лектинів (у тому числі галектину-3) [108, 135–137] і ліпідів, бере участь в пригніченні передачі сигналу бета-фактора росту й антагонізації рецепторів інсуліну [98, 108, 138]. FtА є необхідним кофактором інгібування експресії прозапального цитокіну, фактора некрозу пухлини, разом зі спермідином, активуючи накопичення триацилгліцерину й NF-κB [98, 108] (див. рис. 3).
FtА, як і фетуїн В, багатий на гістидин, кініноген і глікопротеїн, належить до родини цистатинів 3-го типу, що є інгібітором цистеїнпептидази [98]. Досі не виявлено специфічної цільової пептидази для FtА [98].
FtА зазнає значних посттрансляційних модифікацій, таких як протеолітичний процесинг від одноланцюгового попередника до циркулюючого дволанцюгового протеїну комплексу, N- і O-глікозилювання, сульфатації і фосфорилювання треоніну й серину, які впливають на його активність і стабільність [98, 101, 102, 139].
Висновки
Рання діагностика ХХН, виявлення пацієнтів, у яких вона може прогресувати до термінальної стадії ниркової недостатності, є актуальними й дуже важливими. Показники, що включають рівень креатиніну, рШКФ та протеїнурію, не зовсім задовольняють клінічну потребу. Тому для оцінки прогресування ХХН необхідні нові біомаркери. Причому не один біомаркер, а комбінація різноманітних біомаркерів. Отже, як ми бачимо, такі маркери пошкодження нирок, як UMOD, протеїн Klotho, FtА, є актуальними на даний час, і не лише для ранньої діагностики, вони можуть стати основою для створення нових ліків у нефрології для лікування пацієнтів із ХХН, у тому числі з діабетичною нефропатією. Для цих біомаркерів характерне виявлення ранніх пошкоджень, локалізації пошкодження. Вони дають оцінку щодо подальшого прогресування захворювання, тяжкості й смерті [140].
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 11.05.2022
Рецензовано/Revised 23.05.2022
Прийнято до друку/Accepted 03.06.2022
Список литературы
1. Benjamin O., Lappin S.L. End-Stage Renal Disease. 2021 Sep 16. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2022 Jan. PMID: 29763036.
2. Mizdrak M., Kumrić M., Kurir T.T., Božić J. Emerging Biomarkers for Early Detection of Chronic Kidney Disease. J. Pers. Med. 2022 Mar 31. 12(4). 548. doi: 10.3390/jpm12040548. PMID: 35455664. PMCID: PMC9025702.
3. Catanese L., Siwy J., Mavrogeorgis E., Amann K., Mischak H., Beige J., Rupprecht H. A Novel Urinary Proteomics Classifier for Non-Invasive Evaluation of Interstitial Fibrosis and Tubular Atrophy in Chronic Kidney Disease. Proteomes. 2021 Jul 13. 9(3). 32. doi: 10.3390/proteomes9030032. PMID: 34287333. PMCID: PMC8293473.
4. Внутрішня медицина: Підручник для студентів закладів вищої медичної освіти ІІІ–ІV рівня акредитації та лікарів післядипломної освіти на основі рекомендацій доказової медицини / За ред. В.М. Коваленка. Укл.: Н.М. Шуба, О.Г. Несукай, О.П. Борткевич. 3-тє вид., переробл. і доповн. К.: Моріон, 2019. 960 с. + 8 с. кол. вкл. ISBN 978-966-2066-74-6.
5. Yuan Q., Ren Q., Li L., Tan H., Lu M., Tian Y., Huang L., Zhao B., Fu H., Hou F.F., Zhou L., Liu Y. A Klotho-derived peptide protects against kidney fibrosis by targeting TGF-β signaling. Nat. Commun. 2022 Jan 21. 13(1). 438. doi: 10.1038/s41467-022-28096-z. PMID: 35064106. PMCID: PMC8782923.
6. Yin T., Chen Y., Tang L., Yuan H., Zeng X., Fu P. Relationship between modifiable lifestyle factors and chronic kidney disease: a bibliometric analysis of top-cited publications from 2011 to 2020. BMC Nephrol. 2022 Mar 25. 23(1). 120. doi: 10.1186/s12882-022-02745-3. PMID: 35337272. PMCID: PMC8957172.
7. Petra E., Siwy J., Vlahou A., Jankowski J. Urine peptidome in combination with transcriptomics analysis highlights MMP7, MMP14 and PCSK5 for further investigation in chronic kidney disease. PLoS One. 2022 Jan 19. 17(1). e0262667. doi: 10.1371/journal.pone.0262667. PMID: 35045102. PMCID: PMC8769332.
8. Šalamon Š., Bevc S., Ekart R., Hojs R., Potočnik U. Polymorphism in the GATM Locus Associated with Dialysis-Independent Chronic Kidney Disease but Not Dialysis-Dependent Kidney Failure. Genes (Basel). 2021 May 28. 12(6). 834. doi: 10.3390/genes12060834. PMID: 34071541. PMCID: PMC8228672.
9. Będzichowska A., Jobs K., Kloc M., Bujnowska A., Kalicki B. The Assessment of the Usefulness of Selected Markers in the Diagnosis of Chronic Kidney Disease in Children. Biomark Insights. 2021 Apr 20. 16. 11772719211011173. doi: 10.1177/11772719211011173. PMID: 33958853. PMCID: PMC8060753.
10. Gan Y., Zhao M., Feng J. Association of fetuin-A levels and left ventricular diastolic dysfunction in patients on haemodialysis. Int. Urol. Nephrol. 2021 Aug. 53(8). 1689-1694. doi: 10.1007/s11255-021-02796-9. Epub 2021 Mar 6. PMID: 33675483.
11. Panizo S., Martínez-Arias L., Alonso-Montes C., Cannata P., Martín-Carro B., Fernández-Martín J.L., Naves-Díaz M., Carrillo-López N., Cannata-Andía J.B. Fibrosis in Chronic Kidney Disease: Pathogenesis and Consequences. Int. J. Mol. Sci. 2021 Jan 2. 22(1). 408. doi: 10.3390/ijms22010408. PMID: 33401711. PMCID: PMC7795409.
12. Ludes P.O., de Roquetaillade C., Chousterman B.G., Pottecher J., Mebazaa A. Role of Damage-Associated Molecular Patterns in Septic Acute Kidney Injury, From Injury to Recovery. Front. Immunol. 2021 Mar 1. 12. 606622. doi: 10.3389/fimmu.2021.606622. PMID: 33732235. PMCID: PMC7957065.
13. Lavainne F., Guillot P., Figueres L. Troubles minéraux et osseux dans la maladie rénale chronique: physiopathologie, conséquences et prise en charge [Chronic kidney disease — Mineral bone disorders: Physiopathology and guidelines]. Rev. Med. Interne. 2022 Apr. 43(4). 225-232. French. doi: 10.1016/j.revmed.2022.01.009. Epub 2022 Feb 25. PMID: 35227526.
14. Goyal R., Jialal I. Hyperphosphatemia. 2021 Sep 28. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2022 Jan. PMID: 31869067.
15. Tomo S., Birdi A., Yadav D., Chaturvedi M., Sharma P. Klotho: A Possible Role in the Pathophysiology of Nephrotic Syndrome. EJIFCC. 2022 Apr 11. 33(1). 3-10. PMID: 35645691. PMCID: PMC9092721.
16. Turek M., Stępniewska J., Różański J. The Multifactorial Pathogenesis of Calciphylaxis: A Case Report. Am. J. Case Rep. 2021 Jun 7. 22. e930026. doi: 10.12659/AJCR.930026. PMID: 34097671. PMCID: PMC8197444.
17. Nseir V., Bradauskaite G., Pedroza M., Minimo C., Zaki R., Chewaproug D. A Rare Case of Calciphylaxis in an Orthotopic Liver Transplant Recipient with Acute Kidney Injury. Exp. Clin. Transplant. 2021 Apr. 19(4). 382-385. doi: 10.6002/ect.2017.0123. Epub 2018 Apr 9. PMID: 29633925.
18. Whitehead M., Shanahan C.M. Circulating uromodulin: a cytokine trap for osteoinductive inflammatory mediators in chronic kidney disease? Cardiovasc. Res. 2021 Feb 22. 117(3). 651-652. doi: 10.1093/cvr/cvaa348. PMID: 33367494.
19. Correll V.L., Otto J.J., Risi C.M., Main B.P., Boutros P.C., Kislinger T., Galkin V.E., Nyalwidhe J.O., Semmes O.J., Yang L. Optimization of small extracellular vesicle isolation from expressed prostatic secretions in urine for in-depth proteomic analysis. J. Extracell. Vesicles. 2022 Feb. 11(2). e12184. doi: 10.1002/jev2.12184. PMID: 35119778. PMCID: PMC8815402.
20. Tran A.C., Melchinger H., Weinstein J., Shaw M., Kent C., Perazella M.A., Wilson F.P., Parikh C.R., Moledina D.G. Urine testing to differentiate glomerular from tubulointerstitial diseases on kidney biopsy. Pract. Lab. Med. 2022 Apr 6. 30. e00271. doi: 10.1016/j.plabm.2022.e00271. PMID: 35465621. PMCID: PMC9018443.
21. Wen Y., Parikh C.R. Current concepts and advances in biomarkers of acute kidney injury. Crit. Rev. Clin. Lab. Sci. 2021 Aug. 58(5). 354-368. doi: 10.1080/10408363.2021.1879000. Epub 2021 Feb 8. PMID: 33556265.
22. Ix J.H., Shlipak M.G. The Promise of Tubule Biomarkers in Kidney Disease: A Review. Am. J. Kidney Dis. 2021 Nov. 78(5). 719-727. doi: 10.1053/j.ajkd.2021.03.026. Epub 2021 May 27. PMID: 34051308. PMCID: PMC8545710.
23. Puthumana J., Thiessen-Philbrook H., Xu L., Coca S.G., Garg A.X., Himmelfarb J., Bhatraju P.K., Ikizler T.A., Siew E.D., Ware L.B., Liu K.D., Go A.S., Kaufman J.S., Kimmel P.L., Chinchilli V.M., Cantley L.G., Parikh C.R. Biomarkers of inflammation and repair in kidney disease progression. J. Clin. Invest. 2021 Feb 1. 131(3). e139927. doi: 10.1172/JCI139927. PMID: 33290282. PMCID: PMC7843225.
24. You R., Zheng H., Xu L., Ma T., Chen G., Xia P., Fan X., Ji P., Wang L., Chen L. Decreased urinary uromodulin is potentially associated with acute kidney injury: a systematic review and meta-analysis. J. Intensive Care. 2021 Nov 15. 9(1). 70. doi: 10.1186/s40560-021-00584-2. PMID: 34782019. PMCID: PMC8591828.
25. Chang C., Obeid W., Thiessen-Philbrook H., Parikh C.R. Sample Processing and Stability for Urine Biomarker Studies. J. Appl. Lab. Med. 2021 Nov 1. 6(6). 1628-1634. doi: 10.1093/jalm/jfab082. PMID: 34414423. PMCID: PMC8561784.
26. Obert L.A., Elmore S.A., Ennulat D., Frazier K.S. A Review of Specific Biomarkers of Chronic Renal Injury and Their Potential Application in Nonclinical Safety Assessment Studies. Toxicol. Pathol. 2021 Jul. 49(5). 996-1023. doi: 10.1177/0192623320985045. Epub 2021 Feb 12. PMID: 33576319. PMCID: PMC8195817.
27. Rudnicki M., Siwy J., Wendt R., Lipphardt M., Koziolek M.J., Maixnerova D., Peters B., Kerschbaum J., Leierer J., Neprasova M., Banasik M., Sanz A.B., Perez-Gomez M.V., Ortiz A., Stegmayr B., Tesar V., Mischak H., Beige J., Reich H.N. PERSTIGAN working group. Urine proteomics for prediction of disease progression in patients with IgA nephropathy. Nephrol. Dial. Transplant. 2021 Dec 31. 37(1). 42-52. doi: 10.1093/ndt/gfaa307. PMID: 33313853. PMCID: PMC8719618.
28. Mukhin N., Konoplev G., Oseev A., Schmidt M.P., Stepanova O., Kozyrev A., Dmitriev A., Hirsch S. Label-Free Protein Detection by Micro-Acoustic Biosensor Coupled with Electrical Field Sorting. Theoretical Study in Urine Models. Sensors (Basel). 2021 Apr 6. 21(7). 2555. doi: 10.3390/s21072555. PMID: 33917374. PMCID: PMC8038679.
29. Ascher S.B., Scherzer R., Estrella M.M., Berry J.D., de Lemos J.A., Jotwani V.K., Garimella P.S., Malhotra R., Bullen A.L., Katz R., Ambrosius W.T., Cheung A.K., Chonchol M., Killeen A.A., Ix J.H., Shlipak M.G. SPRINT research group. Kidney tubule health, mineral metabolism, and adverse events in persons with CKD in SPRINT. Nephrol. Dial. Transplant. 2021 Sep 2. gfab255. doi: 10.1093/ndt/gfab255. Epub ahead of print. PMID: 34473302.
30. Bullen A.L., Katz R., Jotwani V., Garimella P.S., Lee A.K., Estrella M.M., Shlipak M.G., Ix J.H. Biomarkers of Kidney Tubule Health, CKD Progression, and Acute Kidney Injury in SPRINT (Systolic Blood Pressure Intervention Trial) Participants. Am. J. Kidney Dis. 2021 Sep. 78(3). 361-368.e1. doi: 10.1053/j.ajkd.2021.01.021. Epub 2021 Apr 20. PMID: 33857535. PMCID: PMC8384678.
31. van Duijl T.T., Ruhaak L.R., Smit N.P.M., Pieterse M.M., Romijn F.P.H.T.M., Dolezal N., Drijfhout J.W., de Fijter J.W., Cobbaert C.M. Development and Provisional Validation of a Multiplex LC-MRM-MS Test for Timely Kidney Injury Detection in Urine. J. Proteome Res. 2021 Dec 3. 20(12). 5304-5314. doi: 10.1021/acs.jproteome.1c00532. Epub 2021 Nov 4. PMID: 34735145. PMCID: PMC8650098.
32. You R., Chen L., Xu L., Zhang D., Li H., Shi X., Zheng Y., Chen L. High Level of Uromodulin Increases the Risk of Hypertension: A Mendelian Randomization Study. Front. Cardiovasc. Med. 2021 Sep 1. 8. 736001. doi: 10.3389/fcvm.2021.736001. PMID: 34540925. PMCID: PMC8440862.
33. Joseph C.B., Mariniello M., Yoshifuji A., Schiano G., Lake J., Marten J., Richmond A., Huffman J.E., Campbell A., Harris S.E., Troyanov S., Cocca M., Robino A., Thériault S., Eckardt K.U., Wuttke M., Cheng Y., Corre T., Kolcic I., Black C., Bruat V., Concas M.P., Sala C., Aeschbacher S., Schaefer F., Bergmann S., Campbell H., Olden M., Polasek O., Porteous D.J., Deary I.J., Madore F., Awadalla P., Girotto G., Ulivi S., Conen D., Wuehl E., Olinger E., Wilson J.F., Bochud M., Köttgen A., Hayward C., Devuyst O. Meta-GWAS Reveals Novel Genetic Variants Associated with Urinary Excretion of Uromodulin. J. Am. Soc. Nephrol. 2022 Mar. 33(3). 511-529. doi: 10.1681/ASN.2021040491. PMID: 35228297. PMCID: PMC8975067.
34. Holzmann-Littig C., Renders L., Steubl D. Uromodulin — a new marker of kidney function? Clin. Nephrol. 2021 Jun. 95(6). 347-349. doi: 10.5414/CN110303. PMID: 33704054.
35. Wang J., Liu L., He K., Gao B., Wang F., Zhao M., Zhang L., On Behalf Of The Chinese Cohort Study Of Chronic Kidney Disease C-Stride. UMOD Polymorphisms Associated with Kidney Function, Serum Uromodulin and Risk of Mortality among Patients with Chronic Kidney Disease, Results from the C-STRIDE Study. Genes (Basel). 2021 Oct 23. 12(11). 1687. doi: 10.3390/genes12111687. PMID: 34828293. PMCID: PMC8620616.
36. Денова Л.Д. Уромодулін як потенційний кандидат-маркер прогнозування перебігу хронічної хвороби нирок. Нирки. 2021. Т. 10. № 4. doi: http://dx.doi.org/10.22141/2307-1257.10.4.2021.247898
37. Franceschini N., Le T.H. Urine Uromodulin and Genetics of its Variation. J. Am. Soc. Nephrol. 2022 Mar. 33(3). 461-462. doi: 10.1681/ASN.2022010027. PMID: 35228296. PMCID: PMC8975060.
38. Chan J., Svensson M., Tannæs T.M., Waldum-Grevbo B., Jenssen T., Eide I.A. Associations of Serum Uromodulin and Urinary Epidermal Growth Factor with Measured Glomerular Filtration Rate and Interstitial Fibrosis in Kidney Transplantation. Am. J. Nephrol. 2022. 53(2-3). 108-117. doi: 10.1159/000521757. Epub 2022 Feb 1. PMID: 35104815. PMCID: PMC9116601.
39. Then C., Herder C., Then H., Thorand B., Huth C., Heier M., Meisinger C., Peters A., Koenig W., Rathmann W., Roden M., Stumvoll M., Maalmi H., Meitinger T., Lechner A., Scherberich J., Seissler J. Serum uromodulin is inversely associated with biomarkers of subclinical inflammation in the population-based KORA F4 study. Clin. Kidney J. 2020 Sep 6. 14(6). 1618-1625. doi: 10.1093/ckj/sfaa165. PMID: 34221377. PMCID: PMC8248959.
40. Then C., Then H.L., Lechner A., Thorand B., Meisinger C., Heier M., Peters A., Koenig W., Rathmann W., Scherberich J., Seissler J. Serum uromodulin and decline of kidney function in older participants of the population-based KORA F4/FF4 study. Clin. Kidney J. 2020 May 1. 14(1). 205-211. doi: 10.1093/ckj/sfaa032. PMID: 33564420. PMCID: PMC7857794.
41. Mary S., Boder P., Rossitto G., Graham L., Scott K., Flynn A., Kipgen D., Graham D., Delles C. Salt loading decreases urinary excretion and increases intracellular accumulation of uromodulin in stroke-prone spontaneously hypertensive rats. Clin. Sci (Lond). 2021 Dec 22. 135(24). 2749-2761. doi: 10.1042/CS20211017. PMID: 34870708. PMCID: PMC8689196.
42. Alesutan I., Luong T.T.D., Schelski N., Masyout J., Hille S., Schneider M.P., Graham D., Zickler D., Verheyen N., Estepa M., Pasch A., Maerz W., Tomaschitz A., Pilz S., Frey N., Lang F., Delles C., Müller O.J., Pieske B., Eckardt K.U., Scherberich J., Voelkl J. Circulating uromodulin inhibits vascular calcification by interfering with pro-inflammatory cytokine signalling. Cardiovasc. Res. 2021 Feb 22. 117(3). 930-941. doi: 10.1093/cvr/cvaa081. PMID: 32243494.
43. Ponte B., Pruijm M., Ackermann D., Olinger E., Youhanna S., Vogt B., Burnier M., Pechere-Bertschi A., Bochud M., Devuyst O. Uromodulin, Salt, and 24-Hour Blood Pressure in the General Population. Clin. J. Am. Soc. Nephrol. 2021 May 8. 16(5). 787-789. doi: 10.2215/CJN.11230720. Epub 2021 Jan 21. PMID: 33478975. PMCID: PMC8259484.
44. Li S., Wang L., Sun S., Wu Q. Hepsin: a multifunctional transmembrane serine protease in pathobiology. FEBS J. 2021 Sep. 288(18). 5252-5264. doi: 10.1111/febs.15663. Epub 2020 Dec 19. PMID: 33300264.
45. Nanamatsu A., Mori T., Ando F., Furusho T., Mandai S., Susa K., Sohara E., Rai T., Uchida S. Vasopressin Induces Urinary Uromodulin Secretion By Activating PKA (Protein Kinase A). Hypertension. 2021 Jun. 77(6). 1953-1963. doi: 10.1161/HYPERTENSIONAHA.121.17127. Epub 2021 Apr 26. PMID: 33896194.
46. Turner M., Staplin N. UMOD-ulating CKD risk: untangling the relationship between urinary uromodulin, blood pressure, and kidney disease. Kidney Int. 2021 Dec. 100(6). 1168-1170. doi: 10.1016/j.kint.2021.09.019. PMID: 34802557.
47. Singh G., Gohh R., Clark D., Kalra K., Das M., Bradauskaite G., Bleyer A.J., Tanriover B., Chang A.R., Anand P.M. Vignette-Based Reflections to Inform Genetic Testing Policies in Living Kidney Donors. Genes (Basel). 2022 Mar 26. 13(4). 592. doi: 10.3390/genes13040592. PMID: 35456398. PMCID: PMC9025319.
48. Shen F., Liu M., Pei F., Yu L., Yang X. Role of uromodulin and complement activation in the progression of kidney disease. Oncol. Lett. 2021 Dec. 22(6). 829. doi: 10.3892/ol.2021.13090. Epub 2021 Oct 13. PMID: 34691256. PMCID: PMC8527566.
49. Yu L., Pei F., Sun Q., Shen F., Yang X., Hu Z., Liu M. Uromodulin aggravates renal tubulointerstitial injury through activation of the complement pathway in rats. J. Cell. Physiol. 2021 Jul. 236(7). 5012-5021. doi: 10.1002/jcp.30208. Epub 2021 Jan 5. PMID: 33400289.
50. Bai L., Xie Q., Xia M., Gong K., Wang N., Chen Y., Zhao M. The importance of sialic acid, pH and ion concentration on the interaction of uromodulin and complement factor H. J. Cell. Mol. Med. 2021 May. 25(9). 4316-4325. doi: 10.1111/jcmm.16492. Epub 2021 Mar 31. PMID: 33788378. PMCID: PMC8093974.
51. Stsiapanava A., Xu C., Nishio S., Han L., Yamakawa N., Carroni M., Tunyasuvunakool K., Jumper J., de Sanctis D., Wu B., Jovine L. Structure of the decoy module of human glycoprotein 2 and uromodulin and its interaction with bacterial adhesin FimH. Nat. Struct. Mol. Biol. 2022 Mar. 29(3). 190-193. doi: 10.1038/s41594-022-00729-3. Epub 2022 Mar 10. PMID: 35273390. PMCID: PMC8930769.
52. Micanovic R., LaFavers K.A., Patidar K.R., Ghabril M.S., Doud E.H., Mosley A.L., Sabo A.R., Khan S., El-Achkar T.M. The kidney releases a nonpolymerizing form of uromodulin in the urine and circulation that retains the external hydrophobic patch domain. Am. J. Physiol. Renal. Physiol. 2022 Apr 1. 322(4). F403-F418. doi: 10.1152/ajprenal.00322.2021. Epub 2022 Jan 31. PMID: 35100812. PMCID: PMC8934678.
53. Abdelsalam M., Motawea M., Kyrillos F., Abdel-Razik A., Zaki M.E.S., Abdel-Wahab A. Study of Uromodulin Gene Polymorphism in Egyptian Patients with End-Stage Renal Disease. Saudi J. Kidney Dis. Transpl. 2021 Jan-Feb. 32(1). 157-162. doi: 10.4103/1319-2442.318517. PMID: 34145125.
54. Mansour S.G., Liu C., Jia Y., Reese P.P., Hall I.E., El-Achkar T.M., LaFavers K.A., Obeid W., Rosenberg A.Z., Daneshpajouhnejad P., Doshi M.D., Akalin E., Bromberg J.S., Harhay M.N., Mohan S., Muthukumar T., Schröppel B., Singh P., El-Khoury J.M., Weng F.L., Thiessen-Philbrook H.R., Parikh C.R. Uromodulin to Osteopontin Ratio in Deceased Donor Urine Is Associated With Kidney Graft Outcomes. Transplantation. 2021 Apr 1. 105(4). 876-885. doi: 10.1097/TP.0000000000003299. PMID: 32769629. PMCID: PMC8805736.
55. Usui R., Ogawa T., Takahashi H., Iwasaki C., Koike M., Morito T., Hatano M., Nitta K. Serum uromodulin is a novel renal function marker in the Japanese population. Clin. Exp. Nephrol. 2021 Jan. 25(1). 28-36. doi: 10.1007/s10157-020-01964-y. Epub 2020 Sep 11. PMID: 32915368.
56. Ponte B., Sadler M.C., Olinger E., Vollenweider P., Bochud M., Padmanabhan S., Hayward C., Kutalik Z., Devuyst O. Mendelian randomization to assess causality between uromodulin, blood pressure and chronic kidney disease. Kidney Int. 2021 Dec. 100(6). 1282-1291. doi: 10.1016/j.kint.2021.08.032. Epub 2021 Oct 9. PMID: 34634361.
57. Enko D., Meinitzer A., Scherberich J.E., März W., Herrmann M., Artinger K., Rosenkranz A.R., Zitta S. Individual uromodulin serum concentration is independent of glomerular filtration rate in healthy kidney donors. Clin. Chem. Lab. Med. 2020 Oct 13. 59(3). 563-570. doi: 10.1515/cclm-2020-0894. PMID: 33048833.
58. Cansever H.N., Sari F., Cevikol C., Cetinkaya R., Süleymanlar G., Ersoy F. Serum uromodulin levels, MR imaging findings, and their relationship with eGFR-based CKD staging in ADPKD patients. Int. Urol. Nephrol. 2021 Jul. 53(7). 1383-1389. doi: 10.1007/s11255-020-02730-5. Epub 2021 Jan 3. PMID: 33389516.
59. Jie C., Yi-Ying Y., Miao C. Correlation of serum uromodulin levels with renal fibrosis and renal function progression in patients with CKD. Pak. J. Pharm. Sci. 2021 Nov. 34(6(Special)). 2417-2422. PMID: 35039253.
60. Yazdani B., Delgado G.E., Scharnagl H., Krämer B.K., Drexel H., März W., Scherberich J.E., Leiherer A., Kleber M.E. Combined Use of Serum Uromodulin and eGFR to Estimate Mortality Risk. Front. Med. (Lausanne). 2021 Sep 8. 8. 723546. doi: 10.3389/fmed.2021.723546. PMID: 34568379. PMCID: PMC8455921.
61. Then C., Herder C., Thorand B., Sujana C., Heier M., Meisinger C., Peters A., Koenig W., Rathmann W., Roden M., Stumvoll M., Maalmi H., Then H., Ferrari U., Scherberich J., Seissler J. KORA-Study Group. Association of serum uromodulin with adipokines in dependence of type 2 diabetes. Cytokine. 2022 Feb. 150. 155786. doi: 10.1016/j.cyto.2021.155786. Epub 2021 Dec 15. PMID: 34920231.
62. LaFavers K. Disruption of Kidney-Immune System Crosstalk in Sepsis with Acute Kidney Injury: Lessons Learned from Animal Models and Their Application to Human Health. Int. J. Mol. Sci. 2022 Feb 1. 23(3). 1702. doi: 10.3390/ijms23031702. PMID: 35163625. PMCID: PMC8835938.
63. Jain R.B., Ducatman A. Associations between the concentrations of α-klotho and selected perfluoroalkyl substances in the presence of eGFR based kidney function and albuminuria: Data for US adults aged 40–79 years. Sci Total Environ. 2022 May 17. 155994. doi: 10.1016/j.scitotenv.2022.155994. Epub ahead of print. PMID: 35595139.
64. Močnik M., Marčun Varda N. Current Knowledge of Selected Cardiovascular Biomarkers in Pediatrics: Kidney Injury Molecule-1, Salusin-α and -β, Uromodulin, and Adropin. Children (Basel). 2022 Jan 13. 9(1). 102. doi: 10.3390/children9010102. PMID: 35053727. PMCID: PMC8774650.
65. Ray S.K., Masarkar N., Mukherjee S. Implications of Klotho Protein for Managing Kidney Disease — an Emerging Role in Therapeutics and Molecular Medicine. Curr. Mol. Med. 2021. 21(6). 484-494. doi: 10.2174/1566524020666201120143313. PMID: 33222666.
66. Noonin C., Peerapen P., Yoodee S., Kapincharanon C., Kanlaya R., Thongboonkerd V. Systematic analysis of modulating activities of native human urinary Tamm-Horsfall protein on calcium oxalate crystallization, growth, aggregation, crystal-cell adhesion and invasion through extracellular matrix. Chem. Biol. Interact. 2022 Apr 25. 357. 109879. doi: 10.1016/j.cbi.2022.109879. Epub 2022 Mar 6. PMID: 35263610.
67. Hasan F.T., Mohey M.A. Association of genetic polymorphism and expression of UMOD gene and chronic kidney disease. Wiad. Lek. 2021. 74(9 cz. 2). 2297-2300. PMID: 34824175.
68. Yang Y., Hong S., Li C., Zhang J., Hu H., Chen X., Jiang K., Sun F., Wang Q., Wang S. Proteomic analysis reveals some common proteins in the kidney stone matrix. PeerJ. 2021 Jul 27. 9. e11872. doi: 10.7717/peerj.11872. PMID: 34395096. PMCID: PMC8323604.
69. Wang Y., Du M.F., Yao S., Zou T., Zhang X.Y., Hu G.L., Chu C., Liao Y.Y., Chen C., Wang D., Ma Q., Wang K.K., Sun Y., Niu Z.J., Yan R.C., Yan Y., Zhou H.W., Jia H., Gao W.H., Li H., Li C.H., Chen F.Y., Gao K., Zhang J., Safirstein R., Wang F., Yang T.L., Mu J.J. Associations of Serum Uromodulin and Its Genetic Variants With Blood Pressure and Hypertension in Chinese Adults. Front. Cardiovasc. Med. 2021 Nov 17. 8. 710023. doi: 10.3389/fcvm.2021.710023. PMID: 34869624. PMCID: PMC8635522.
70. Du M.F., Yao S., Zou T., Mu J.J., Zhang X.Y., Hu G.L., Chu C., Jia H., Liao Y.Y., Chen C., Wang D., Ma Q., Yan Y., Wang K.K., Sun Y., Niu Z.J., Yan R.C., Zhang X., Zhou H.W., Gao W.H., Li H., Li C.H., Gao K., Zhang J., Yang T.L., Wang Y. Associations of plasma uromodulin and genetic variants with blood pressure responses to dietary salt interventions. J. Clin. Hypertens. (Greenwich). 2021 Oct. 23(10). 1897-1906. doi: 10.1111/jch.14347. Epub 2021 Aug 7. PMID: 34363725. PMCID: PMC8678750.
71. Boder P., Mary S., Mark P.B., Leiper J., Dominiczak A.F., Padmanabhan S., Rampoldi L., Delles C. Mechanistic interactions of uromodulin with the thick ascending limb: perspectives in physiology and hypertension. J. Hypertens. 2021 Aug 1. 39(8). 1490-1504. doi: 10.1097/HJH.0000000000002861. PMID: 34187999. PMCID: PMC7611110.
72. Utami S.B., Endo R., Hamada T., Notsu T., Minato H., Komatsu K., Nakayama Y., Shirayoshi Y., Yamamoto K., Okada S., Ninomiya H., Otuki A., Hisatome I. Hsp70 promotes maturation of uromodulin mutants that cause familial juvenile hyperuricemic nephropathy and suppresses cellular damage. Clin. Exp. Nephrol. 2022 Jun. 26(6). 522-529. doi: 10.1007/s10157-022-02196-y. Epub 2022 Feb 25. PMID: 35212881.
73. Shamam Y.M., Hashmi M.F. Autosomal Dominant Tubulointerstitial Kidney Disease. 2022 Apr 16. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2022 Jan. PMID: 33760469.
74. Bleyer A.J., Wolf M.T., Kidd K.O., Zivna M., Kmoch S. Autosomal dominant tubulointerstitial kidney disease: more than just HNF1β. Pediatr. Nephrol. 2022 May. 37(5). 933-946. doi: 10.1007/s00467-021-05118-4. Epub 2021 May 22. PMID: 34021396. PMCID: PMC8722360.
75. Wang D., Qiu Y., Fan J., Liu Y., Chen W., Li Z., Chen W., Wang X. Upregulation of C/EBP Homologous Protein induced by ER Stress Mediates Epithelial to Myofibroblast Transformation in ADTKD-UMOD. Int. J. Med. Sci. 2022 Jan 24. 19(2). 364-376. doi: 10.7150/ijms.65036. PMID: 35165522. PMCID: PMC8795802.
76. Schaeffer C., Devuyst O., Rampoldi L. Uromodulin: Roles in Health and Disease. Annual Rev. Physiol. 2021 Feb 10. 83. 477-501. doi: 10.1146/annurev-physiol-031620-092817. PMID: 33566673.
77. Li Y., Cheng Y., Consolato F., Schiano G., Chong M.R., Pietzner M., Nguyen N.Q.H., Scherer N., Biggs M.L., Kleber M.E., Haug S., Göçmen B., Pigeyre M., Sekula P., Steinbrenner I., Schlosser P., Joseph C.B., Brody J.A., Grams M.E., Hayward C., Schultheiss U.T., Krämer B.K., Kronenberg F., Peters A., Seissler J., Steubl D., Then C., Wuttke M., März W., Eckardt K.U., Gieger C., Boerwinkle E., Psaty B.M., Coresh J., Oefner P.J., Pare G., Langenberg C., Scherberich J.E., Yu B., Akilesh S., Devuyst O., Rampoldi L., Köttgen A. Genome-wide studies reveal factors associated with circulating uromodulin and its relations with complex diseases. JCI Insight. 2022 Apr 21. e157035. doi: 10.1172/jci.insight.157035. Epub ahead of print. PMID: 35446786.
78. Beenken A., Al-Awqati Q. Uromodulin fights UTI with sugars. Kidney Int. 2021 May. 99(5). 1057-1059. doi: 10.1016/j.kint.2020.12.035. Epub 2021 Feb 5. PMID: 33549589.
79. Li H., Kostel S.A., DiMartino S.E., Hashemi Gheinani A., Froehlich J.W., Lee R.S. Uromodulin Isolation and Its N-Glycosylation Analysis by NanoLC-MS/MS. J. Proteome Res. 2021 May 7. 20(5). 2662-2672. doi: 10.1021/acs.jproteome.0c01053. Epub 2021 Mar 2. PMID: 33650863.
80. Patabandige M.W., Go E.P., Desaire H. Clinically Viable Assay for Monitoring Uromodulin Glycosylation. J. Am. Soc. Mass Spectrom. 2021 Feb 3. 32(2). 436-443. doi: 10.1021/jasms.0c00317. Epub 2020 Dec 10. PMID: 33301684. PMCID: PMC8541689.
81. Liu Q., Li S., Yu L., Yin X., Liu X., Ye J., Lu G. CCL5 Suppresses Klotho Expression via p-STAT3/DNA Methyltransferase1-Mediated Promoter Hypermethylation. Front. Physiol. 2022 Mar 1. 13. 856088. doi: 10.3389/fphys.2022.856088. PMID: 35299661. PMCID: PMC8922032.
82. Gupta M., Orozco G., Rao M., Gedaly R., Malluche H.H., Neyra J.A. The Role of Alterations in Alpha-Klotho and FGF-23 in Kidney Transplantation and Kidney Donation. Front. Med. (Lau–sanne). 2022 May 6. 9. 803016. doi: 10.3389/fmed.2022.803016. PMID: 35602513. PMCID: PMC9121872.
83. Wu S.E., Chen W.L. Soluble Klotho as an effective biomarker to characterize inflammatory states. Ann. Med. 2022 Dec. 54(1). 1520-1529. doi: 10.1080/07853890.2022.2077428. PMID: 35603960.
84. Jin D., Jia M., Xie Y., Lin L., Qiu H., Lu G. Impact of Klotho on the expression of SRGAP2a in podocytes in diabetic nephropathy. BMC Nephrol. 2022 Apr 18. 23(1). 151. doi: 10.1186/s12882-022-02765-z. PMID: 35436879. PMCID: PMC9014571.
85. Kale A., Sankrityayan H., Anders H.J., Gaikwad A.B. Klotho in kidney diseases: A crosstalk between the renin-angiotensin system and endoplasmic reticulum stress. Nephrol. Dial. Transplant. 2021 Nov 26. gfab340. doi: 10.1093/ndt/gfab340. Epub ahead of print. PMID: 34850136.
86. Нестерова А.А., Глинка Е.Ю., Тюренков И.Н., Перфилова В.Н. Белок Клото — универсальный регулятор физиологических процессов в организме. Успехи физиологических наук. 2020. Т. 51. № 2. С. 88-104. DOI: 10.31857/S0301179820020083.
87. Li S., Kong J., Yu L., Liu Q. Abnormally decreased renal Klotho is linked to endoplasmic reticulum-associated degradation in mice. Int. J. Med. Sci. 2022 Jan 9. 19(2). 321-330. doi: 10.7150/ijms.68137. PMID: 35165517. PMCID: PMC8795804.
88. Ciardullo S., Perseghin G. Soluble α-Klotho levels, glycemic control and renal function in US adults with type 2 diabetes. Acta Diabetol. 2022 Jun. 59(6). 803-809. doi: 10.1007/s00592-022-01865-4. Epub 2022 Mar 14. PMID: 35286490. PMCID: PMC9085659.
89. Hu M.C., Moe O.W. Phosphate and Cellular Senescence. Adv. Exp. Med. Biol. 2022. 1362. 55-72. doi: 10.1007/978-3-030-91623-7_7. PMID: 35288873.
90. Du C., Wang X., Wu Y., Liao W., Xiong J., Zhu Y., Liu C., Han W., Wang Y., Han S., Chen S., Xu Y., Wang S., Wang F., Yang K., Zhao J., Wang J. Renal Klotho and inorganic phosphate are extrinsic factors that antagonistically regulate hematopoietic stem cell maintenance. Cell. Rep. 2022 Feb 15. 38(7). 110392. doi: 10.1016/j.celrep.2022.110392. PMID: 35172146.
91. Buchanan S., Combet E., Stenvinkel P., Shiels P.G. Klotho, Aging, and the Failing Kidney. Front. Endocrinol. (Lausanne). 2020 Aug 27. 11. 560. doi: 10.3389/fendo.2020.00560. PMID: 32982966. PMCID: PMC7481361.
92. Zhao M., Murakami S., Matsumaru D., Kawauchi T., Nabeshima Y.I., Motohashi H. NRF2 pathway activation attenuates ageing-related renal phenotypes due to α-klotho deficiency. J. Biochem. 2022 May 11. 171(5). 579-589. doi: 10.1093/jb/mvac014. PMID: 35137128.
93. Lehtihet M., Stephanou C., Börjesson A., Bhuiyan H., Pohanka A., Ekström L. Studies of IGF-I and Klotho Protein in Relation to Anabolic-Androgenic Steroid and Growth Hormone Administrations. Front. Sports Act. Living. 2022 Mar 31. 4. 829940. doi: 10.3389/fspor.2022.829940. PMID: 35434614. PMCID: PMC9008280.
94. Desbiens L.C., Sidibé A., Ung R.V., Mac-Way F. FGF23-Klotho Axis and Fractures in Patients Without and With Early CKD: A Case-Cohort Analysis of CARTaGENE. J. Clin. Endocrinol. Metab. 2022 May 17. 107(6). e2502-e2512. doi: 10.1210/clinem/dgac071. PMID: 35139204. PMCID: PMC9113817.
95. Wu Q., Fan W., Zhong X., Zhang L., Niu J., Gu Y. Klotho/FGF23 and Wnt in SHPT associated with CKD via regulating miR-29a. Am. J. Transl. Res. 2022 Feb 15. 14(2). 876-887. PMID: 35273691. PMCID: PMC8902549.
96. Isakova T., Yanucil C., Faul C. A Klotho-Derived Peptide as a Possible Novel Drug to Prevent Kidney Fibrosis. Am. J. Kidney Dis. 2022 Apr 22. S0272-6386(22)00620-5. doi: 10.1053/j.ajkd.2022.03.006. Epub ahead of print. PMID: 35469964.
97. Valiño-Rivas L., Cuarental L., Ceballos M.I., Pintor-Chocano A., Perez-Gomez M.V., Sanz A.B., Ortiz A., Sanchez-Niño M.D. Growth differentiation factor-15 preserves Klotho expression in acute kidney injury and kidney fibrosis. Kidney Int. 2022 Jun. 101(6). 1200-1215. doi: 10.1016/j.kint.2022.02.028. Epub 2022 Mar 23. PMID: 35337892.
98. Rudloff S., Jahnen-Dechent W., Huynh-Do U. Tissue chaperoning-the expanded functions of fetuin-A beyond inhibition of systemic calcification. Pflugers Arch. 2022 Apr 11. 1-14. doi: 10.1007/s00424-022-02688-6. Epub ahead of print. PMID: 35403906. PMCID: PMC8995415.
99. Icer M.A., Yıldıran H. Effects of fetuin-A with diverse functions and multiple mechanisms on human health. Clin. Biochem. 2021 Feb. 88. 1-10. doi: 10.1016/j.clinbiochem.2020.11.004. Epub 2020 Nov 25. PMID: 33245873.
100. Bassey P.E., Numthavaj P., Rattanasiri S., Sritara P., McEvoy M., Ongphiphadhanakul B., Thakkinstian A. Causal association pathways between fetuin-A and kidney function: a mediation analysis. J. Int. Med. Res. 2022 Apr. 50(4). 3000605221082874. doi: 10.1177/03000605221082874. PMID: 35435033. PMCID: PMC9019358.
101. Magalhães P., Zürbig P., Mischak H., Schleicher E. Urinary fetuin-A peptides as a new marker for impaired kidney function in patients with type 2 diabetes. Clin. Kidney J. 2020 Oct 23. 14(1). 269-276. doi: 10.1093/ckj/sfaa176. PMID: 33564428. PMCID: PMC7857838.
102. Kovářová M., Kalbacher H., Peter A., Häring H.U., Didangelos T., Stefan N., Birkenfeld A., Schleicher E., Kantartzis K. Detection and Characterization of Phosphorylation, Glycosylation, and Fatty Acid Bound to Fetuin A in Human Blood. J. Clin. Med. 2021 Jan 22. 10(3). 411. doi: 10.3390/jcm10030411. PMID: 33499061. PMCID: PMC7865524.
103. Umapathy D., Subramanyam P.V., Krishnamoorthy E., Viswanathan V., Ramkumar K.M. Association of Fetuin-A with Thr256Ser exon polymorphism of α2-Heremans Schmid Glycoprotein (AHSG) gene in type 2 diabetic patients with overt nephropathy. J. Diabetes Complications. 2022 Jan. 36(1).108074. doi: 10.1016/j.jdiacomp.2021.108074. Epub 2021 Oct 8. PMID: 34774416.
104. Jirak P., Stechemesser L., Moré E., Franzen M., Topf A., Mirna M., Paar V., Pistulli R., Kretzschmar D., Wernly B., Hoppe U.C., Lichtenauer M., Salmhofer H. Clinical implications of fetuin-A. Adv. Clin. Chem. 2019. 89.79-130. doi: 10.1016/bs.acc.2018.12.003. Epub 2019 Feb 8. PMID: 30797472.
105. Birukov A., Polemiti E., Jäger S., Stefan N., Schulze M.B. Fetuin-A and risk of diabetes-related vascular complications: a prospective study. Cardiovasc. Diabetol. 2022 Jan 8. 21(1). 6. doi: 10.1186/s12933-021-01439-8. PMID: 34998417. PMCID: PMC8742328.
106. Zhou Z., Chen H., Sun M., Jin H., Ju H. Fetuin-A to adiponectin ratio is an independent indicator of subclinical atherosclerosis in patients with newly diagnosed type 2 diabetes mellitus. J. Diabetes Complications. 2022 Jan. 36(1). 108102. doi: 10.1016/j.jdiacomp.2021.108102. Epub 2021 Dec 3. PMID: 34887185.
107. Kothari V., Babu J.R., Mathews S.T. AMP activated kinase negatively regulates hepatic Fetuin-A via p38 MAPK-C/EBPβ/E3 Ubiquitin Ligase Signaling pathway. PLoS One. 2022 May 6. 17(5). e0266472. doi: 10.1371/journal.pone.0266472. PMID: 35522655. PMCID: PMC9075660.
108. Luís C., Soares R., Baylina P., Fernandes R. Underestimated Prediabetic Biomarkers: Are We Blind to Their Strategy? Front. Endocrinol. (Lausanne). 2022 Mar 7. 13. 805837. doi: 10.3389/fendo.2022.805837. PMID: 35321333. PMCID: PMC8936175.
109. Ahn M.B., Kim S.K., Kim S.H., Cho W.K., Suh J.S., Cho K.S., Suh B.K., Jung M.H. Clinical Significance of the Fetuin-A-to-Adiponectin Ratio in Obese Children and Adolescents with Diabetes Mellitus. Children (Basel). 2021 Dec 8. 8(12). 1155. doi: 10.3390/children8121155. PMID: 34943350. PMCID: PMC8699833.
110. Harbuwono D.S., Sazli B.I., Kurniawan F., Darmowidjojo B., Koesnoe S., Tahapary D.L. The impact of Ramadan fasting on Fetuin-A level in type 2 diabetes mellitus. Heliyon. 2021 May 15. 7(5). e06773. doi: 10.1016/j.heliyon.2021.e06773. PMID: 34041376. PMCID: PMC8141768.
111. Lőrincz H., Csige I., Harangi M., Szentpéteri A., Seres I., Szabó Z., Paragh G., Somodi S. Low Levels of Serum Fetuin-A and Retinol-Binding Protein 4 Correlate with Lipoprotein Subfractions in Morbid Obese and Lean Non-Diabetic Subjects. Life (Basel). 2021 Aug 27. 11(9). 881. doi: 10.3390/life11090881. PMID: 34575030. PMCID: PMC8471801.
112. Susairaj P., Snehalatha C., Nanditha A., Satheesh K., Raghavan A., Vinitha R., Ramachandran A. Analysis of an Indian diabetes prevention programme on association of adipokines and a hepatokine with incident diabetes. Sci Rep. 2021 Oct 13. 11(1). 20327. doi: 10.1038/s41598-021-99784-x. PMID: 34645898. PMCID: PMC8514464.
113. Högstedt A., Farnebo S., Tesselaar E., Ghafouri B. Investigation of proteins important for microcirculation using in vivo microdialysis after glucose provocation: a proteomic study. Sci Rep. 2021 Sep 27. 11(1). 19093. doi: 10.1038/s41598-021-98672-8. PMID: 34580391. PMCID: PMC8476624.
114. Khan S.R., Canales B.K., Dominguez-Gutierrez P.R. Randall’s plaque and calcium oxalate stone formation: role for immunity and inflammation. Nat. Rev. Nephrol. 2021 Jun. 17(6). 417-433. doi: 10.1038/s41581-020-00392-1. Epub 2021 Jan 29. PMID: 33514941.
115. Chattopadhyay D., Das S., Guria S., Basu S., Mukherjee S. Fetuin-A regulates adipose tissue macrophage content and activation in insulin resistant mice through MCP-1 and iNOS: involvement of IFNγ-JAK2-STAT1 pathway. Biochem. J. 2021 Nov 26. 478(22). 4027-4043. doi: 10.1042/BCJ20210442. PMID: 34724561.
116. Ghadimi M., Foroughi F., Hashemipour S., Nooshabadi M.R., Ahmadi M.H., Yari M.G., Kavianpour M., Haghighian H.K. Decreased insulin resistance in diabetic patients by influencing Sirtuin1 and Fetuin-A following supplementation with ellagic acid: a randomized controlled trial. Diabetol. Metab. Syndr. 2021 Feb 5. 13(1). 16. doi: 10.1186/s13098-021-00633-8. PMID: 33546744. PMCID: PMC7866694.
117. Werida R.H., Abou-Madawy S., Abdelsalam M., Helmy M.W. Omega 3 fatty acids effect on the vascular calcification biomarkers fetuin A and osteoprotegerin in hemodialysis patients. Clin. Exp. Med. 2022 May. 22(2). 301-310. doi: 10.1007/s10238-021-00740-w. Epub 2021 Jul 20. PMID: 34286397.
118. Anzai F., Karasawa T., Komada T., Yamada N., Miura Y., Sampilvanjil A., Baatarjav C., Fujimura K., Matsumura T., Tago K., Kurosu H., Takeishi Y., Kuro-O M., Takahashi M. Calciprotein Particles Induce IL-1β/α-Mediated Inflammation through NLRP3 Inflammasome-Dependent and -Independent Mechanisms. Immunohorizons. 2021 Jul 29. 5(7). 602-614. doi: 10.4049/immunohorizons.2100066. PMID: 34326201.
119. Chen W., Fitzpatrick J., Monroy-Trujillo J.M., Sozio S.M., Jaar B.G., Estrella M.M., Serrano J., Anokhina V., Miller B.L., Melamed M.L., Bushinsky D.A., Parekh R.S. Associations of Serum Calciprotein Particle Size and Transformation Time With Arterial Calcification, Arterial Stiffness, and Mortality in Incident Hemodialysis Patients. Am. J. Kidney Dis. 2021 Mar. 77(3). 346-354. doi: 10.1053/j.ajkd.2020.05.031. Epub 2020 Aug 13. PMID: 32800846. PMCID: PMC7881044.
120. Janus S.E., Hajjari J., Chami T., Mously H., Badhwar A.K., Karnib M., Carneiro H., Rahman M., Al-Kindi S.G. Multi-Variable Biomarker Approach in Identifying Incident Heart Failure in Chronic Kidney Disease Results from the Chronic Renal Insufficiency Cohort (CRIC) Study. Eur. J. Heart Fail. 2022 May 19. doi: 10.1002/ejhf.2543. Epub ahead of print. PMID: 35587997.
121. Tiong M.K., Smith E.R., Pascoe E.M., Elder G.J., Lioufas N.M., Pedagogos E., Hawley C.M., Valks A., Holt S.G., Hewitson T.D., Toussaint N.D. Effect of lanthanum carbonate on serum calciprotein particles in patients with stage 3–4 CKD — results from a placebo-controlled randomised trial. Nephrol. Dial. Transplant. 2022 Feb 25. gfac043. doi: 10.1093/ndt/gfac043. Epub ahead of print. PMID: 35212735.
122. Sevinc C., Yilmaz G., Ustundag S. The relationship between calcification inhibitor levels in chronic kidney disease and the development of atherosclerosis. Ren. Fail. 2021 Dec. 43(1). 1349-1358. doi: 10.1080/0886022X.2021.1969248. PMID: 34583616. PMCID: PMC8491735.
123. Kuro-O M. Klotho and calciprotein particles as therapeutic targets against accelerated ageing. Clin. Sci (Lond). 2021 Aug 13. 135(15). 1915-1927. doi: 10.1042/CS20201453. PMID: 34374422. PMCID: PMC8355631.
124. Cui Z., Li Y., Liu G., Jiang Y. miR-103a-3p Silencing Ameliorates Calcium Oxalate Deposition in Rat Kidney by Activating the UMOD/TRPV5 Axis. Dis. Markers. 2022 Feb 23. 2022. 2602717. doi: 10.1155/2022/2602717. PMID: 35251369. PMCID: PMC8890864.
125. Poloczek J., Kazura W., Kwaśnicka E., Gumprecht J., Jochem J., Stygar D. Effects of Bariatric Surgeries on Fetuin-A, Selenoprotein P, Angiopoietin-Like Protein 6, and Fibroblast Growth Factor 21 Concentration. J. Diabetes Res. 2021 Aug 6. 2021. 5527107. doi: 10.1155/2021/5527107. PMID: 34414240. PMCID: PMC8369187.
126. Koeppert S., Ghallab A., Peglow S., Winkler C.F., Graeber S., Büscher A., Hengstler J.G., Jahnen-Dechent W. Live Imaging of Calciprotein Particle Clearance and Receptor Mediated Uptake: Role of Calciprotein Monomers. Front. Cell. Dev. Biol. 2021 Apr 29. 9. 633925. doi: 10.3389/fcell.2021.633925. PMID: 33996793. PMCID: PMC8116800.
127. Alshahawey M., El Borolossy R., El Wakeel L., Elsaid T., Sabri N.A. The impact of cholecalciferol on markers of vascular calcification in hemodialysis patients: A randomized placebo controlled study. Nutr. Metab. Cardiovasc. Dis. 2021 Feb 8. 31(2). 626-633. doi: 10.1016/j.numecd.2020.09.014. Epub 2020 Sep 21. PMID: 33594986.
128. Tiong M.K., Krishnasamy R., Smith E.R., Hutchison C.A., Ryan E.G., Pascoe E.M., Hawley C.M., Hewitson T.D., Jardine M.J., Roberts M.A., Cho Y., Wong M.G., Heath A., Nelson C.L., Sen S., Mount P.F., Vergara L.A., Paul-Brent P.A., Johnson D.W., Toussaint N.D. Effect of a medium cut-off dialyzer on protein-bound uremic toxins and mineral metabolism markers in patients on hemodialysis. Hemodial. Int. 2021 Mar 28. doi: 10.1111/hdi.12924. Epub ahead of print. PMID: 33779046.
129. Werida R.H., Abou-Madawy S., Abdelsalam M., Helmy M.W. Omega 3 fatty acids effect on the vascular calcification biomarkers fetuin A and osteoprotegerin in hemodialysis patients. Clin. Exp. Med. 2022 May. 22(2). 301-310. doi: 10.1007/s10238-021-00740-w. Epub 2021 Jul 20. PMID: 34286397.
130. Roca-Tey R., Ramírez de Arellano M., González-Oliva J.C., Roda A., Samon R., Ibrik O., Ugalde-Altamirano J., Viladoms J., Calls J. Is fetuin-A a biomarker of dialysis access dysfunction? J. Vasc. Access. 2021 Jul 29. 11297298211035846. doi: 10.1177/11297298211035846. Epub ahead of print. PMID: 34325543.
131. Kuro-O M. Phosphate as a Pathogen of Arteriosclerosis and Aging. J. Atheroscler. Thromb. 2021 Mar 1. 28(3). 203-213. doi: 10.5551/jat.RV17045. Epub 2020 Oct 8. PMID: 33028781. PMCID: PMC8048948.
132. Fernández P., Douthat W., Castellano M., Cardozo G., Garay G., de Arteaga J., Chiurchiu C., de la Fuente J. Biomarkers of bone and mineral disorders (FGF-23, fetuin-A) and vascular calcification scores as predictive tools for cardiovascular death in dialysis patients, at 10 years of follow-up. Medicina (B Aires). 2021. 81(2). 191-197. English. PMID: 33906137.
133. Lin X., Zhu T., Xu F., Zhong J.Y., Li F., Shan S.K., Wu F., Guo B., Zheng M.H., Wang Y., Xu Q.S., Liao X.B., Lu H.Y., Xie X.B., Yuan L.Q. Plasma Exosomes Derived From Patients With End-Stage Renal Disease and Renal Transplant Recipients Have Different Effects on Vascular Calcification. Front. Cell. Dev. Biol. 2021 Jan 28. 8. 618228. doi: 10.3389/fcell.2020.618228. PMID: 33585452. PMCID: PMC7876285.
134. Düsing P., Zietzer A., Goody P.R., Hosen M.R., Kurts C., Nickenig G., Jansen F. Vascular pathologies in chronic kidney disease: pathophysiological mechanisms and novel therapeutic approa–ches. J. Mol. Med. (Berl.). 2021 Mar. 99(3). 335-348. doi: 10.1007/s00109-021-02037-7. Epub 2021 Jan 22. PMID: 33481059. PMCID: PMC7900031.
135. Chou P.R., Wu P.Y., Wu P.H., Huang T.H., Huang J.C., Chen S.C., Lee S.C., Kuo M.C., Chiu Y.W., Hsu Y.L., Chang J.M., Hwang S.J. Investigation of the Relationship between Cardiovascular Biomarkers and Brachial-Ankle Pulse Wave Velocity in Hemodialysis Patients. J. Pers. Med. 2022 Apr 15. 12(4). 636. doi: 10.3390/jpm12040636. PMID: 35455752. PMCID: PMC9025475.
136. Tiong M.K., Cai M.M.X., Toussaint N.D., Tan S.J., Pasch A., Smith E.R. Effect of nutritional calcium and phosphate loading on calciprotein particle kinetics in adults with normal and impaired kidney function. Sci Rep. 2022 May 5. 12(1). 7358. doi: 10.1038/s41598-022-11065-3. PMID: 35513558. PMCID: PMC9072391.
137. Wu P.Y., Lee S.Y., Chang K.V., Chao C.T., Huang J.W. Gender-Related Differences in Chronic Kidney Disease-Associated Vascular Calcification Risk and Potential Risk Mediators: A Scoping Review. Healthcare (Basel). 2021 Aug 1. 9(8). 979. doi: 10.3390/healthcare9080979. PMID: 34442116. PMCID: PMC8394860.
138. Mohammed S.K., Taha E.M., Muhi S.A. A case-control study to determination FBXW7 and Fetuin-A levels in patients with type 2 diabetes in Iraq. J. Diabetes Metab. Disord. 2021 Jan 21. 20(1). 237-243. doi: 10.1007/s40200-021-00738-x. PMID: 34222065. PMCID: PMC8212217.
139. Uedono H., Mori K., Ochi A., Nakatani S., Miki Y., Tsuda A., Morioka T., Nagata Y., Imanishi Y., Shoji T., Inaba M., Emoto M. Effects of fetuin-A-containing calciprotein particles on posttranslational modifications of fetuin-A in HepG2 cells. Sci Rep. 2021 Apr 5. 11(1). 7486. doi: 10.1038/s41598-021-86881-0. PMID: 33820929. PMCID: PMC8021573.
140. Piwkowska A., Zdrojewski Ł., Heleniak Z., Dębska-Ślizień A. Novel Markers in Diabetic Kidney Disease-Current State and Perspectives. Diagnostics (Basel). 2022 May 11. 12(5). 1205. doi: 10.3390/diagnostics12051205. PMID: 35626360.

/8.jpg)
/9.jpg)
/11.jpg)
/12.jpg)