Журнал «Боль. Суставы. Позвоночник» Том 12, №1, 2022
Вернуться к номеру
Мінеральна щільність кісткової тканини та її зв’язок з показниками тілобудови у пацієнтів, які перенесли мозковий інсульт
Авторы: Бистрицька М.А.
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Мозковий інсульт (МІ) та остеопороз з його ускладненнями — вікасоційовані захворювання, які вражають переважно осіб літнього віку. Метою дослідження було визначити показники мінеральної щільності кісткової тканини (МЩКТ), жирової й знежиреної маси та їхній зв’язок в осіб, які перенесли МІ. Матеріали та методи. Було обстежено 86 пацієнтів, які перенесли МІ, та 86 осіб відповідного віку та статі без неврологічної патології, які становили групу порівняння. МЩКТ, показники знежиреної та жирової маси визначали за допомогою двофотонної рентгенівської абсорбціометрії. Результати. У чоловіків і жінок, які перенесли МІ, частота остеопорозу була вірогідно вищою, ніж в осіб групи порівняння (14,2 та 2,3 %; 20,5 та 4,4 % відповідно). МЩКТ у жінок після інсульту була вірогідно нижчою на рівні всіх обстежених ділянок скелета, у чоловіків відмінності зареєстровані на рівні проксимального відділу стегнової кістки та всього скелета. У чоловіків, які перенесли МІ, виявлено вірогідно нижчі показники індексу знежиреної маси (17,9 ± 1,5 та 19,2 ± 1,8 кг/м2; р < 0,05) та індексу апендикулярної знежиреної маси (7,5 ± 0,4 та 8,5 ± 1,0 кг/м2; р < 0,05), у жінок вірогідних відмінностей показників тілобудови не виявлено, проте частота саркопенії була вірогідно вищою як у чоловіків (28,6 та 9,5 %; р < 0,05), так і в жінок (15,9 та 2,3 %; р < 0,05). У чоловіків обох груп виявлено вірогідні позитивні зв’язки між МЩКТ усього скелета та показниками знежиреної маси. У жінок із МІ отримано залежність показників МЩКТ різної локалізації від жирової та знежиреної маси на відміну від чоловіків, у яких впливу жирової маси на показники кісткової тканини не знайдено. Висновки. Мозковий інсульт призводить до змін МЩКТ й знежиреної (м’язової) маси, а отже, є фактором ризику розвитку остеопорозу та саркопенії.
Background. Stroke and osteoporosis with its complications are age-related diseases that mainly affect the elderly. The aim of the study was to determine the bone mineral density (BMD, fat and lean mass and their association in stroke patients. Materials and methods. Eighty-six stroke patients and 86 age- and sex-matched individuals without neurological disorders as a comparison group were examined. BMD, lean and fat mass were determined using dual-energy X-ray absorptiometry. Results. Men and women with stroke had a significantly higher frequency of osteoporosis than the comparison group (14.2 vs. 2.3 %; 20.5 vs. 4.4 %, respectively). BMD in women with a stroke was lower at the level of all examined areas, in men; differences were registered at the proximal femur and the total body. In men with stroke, significantly lower lean mass index (17.9 ± 1.5 and 19.2 ± 1.8 kg/m2; p < 0.05) and the appendicular lean mass index (7.5 ± 0.4 and 8.5 ± 1.0 kg/m2; p < 0.05) were found, and in women — no significant differences in body composition indices were found, however, the frequency of sarcopenia was significantly higher in both men (28.6 vs. 9.5 %, p < 0.05) and women (15.9 vs. 2.3 %, p < 0.05). In men of both groups, positive correlations between total body BMD and lean mass were registered. The dependence of BMD of different areas on fat and lean mass was obtained in stroke women, in contrast to men, in whom the influence of fat mass on BMD was not found. Conclusion. The stroke leads to changes in bone mineral density and lean (muscle) mass and therefore is a risk factor for the development of osteoporosis and sarcopenia.
остеопороз; мінеральна щільність кісткової тканини; жирова маса; знежирена маса; саркопенія, мозковий інсульт
osteoporosis; bone mineral density; fat mass; lean mass; sarcopenia; stroke
Вступ
Матеріали та методи
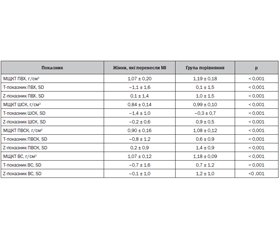
Результати
Обговорення
Висновки
- Luan L., Li R., Wang Z. еt al. Stroke increases the risk of hip fracture: a systematic review and meta-ana–lysis. Osteoporos. Int. 2016 Nov. 27(11). 3149-3154. doi: 10.1007/s00198-016-3632-5. Epub 2016 May 16. PMID: 27185402.
- Yuan Z.C., Mo H., Guan J., He J.L., Wu Z.J. Risk of hip fracture following stroke, a meta-analysis of 13 cohort studies. Osteoporos. Int. 2016 Sep. 27(9). 2673-2679. doi: 10.1007/s00198-016-3603-x. Epub 2016 Apr 22. PMID: 27101998.
- Huo K., Hashim S.I., Yong K.L., Su H., Qu Q.M. Impact and risk factors of post-stroke bone fracture. World J. Exp. Med. 2016 Feb 20. 6(1). 1-8. doi: 10.5493/wjem.v6.i1.1. PMID: 26929915; PMCID: PMC4759351.
- Wei M., Lyu H., Huo K., Su H. Impact of Bone Fracture on Ischemic Stroke Recovery. Int. J. Mol. Sci. 2018 May 22. 19(5). 1533. doi: 10.3390/ijms19051533. PMID: 29786644; PMCID: PMC5983742.
- Xu T., Clemson L., O’Loughlin K., Lannin N.A., Dean C., Koh G. Risk Factors for Falls in Community Stroke Survivors: A Systematic Review and Meta-Analysis. Arch. Phys. Med. Rehabil. 2018 Mar. 99(3). 563-573.e5. doi: 10.1016/j.apmr.2017.06.032. Epub 2017 Aug 7. PMID: 28797618.
- Ryan A.S., Ivey F.M., Serra M.C., Hartstein J., Hafer-Macko C.E. Sarcopenia and Physical Function in Middle-Aged and Older Stroke Survivors. Arch. Phys. Med. Rehabil. 2017 Mar. 98(3). 495-499. doi: 10.1016/j.apmr.2016.07.015. Epub 2016 Aug 13. PMID: 27530769; PMCID: PMC5305627.
- Lee D.H., Joo M.C. Change in Bone Mineral Density in Stroke Patients with Osteoporosis or Osteopenia. Int. J. Environ Res. Public Health. 2022 Jul 23. 19(15). 8954. doi: 10.3390/ijerph19158954. PMID: 35897324; PMCID: PMC9332617.
- Zhang L., Zhang Z.H., Wang Q.R. et al. Stroke and osteoporosis: a Taiwan cohort study. Postgrad. Med. J. 2021 Apr. 97(1146). 211-216. doi: 10.1136/postgradmedj-2019-136959. Epub 2020 Mar 12. PMID: 32165547; PMCID: PMC8005805.
- Lam F.M., Bui M., Yang F.Z., Pang M.Y. Chronic effects of stroke on hip bone density and tibial morphology: a longitudinal study. Osteoporos. Int. 2016 Feb. 27(2). 591-603. doi: 10.1007/s00198-015-3307-7. Epub 2015 Sep 2. PMID: 26329101.
- Sainsbury A., Seebass G., Bansal A., Young J. Reliability of the Barthel Index when used with older people. Age and ageing. 2005. 34. 228-32. doi:10.1093/ageing/afi063.
- Official Positions 2019 ISCD (Adult). https://iscd.org/learn/official-positions/adult-positions/Accessed June 30, 2021.
- Kuriyan R. Body composition techniques. Indian J. Med. Res. 2018 Nov. 148(5). 648-658. doi: 10.4103/ijmr.IJMR_1777_18. PMID: 30666990; PMCID: PMC6366261.
- Wang H.P., Sung S.F., Yang H.Y., Huang W.T., Hsieh C.Y. Associations between stroke type, stroke severity, and pre-stroke osteoporosis with the risk of post-stroke fracture: A nationwide population-based study. J. Neurol. Sci. 2021 Aug 15. 427. 117512. doi: 10.1016/j.jns.2021.117512. Epub 2021 May 28. PMID: 34082148.
- Kim H.D., Kim S.H., Kim D.K., Jeong H.J., Sim Y.J., Kim G.C. Change of Bone Mineral Density and Relationship to Clinical Parameters in Male Stroke Patients. Ann. Rehabil. Med. 2016 Dec. 40(6). 981-988. doi: 10.5535/arm.2016.40.6.981. Epub 2016 Dec 30. PMID: 28119827; PMCID: PMC5256333.
- Kapral M.K., Fang J., Alibhai S.M. et al. Risk of fractures after stroke: Results from the Ontario Stroke Re–gistry. Neurology. 2017 Jan 3. 88(1). 57-64. doi: 10.1212/WNL.0000000000003457. Epub 2016 Nov 23. PMID: 27881629; PMCID: PMC5200858.
- Crivelli M., Chain A., da Silva I.T.F., Waked A.M., Bezerra F.F. Association of Visceral and Subcutaneous Fat Mass With Bone Density and Vertebral Fractures in Women With Severe Obesity. J. Clin. Densitom. 2021 Jul-Sep. 24(3). 397-405. doi: 10.1016/j.jocd.2020.10.005. Epub 2020 Oct 16. PMID: 33109469.
- Koh I.S., Minn Y.K., Suk S.H. Body Fat Mass and Risk of Cerebrovascular Lesions: The PRESENT (Prevention of Stroke and Dementia) Project. Int. J. Environ Res. Public Health. 2019 Aug 8. 16(16). 2840. doi: 10.3390/ijerph16162840. PMID: 31398929; PMCID: PMC6721138.
- Hunnicutt J.L., Gregory C.M. Skeletal muscle changes following stroke: a systematic review and comparison to healthy individuals. Top Stroke Rehabil. 2017 Sep. 24(6). 463-471. doi: 10.1080/10749357.2017.1292720. Epub 2017 Mar 2. PMID: 28251861; PMCID: PMC5801663.

/8.jpg)
/9.jpg)
/10.jpg)