Журнал «Боль. Суставы. Позвоночник» Том 12, №1, 2022
Вернуться к номеру
Порушення функції скелетних м’язів, саркопенія та саркопенічне ожиріння у хворих на хронічне обструктивне захворювання легень
Авторы: Масік Н.П., Степанюк Т.В., Масік О.І.
Вінницький національний медичний університет ім. М.І. Пирогова, м. Вінниця, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
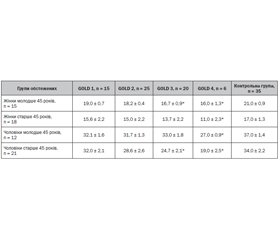
Актуальність. Хронічне обструктивне захворювання легень (ХОЗЛ) часто поєднується з порушеннями функції опорно-рухового апарату, зокрема дисфункцією скелетних м’язів, саркопенією, остеопорозом та ожирінням. Мета: оцінити стан скелетних м’язів та визначити поширеність саркопенії та саркопенічного ожиріння у пацієнтів із ХОЗЛ. Матеріали та методи. Обстежено 66 хворих на ХОЗЛ і 35 здорових осіб. Саркопенію встановлювали на основі критеріїв EWGSOP2, а саркопенічне ожиріння — за наявності саркопенії з індексом маси тіла > 25 кг/м2. Результати. У 59,1 % хворих на ХОЗЛ виявлено зниження сили скелетних м’язів, зокрема, на 28,2 % у жінок і на 39,1 % у чоловіків при GOLD 4 порівняно з GOLD 1 і на 40,7 і 54,3 % відповідно порівняно з контролем. Зменшення окружності гомілки (на 16,3 % у жінок і на 20,8 % у чоловіків) визначено при GOLD 4 порівняно з GOLD 1. Встановлено зниження швидкості ходи на 20 % у жінок і на 27,3 % у чоловіків при GOLD 4 порівняно з GOLD 1 та вірогідний кореляційний зворотний зв’язок між віком та швидкістю ходи (r = –0,72 — у жінок та r = –0,61 — у чоловіків). Встановлено вірогідне зниження знежиреної маси кінцівок у хворих на ХОЗЛ старше 45 років і при GOLD 2, індексів знежиреної й жирової маси — при GOLD 3, апендикулярної знежиреної маси — при GOLD 4 і у хворих старше 60 років. Встановлено прямий кореляційний зв’язок між тяжкістю ХОЗЛ і андроїдним типом ожиріння (r = 0,41; p < 0,05). Висновки. Саркопенію діагностовано у 66,7 % хворих на ХОЗЛ та 5,7 % контрольної групи, а саркопенічне ожиріння — у 27,3 % хворих на ХОЗЛ. Зростання частки саркопенії спостеріглось з віком (з 50 % у молодих осіб до 91,7 % в осіб старше 60 років), так само, як і саркопенічного ожиріння (з 25 % осіб молодше 45 років до 55,6 % старше 60 років), та зі збільшенням тяжкості ХОЗЛ (з 20 % при GOLD 1 до 100 % при GOLD 4 і з 42,9 % з GOLD 1 до 50 % з GOLD 4 відповідно).
Background. Chronic obstructive pulmonary disease (COPD) is often associated with musculoskeletal dysfunction, including skeletal muscle dysfunction, sarcopenia, osteoporosis, and obesity. The purpose was to assess skeletal muscle status and determine the prevalence of sarcopenia and sarcopenic obesity in patients with COPD. Materials and methods. 66 patients with COPD and 35 healthy subjects had been examined. Sarcopenia was established using EWGSOP2 criteria, and sarcopenic obesity was defined in the presence of sarcopenia with a body mass index > 25 kg/m2. Results. In 59.1 % of the patients with COPD, a decrease in skeletal muscle strength was found, in particular, by 28.2 % in women and by 39.1 % in men at GOLD 4 in comparison with GOLD 1 and by 40.7 % and 54.3 %, respectively, compared to the control. A decrease in leg circumference (by 16.3 % in women and by 20.8 % in men) was determined at GOLD 4 compared to GOLD 1. A decrease in walking speed by 20 % in women and by 27.3 % in men was determined at GOLD 4 in comparison with GOLD 1 and a reliable correlation inverse connection between age and walking speed (r = –0.72 — in women and r = –0.61 — in men). A significant decrease in the lean mass of the limbs was established in COPD patients over 45 years old and with GOLD 2, lean and fat mass indices — with GOLD 3, appendicular lean mass — with GOLD 4 and over 60 years old. A direct correlation link was established between the severity of COPD and android type of obesity (r = 0.41; p < 0.05). Conclusions. Sarcopenia was diagnosed in 66.7 % of the patients with COPD and 5.7 % of the control group, and sarcopenic obesity was diagnosed in 27.3 % of the patients with COPD. An increase in the share of sarcopenia was observed with age (from 50 % among young people to 91.7 % among subjects over 60 years old) and sarcopenic obesity (from 25 % of subjects under 45 years old to 55.6 % over 60 years old) and with increasing severity of COPD (from 20 % with GOLD 1 to 100 % with GOLD 4 and from 42.9 % with GOLD 1 to 50 % with GOLD 4, respectively).
хронічне обструктивне захворювання легень; м’язова тканина; знежирена маса; дисфункція скелетних м’язів; саркопенія; саркопенічне ожиріння; вік
chronic obstructive pulmonary disease (COPD); muscle tissue; lean mass; skeletal muscle dysfunction; sarcopenia; sarcopenic obesity; age
Вступ
Матеріали та методи
Методи дослідження
Результати
Обговорення
Висновки
- Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease: 2020 Report. Режим доступу: https://goldcopd.org/wp-content/uploads/2019/12/GOLD-2020-FINAL-ver1.2-03Dec19_WMV.pdf.
- Фещенко Ю.І., Гаврисюк В.К., Дзюблик О.Я. та ін. Адаптована клінічна настанова: хронічне обструктивне захворювання легень. Український пульмонологічний журнал. 2020. 3. 5-36. doi: 10.31215/2306-4927-2020-109-3-5-36.
- Островський М.М., Корж Н.В. Маркери системного запалення та надмірна маса тіла у хворих на хронічне обструктивне захворювання легень із ІІІ ступенем бронхообструкції. Астма та алергія. 2019. 2. 39-45. doi: 10.31655/2307-3373-2019-2-10-16.
- Vieira R., Nogueira I., Queiroz N. et al. Peripheral and respiratory muscle strength in chronic obstructive pulmonary disease. Rev. Bras. Cineantropom Desempenho Hum. 2018. 20(2). 125-133. doi: 10.5007/1980-0037.2018v20n2p125.
- Демчук А.В., Мостовой Ю.М., Побережець В.Л. Метаболічні фенотипи ХОЗЛ: особливості курації пацієнта. Астма та алергія. 2019. 2. 39-45. doi: 10.31655/2307-3373-2019-2-39-45.
- Поворознюк В.В., Дзерович Н.І. Саркопенія (огляд літератури). Журнал Національної академії медичних наук України. 2019. 25(3). 321-331.
- Cruz-Jentoft A.J., Bahat G., Bauer J. et al.; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019 Jan 1. 48(1). 16-31. doi: 10.1093/ageing/afy169. PMID: 30312372; –PMCID: PMC6322506.
- Limpawattana P., Inthasuwan P., Putraveephong S., Boonsawat W., Theerakulpisut D., Sawanyawisuth K. Sarcopenia in chronic obstructive pulmonary disease: A study of prevalence and associated factors in the Southeast Asian population. Chron. Respir. Dis. 2018 Aug. 15(3). 250-257. doi: 10.1177/1479972317743759. PMID: 29186972; –PMCID: PMC6100162.
- Gea J., Pascual S., Casadevall C., Orozco-Levi M., Barreiro E. Muscle dysfunction in chronic obstructive pulmonary disease: update on causes and biological findings. J. Thorac. Dis. 2015 Oct. 7(10). E418-438. doi: 10.3978/j.issn.2072-1439.2015.08.04. PMID: 26623119; PMCID: PMC4635259.
- Kim S.H., Shin M.J., Shin Y.B., Kim K.U. Sarcopenia Associated with Chronic Obstructive Pulmonary Disease. J. Bone Metab. 2019 May. 26(2). 65-74. doi: 10.11005/jbm.2019.26.2.65. PMID: 31223602; PMCID: PMC6561852.
- Roh E., Choi K.M. Health Consequences of Sarcopenic Obesity: A Narrative Review. Front Endocrinol (Lau–sanne). 2020 May 21. 11. 332. doi: 10.3389/fendo.2020.00332. PMID: 32508753; PMCID: PMC7253580.
- Geltser B.I., Kurpatov I.G., Dej A.A., Kozhanov A.G. Respiratory muscles dysfunction and respiratory diseases. Ter. Arkh. 2019 Mar 30. 91(3). 93-100. doi: 10.26442/00403660.2019.03.000108. PMID: 31094466.
- Давузов Р.Р. Системное воспаление как предиктор саркопении у пациентов с хронической обструктивной болезнью легких. Вестник КРСУ. 2020. Т. 20. № 9. С. 36-40. http://vestnik.krsu.edu.kg/archive/157/6655.
- Lee K., Shin Y., Huh J., Sung Y.S., Lee I.S., Yoon K.H., Kim K.W. Recent Issues on Body Composition Imaging for Sarcopenia Evaluation. Korean J. Radiol. 2019 Feb. 20(2). 205-217. doi: 10.3348/kjr.2018.0479. PMID: 30672160; PMCID: PMC6342757.
- Наказ Міністерства охорони здоров’я від 27 червня 2013 року № 555 «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації. Хронічне обструктивне захворювання легені». http://mtd.dec.gov.ua/images/dodatki/2013_555_HOZL/2013_555hozl_ykpmd.pdf.
- Jang H.C. How to diagnose sarcopenia in Korean older adults. Ann. Geriatr. Med. Res. 2018. 22. 73-79. doi: 10.4235/agmr.2018.22.2.73.
- Jones S.E., Maddocks M., Kon S.S. et al. Sarcopenia in COPD: prevalence, clinical correlates and response to pulmonary rehabilitation. Thorax. 2015. 70. 213-218. doi: 10.1136/thoraxjnl-2014-206440.
- Byun M.K., Cho E.N., Chang J., Ahn C.M., Kim H.J. Sarcopenia correlates with systemic inflammation in COPD. Int. J. Chron. Obstruct. Pulmon. Dis. 2017 Feb 20. 12. 669-675. doi: 10.2147/COPD.S130790. PMID: 28255238; PMCID: PMC5325093.
- Benz E., Trajanoska K., Lahousse L. et al. Sarcopenia in COPD: a systematic review and meta-analysis. European respiratory review: an official journal of the European Respiratory Society. 2019. 28. 190049. doi: 10.1183/16000617.0049-2019.
- Sepúlveda-Loyola W., Osadnik C., Phu S., Morita A.A., Duque G., Probst V.S. Diagnosis, prevalence, and clinical impact of sarcopenia in COPD: a systematic review and meta-analysis. J. Cachexia Sarcopenia Muscle. 2020 Oct. 11(5). 1164-1176. doi: 10.1002/jcsm.12600. PMID: 32862514; PMCID: PMC7567149.
- Vestbo J., Prescott E., Almdal T. et al. Body mass, fat-free body mass, and prognosis in patients with chronic obstructive pulmonary disease from a random population sample: findings from the Copenhagen City Heart Study. Am. J. Respir. Crit. Care Med. 2006. 1. 173(1). 79-83. doi: 10.1164/rccm.200506-969OC. PMID: 16368793.
- Tashiro H., Takahashi K., Tanaka M. et al. Skeletal muscle is associated with exercise tolerance evaluated by cardiopulmonary exercise testing in Japanese patients with chronic obstructive pulmonary disease. Sci. Rep. 2021 Aug 5. 11(1). 15862. doi: 10.1038/s41598-021-95413-9. PMID: 34354171; PMCID: PMC8342424.
- Bui K.L., Nyberg A., Rabinovich R., Saey D., Maltais F. The Relevance of Limb Muscle Dysfunction in Chronic Obstructive Pulmonary Disease: A Review For Clinicians. Clin. Chest Med. 2019 Jun. 40(2). 367-383. doi: 10.1016/j.ccm.2019.02.013. PMID: 31078215.
- Tényi Á., Cano I., Marabita F. et al. Network mo–dules uncover mechanisms of skeletal muscle dysfunction in COPD patients. J. Transl. Med. 2018. 16. 34. doi: 10.1186/s12967-018-1405-y.
- Iepsen U.W., Pedersen B.K. Development of Limb Muscle Dysfunction in Chronic Obstructive Pulmonary Disease: Smoking, Inflammation, or Simply Disuse? Am. J. Respir. Cell Mol. Biol. 2020 Feb. 62(2). 134-135. doi: 10.1165/rcmb.2019-0319ED. PMID: 31532223; PMCID: PMC6993543.
- Martínez-Luna N., Orea-Tejeda A., González-Islas D. et al. Association between body composition, sarcopenia and pulmonary function in chronic obstructive pulmonary disease. BMC Pulm. Med. 2022 Mar 26. 22(1). 106. doi: 10.1186/s12890-022-01907-1. PMID: 35346135; PMCID: PMC8962175.
- Cruthirds C.L., van der Meij B.S., Wierzchowska-McNew A., Deutz N.E.P., Engelen M.P.K.J. Presence or absence of skeletal muscle dysfunction in chronic obstructive pulmonary disease is associated with distinct phenotypes. Arch. Bronconeumol. (Engl Ed). 2021 Apr. 57(4). 264-272. doi: 10.1016/j.arbres.2019.12.034. PMID: 32115277.
- Goërtz Y.M.J., Spruit M.A., Van’t Hul A.J. et al. Fatigue is highly prevalent in patients with COPD and correlates poorly with the degree of airflow limitation. Therapeutic Advances in Respiratory Disease. 2019. 13. 1-13. doi: 10.1177/1753466619878128.
- Sharanya A., Ciano M., Withana S., Kemp P.R., Polkey M.I., Sathyapala S.A. Sex differences in COPD-related quadriceps muscle dysfunction and fibre abnormalities. Chron. Respir. Dis. 2019 Jan-Dec. 16. 1479973119843650. doi: 10.1177/1479973119843650. PMID: 31131626; PMCID: PMC6537500.
- Batsis J.A., Mackenzie T.A., Lopez-Jimenez F., Bartels S.J. Sarcopenia, sarcopenic obesity, and functional impairments in older adults: National Health and Nutrition Examination Surveys 1999-2004. Nutr. Res. 2015 Dec. 35(12). 1031-9. doi: 10.1016/j.nutres.2015.09.003. PMID: 26472145; PMCID: PMC4825802.
- Hwang B., Lim J.Y., Lee J., Choi N.K., Ahn Y.O., Park B.J. Prevalence rate and associated factors of sarcopenic obesity in korean elderly population. J. Korean Med. Sci. 2012 Jul. 27(7). 748-755. doi: 10.3346/jkms.2012.27.7.748. PMID: 22787369; PMCID: PMC3390722.
- Donini L.M., Busetto L., Bischoff S.C. et al. Definition and Diagnostic Criteria for Sarcopenic Obesity: –ESPEN and EASO Consensus Statement. Obes. Facts. 2022. 15(3). 321-335. doi: 10.1159/000521241. PMID: 35196654; –PMCID: PMC9210010.
- Кim T.N., Park M.S. et al. Impact of visceral fat on skeletal muscle mass and vice versa in a prospective cohort study: the Korean Sarcopenic Obesity Study (KSOS). PLoS One. 2014 Dec 17. 9(12). e115407. doi: 10.1371/journal.pone.0115407. PMID: 25517117; PMCID: PMC4269440.
- Pan J., Xu L., Lam T.H. et al. Association of adiposity with pulmonary function in older Chinese: Guangzhou Biobank Cohort Study. Respir. Med. 2017 Nov. 132. 102-108. doi: 10.1016/j.rmed.2017.10.003. PMID: 29229080.
- Wu Z., Yang D., Ge Z., Yan M., Wu N., Liu Y. Body mass index of patients with chronic obstructive pulmonary disease is associated with pulmonary function and exacerbations: a retrospective real world research. J. Thorac. Dis. 2018. 10(8). 5086-5099. doi: 10.21037/jtd.2018.08.67. PMID: 30233884; PMCID: PMC6129899.

/14.jpg)
/15.jpg)
/16.jpg)