Журнал «Боль. Суставы. Позвоночник» Том 12, №1, 2022
Вернуться к номеру
Паранеопластичний артрит — на перехресті ревматології та онкології
Авторы: Єгудіна Є.Д. (1), Трипілка С.А. (2)
(1) — Клініка сучасної ревматології, м. Київ, Україна
(2) — Комунальне некомерційне підприємство Харківської обласної ради «Обласна клінічна лікарня», м. Харків, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Паранеопластичні артрити (ПА) являють собою групу запальних артропатій, асоційованих з прихованим або явним злоякісним новоутворенням, що локалізовані у віддаленому місці щодо первинного вогнища та викликані імуноопосередкованими механізмами. Хоча патогенез ПА невідомий, імуноопосередковані механізми можуть викликати паранеопластичний синдром із домінантною ознакою — поліартритом. Артрит може бути як початковим проявом захворювання, так і виявлятись за деякий час до маніфестації онкологічного процесу. Поширені форми ПА включають паранеопластичний оліго-/поліартрит; гіпертрофічну остеоартропатію; ремітуючий серонегативний симетричний синовіт з подушкоподібним набряком, при натисканні на який утворюється ямка; долонний фасціїт та панкреатичний панікуліт, асоційований з карциномою підшлункової залози. Метою цієї оглядової статті було надати клінічні характеристики, діагностичну оцінку та обговорити лікування ПА, а також виділити проблеми, з якими можуть зіткнутися медичні працівники, щоб відрізнити ці стани від інших автоімунних ревматичних захворювань. Необхідні подальші дослідження для розуміння механізмів, асоційованих з ПА, та розробки нових діагностичних біомаркерів.
Paraneoplastic arthritides (PA) are a group of inflammatory arthropathies associated with latent or manifest malignancy, localized in a distant site in relation to the primary focus and caused by immune-mediated mechanisms. Although the pathogenesis of PA is unknown, immune-mediated mechanisms can cause paraneoplastic syndrome with a dominant feature of polyarthritis. Arthritis can be both the initial manifestation of the disease, and it can manifest itself some time before the oncological process. Common forms of PA include paraneoplastic oligo/polyarthritis; hypertrophic osteoarthropathy; remitting seronegative symmetric synovitis with pitting edema; palmar fasciitis and pancreatic panniculitis associated with pancreatic carcinoma. The purpose of this review article was to describe the clinical characteristics, diagnostic assessment and treatment of paraneoplastic arthritis, and highlight the challenges that healthcare professionals may face in order to distinguish these conditions from other autoimmune rheumatic diseases. Further research is needed to understand the mechanisms associated with PA and to develop new diagnostic biomarkers.
паранеопластичний артрит; поліартрит; гіпертрофічна остеоартропатія; долонний фасціїт; панікуліт
paraneoplastic arthritis; polyarthritis; hypertrophic osteoarthropathy; palmar fasciitis; panniculitis
Вступ
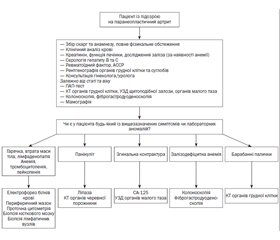
Діагностична оцінка паранеопластичних артритів
Висновки
- Manger B., Schett G. Rheumatic paraneoplastic syndromes — a clinical link between malignancy and autoimmunity. Clin. Immunol. 2018. 186. 67-70. doi: 10.1016/j.clim.2017.07.021.
- Rast F., Parperis K., Amar S., Al-Charakh M. Paraneoplastic inflammatory arthritis. Cureus. 2018. 10(5). e2663. doi: 10.7759/cureus.2663.
- Rugienė R., Dadonienė J., Aleknavičius E., et al. Prevalence of paraneoplastic rheumatic syndromes and their antibody profile among patients with solid tumours. Clin. Rheumatol. 2011. 30(3). 373-80. doi: 10.1007/s10067-010-1676-z.
- Manger B., Schett G. Paraneoplastic syndromes in rheumatology. Nat. Rev. Rheumatol. 2014. 10(11). 662-670. doi: 10.1038/nrrheum.2014.138.
- Kisacik B., Onat A.M., Kasifoglu T., et al. Diagnostic dilemma of paraneoplastic arthritis: case series. Int. J. Rheum. Dis. 2014. 17(6). 640-645. doi: 10.1111/1756-185X.12277.
- Butler R.C., Thompson J.M., Keat A.C. Paraneoplastic rheumatic disorders: a review. J. R. Soc. Med. 1987. 80(3). 168-172.
- Daneshpouy M., Bataille D., Rivet J., et al. Peripheral T-cell lymphoma with eosinophilia presenting as monoarthritis: a case study. Leuk Lymphoma. 2002. 43(9). 1875-1879. doi: 10.1080/1042819021000006358.
- Ito T., Goto K., Yoh K., et al. Hypertrophic pulmonary osteoarthropathy as a paraneoplastic manifestation of lung cancer. J. Thorac. Oncol. 2010. 5(7). 976-980. doi: 10.1097/JTO.0b013e3181dc1f3c.
- Pineda C., Martínez-Lavín M. Hypertrophic osteoarthropathy: what a rheumatologist should know about this uncommon condition. Rheum. Dis. Clin. North Am. 2013. 39. 383-400. doi: 10.1016/j.rdc.2013.02.008.
- Karmacharya P., Donato A.A., Aryal M.R., et al. RS3PE revisited: a systematic review and meta-analysis of 331 cases. Clin. Exp. Rheumatol. 2016. 34(3). 404-415. PMID: 27050250.
- Li H., Altman R.D., Yao Q. RS3PE: clinical and research development. Curr. Rheumatol. Rep. 2015. 17(8). 49. doi: 10.1007/s11926-015-0525-0.
- Arima K., Origuchi T., Tamai M., et al. RS3PE syndrome presenting as vascular endothelial growth factor associated disorder. Ann. Rheum. Dis. 2005. 64(11). 1653-1655. doi: 10.1136/ard.2004.032995.
- Tabeya T., Sugaya T., Suzuki C., et al. A case of angioimmunoblastic T-cell lymphoma with high serum VEGF preceded by RS3PE syndrome. Mod. Rheumatol. 2016. 6(2). 281-285. doi: 10.3109/14397595.2013.857836.
- Manger B., Schett G. Palmar fasciitis and polyarthritis syndrome-systematic literature review of 100 cases. Semin Arthritis Rheum. 2014. 44(1). 105-111. doi: 10.1016/j.semarthrit.2014.03.005.
- Di Battista J., Cipolletta E., Di Carlo M., et al. Palmar Fasciitis and Polyarthritis Syndrome Associated With Ovarian Cancer. A Case Report JCR: Journal of Clinical Rheumatology. 2020. 26(6). e193-e196. doi: 10.1097/RHU.0000000000001062.
- Arbeláez-Cortés A., Vanegas-García A.L., Restrepo-Escobar M., Correa-Londoño L.A., González-Naranjo L.A. Polyarthritis and pancreatic panniculitis associated with pancreatic carcinoma: review of the literature. J. Clin. Rheumatol. 2014. 20(8). 433-436. doi: 10.1097/RHU.0000000000000181.
- Narváez J., Bianchi M.M., Santo P., et al. Pancreatitis, panniculitis, and polyarthritis. Semin Arthritis Rheum. 2010. 39(5). 417-23. doi: 10.1016/j.semarthrit.2008.10.001.
- Borowicz J., Morrison M., Hogan D., Miller R. Subcutaneous fat necrosis/panniculitis and polyarthritis associatedwith acinar cell carcinoma of the pancreas: a rare presentation of pancreatitis, panniculitis and polyarthritis syndrome. J. Drugs Dermatol. 2010. 9(9). 1145-1150. PMID: 20865849.
- Zundler S., Erber R., Agaimy A., et al. Pancreatic panniculitis in a patient with pancreatic-type acinar cell carcinoma of the liver — case report and review of literature. BMC Cancer. 2016. 16. 130. doi: 10.1186/s12885-016-2184-6.
- Yamashita Y., Joshita S., Ito T., Maruyama M., Wada Sh., Umemura T. A case report of pancreatic panniculitis due to acute pancreatitis with intraductal papillary mucinous neoplasm. BMC Gastroenterol. 2020. 24. 20(1). 286. doi: 10.1186/s12876-020-01430-9.
- Kim E.J., Park M.S., Son H.-G., et al. Pancreatitis, Panniculitis, and Polyarthritis Syndrome Simulating Cellulitis and Gouty Arthritis. The Korean Journal of Gastroenterology. 2019. 74(3). 175-182. doi: 10.4166/kjg.2019.74.3.175.
- Adu-Gyamfi K.O., Patri S., Boapimp P., Gyamfi R. Leukemic Arthritis in Chronic Lymphocytic Leukemia Mimicking Both Gout and Septic Arthritis. J. Clin. Rheumatol. 2021. 27(6). e238-e240. doi: 10.1097/RHU.0000000000001376.
- Schultz H., Krenn V., Tony H.P. Oligoarthritis mediated by tumor-specific T lymphocytes in renal-cell carcinoma. N. Engl. J. Med. 1999. 341(4). 290-291. doi: 10.1056/NEJM199907223410415.
- Bojinca V., Janta I. Rheumatic Diseases and Malignancies. Maedica (Bucur). 2012 Dec. 7 (4). 364-371.
- Naschitz J.E. Rheumatic syndromes: clues to occult neoplasia. Curr. Opin. Rheumatol. 2001. 13(1). 62-66. doi: 10.1097/00002281-200101000-00010.
- Gur H., Koren V., Ehrenfeld M., Ben-Bassat I., Sidi Y. Rheumatic manifestations preceding acute leukemia: characteristics and implication in the course and prognosis. Acta Haematol. 1999. 101(1). 1-6. doi: 10.1159/000040913.
- Yamashita H., Ueda Y., Ozaki T., et al. Characteristics of 10 patients with paraneoplastic rheumatologic musculoskeletal manifestations. Mod. Rheumatol. 2014. 24(3). 492-498. doi: 10.3109/14397595.2013.843762.
- Morel J., Deschamps V., Toussirot E., et al. Characteristics and survival of 26 patients with paraneoplastic arthritis. Ann. Rheum. Dis. 2008. 67(2). 244-247. doi: 10.1136/ard.2007.070086.
- Hakkou J., Rostom S., Bahiri R., Hajjaj-Hassouniet N. Paraneoplastic rheumatic syndromes: report of eight cases and review of literature. Rheumatol. Int. 2012. 32(6). 1485-1489. doi: 10.1007/s00296-011-2252-9.
- Larson E., Etwaru D., Siva C., Lawlor K. Report of anti-CCP antibody positive paraneoplastic polyarthritis and review of the literature. Rheumatol. Int. 2011. 31(12). 1635-1638. doi: 10.1007/s00296-009-1294-8.
- Silveira L.H., Martínez-Lavín M., Pineda C., Fonseca M.C., Navarro C., Nava A. Vascular endothelial growth factor and hypertrophic osteoarthropathy. Clin. Exp. Rheumatol. 2000. 18(1). 57-62. PMID: 10728444.
- Atkinson S., Fox S.B. Vascular endothelial growth factor (VEGF)-A and platelet-derived growth factor (PDGF) play a central role in the pathogenesis of clubbing. J. Pathol. 2004. 203(2). 721-728. doi: 10.1002/path.1565.
- Olán F., Portela M., Navarro C., et al. Circulating vascular endothelial growth factor concentrations in a case of pulmonary hypertrophic osteoarthropathy. Correlation with disease activity. J. Rheumatol. 2004. 31(3). 614-616. PMID: 14994415.
- Yao Q., Altman R.D., Brahn E. Periostitis and hypertrophic pulmonary osteoarthropathy: report of 2 cases and review of the literature. Semin Arthritis Rheum. 2009. 38(6). 458-466. doi: 10.1016/j.semarthrit.2008.07.001.
- Slobodin G., Rosner I., Feld J., et al. Pamidronate treatment in rheumatology practice: a comprehensive review. Clin. Rheumatol. 2009. 28(12). 1359-1364. doi: 10.1007/s10067-009-1256-2.
- King M.M., Nelson D.A. Hypertrophic osteoarthropathy effectively treated with zoledronic acid. Clin. Lung Cancer. 2008. 9(3). 179-182. doi: 10.3816/CLC.2008.n.027.
- Lakhmalla M., Dahiya D.S., Kichloo A., Fatima T., Edigin E., Wani F. Remitting seronegative symmetrical synovitis with pitting edema: a review. Journal of Investigative Medicine. 2021. 69(1). 86-90. doi: 10.1136/jim-2020-001613.
- McCarty D.J,. O’Duffy J.D., Pearson L., Hunter J.B. Remitting seronegative symmetrical synovitis with pitting edema. RS3PE syndrome. JAMA. 1985. 254(19). 2763-2767.
- Sibilia J., Friess S., Schaeverbeke T., et al. Remitting seronegative symmetrical synovitis with pitting edema (RS3PE): a form of paraneoplastic polyarthritis? J. Rheumatol. 1999. 26(1). 115-120. PMID: 9918251.
- Medsger T.A., Dixon J.A., Garwood V.F. Palmar fasciitis and polyarthritis associated with ovarian carcinoma. Ann. Intern. Med. 1982. 96(4). 424-431. doi: 10.7326/0003-4819-96-4-424.
- Kajikawa H., Sobajima N., Koiwai C., Ichigo S., Takagi H., Imai A. Palmar fasciitis with polyarthritis-associated ovarian cancer: Case report and literature review. Mol. Clin. Oncol. 2018. 8(2). 292-295. doi: 10.3892/mco.2017.1509.
- Parperis K., Constantinidou A., Panos G. Paraneoplastic Arthritides: Insights to Pathogenesis, Diagnostic Approach, and Treatment. J. Clin. Rheumatol. 2021. 27(8). e505-e509. doi: 10.1097/RHU.0000000000001202.

/29.jpg)
/30.jpg)
/31.jpg)