1. Вступ
Інсульт залишається серйозною проблемою для здоров’я, від якої страждають мільйони людей в усьому світі. При цьому він посідає друге місце у структурі причин смерті та третє серед причин інвалідності [1]. Приблизно 60–80 % усіх інсультів є ішемічними і виникають у результаті тромботичної або емболічної оклюзії церебральної артерії [2]. З роками лікування гострого ішемічного інсульту зазнало багато змін. Все ще залишається невеликою кількість пацієнтів, у яких є можливість застосувати такі методи, як реканалізація, тромболізис і механічна тромбектомія. Тому були розроблені різні терапевтичні стратегії, спрямовані на патофізіологічний каскад, який запускається внаслідок ішемії та призводить до необоротного пошкодження тканин [3, 4].
Інноваційні концепції нейропротекції та нейровідновлення активно вивчалися в багатьох клінічних дослідженнях у минулому. Однак лише дані кількох досліджень за останні десятиліття змогли збільшити кількість позитивних результатів щодо широкої концепції захисту та реабілітації мозку, при цьому в них розглядалися специфічні підходи, що мали суперечливі докази, а також приділялася увага терапевтичним схемам, які зосереджені на стратегіях супресії або понятті мономодальності (препарати, що мають єдиний механізм дії) [5].
Після гострої черепно-мозкової травми відбувається активація внутрішньої захисної системи (відомої як ендогенна захисна активність), що складається з двох ланцюгів: нейропротекції (негайний процес, основною метою якого є обмеження пошкодження нейронів) і нейровідновлення (у ньому виділяють три різні гілки — нейротрофічність, нейропластичність і нейрогенез) [5].
Поняття мультимодальності, якщо розглядати його з точки зору нейрофармакологічної термінології, стосується зв’язку нейропротекції з довгостроковими репараційними процесами, які формують ней-рорегенерацію, віддзеркалюючи фізіологічну послідовність ендогенної регуляції після ураження. Були розглянуті різні спроби інтегрувати цю концепцію, при цьому використання мономодальних препаратів було виключене як неефективне. Але оптимальним рішенням, на основі сучасних досліджень, вважається використання в структурі нейрореабілітації мультимодальних препаратів із плейотропним нейропротекторним ефектом [5].
Що стосується препаратів, які можуть забезпечити доведену користь у постішемічному періоді, ефективними як у гострій, так і в хронічній фазах інсульту є препарати з нейровідновлювальними властивостями [6]. Суттєвою перевагою нейровідновлюючих препаратів є їх пролонгована ефективність, відсутність обмежень у часі при ішемії головного мозку. Оскільки їх доступність перевищує аферентне терапевтичне вікно інсульту (наприклад, таке, що відоме для тканинного активатора плазміногену — tPA), цей тип фармакологічних засобів можна використовувати протягом декількох днів, якщо не тижнів, після виникнення ішемії. Для підсилення неврологічного відновлення відновлювальне лікування має поєднуватися з реабілітацією, яка, ймовірно, діє синергічно [5]. Сучасні дані свідчать про те, що у понад 70 % пацієнтів з інсультом, які отримали користь від тромбектомії та tPA, швидкість перфузії уражених тканин все ще була нижче від оптимальних параметрів. Оскільки повне відновлення перфузії тканин після таких уражень неможливе, у багатьох із тих, хто вижив, розвивається подальший неврологічний дефіцит [6].
Доведено, що Церебролізин, комбінація амінокислот і пептидів, які повторюють біологічні ефекти нейротрофічних факторів, забезпечує сприятливі результати при застосуванні після ішемічного інсульту, зберігаючи при цьому обнадійливий профіль безпеки. Він зменшує кількість прокоагулянтних, протромботичних і прозапальних медіаторів, підтримуючи нормальну функцію мікроциркуляторного русла головного мозку після ішемії. Істотна кількість запальних цитокінів утворюється внаслідок пошкоджень гематоенцефалічного бар’єра (ГЕБ), спричинених не лише молекулами фібрину, а й тромболізисом (з tPA). Таким чином, мультимодальний препарат може підвищити терапевтичну ефективність і безпеку тромболітичних засобів і тромбектомії, захищаючи ГЕБ [6].
У результаті майбутня терапія може включати нейропротектори з більше ніж одним механізмом дії; отже, слід систематично та інтенсивно досліджувати мультимодальність разом із відкриттям нових агентів і ретельним дослідженням тих, які продемонстрували нейропротекторний потенціал не лише до початку реканалізації, але й під час її. Згодом такі дії можуть призвести до подальшого посилення функціонального результату, захищаючи мозок як від ішемії, так і від реперфузійного ураження [6].
2. Концепція нейропротекції та нейрорегенерації
Інсульт має негайні та віддалені наслідки, такі як порушення рухів, чутливості, когнітивних, психологічних та емоційних функцій, зменшення незалежності від сторонньої допомоги та погіршення якості життя. Крім того, нейропластичні зміни, що виникають після інфаркту мозку, можуть розвиватися протягом днів, тижнів, місяців або навіть років. Однак, незважаючи на весь прогрес у розумінні поширення ішемічної події, патофізіологія інсульту відома лише частково, фундаментальні механізми, пов’язані з процесами захисту мозку та його адаптації, є однією із загадок і викликів для трансляційної неврології [7].
На сьогодні є визнаним існування ендогенного захисного механізму, що включає нейробіологічні механізми, такі як нейропротекція, нейротрофічність, нейропластичність і нейрогенез. Центральна нервова система оцінює їх керуючий вплив з модифікацією та відновленням ролей на різних ендогенних рівнях [8]. Тому терапевтичною метою є збільшення дії цих механізмів [5].
Після гострого пошкодження мозку, наприклад ішемічного інсульту, активується ендогенний захисний механізм за допомогою двох антикорельованих процесів: нейропротекції (з негайною дією) та такого, що частково на нього накладається, —нейрорегенерації (ней-ротрофічність, нейропластичність і нейрогенез) [9]. Метою двох головних антикорельованих процесів на першому етапі є зменшення пошкодження, що призводить до порушення функцій, а на подальших етапах — усунення пошкоджень, що призводять до інвалідності, та відновлення функцій [9]. Фундаментальні біологічні процеси та патологічні механізми, які включають механізми ендогенного захисту та пошкодження, узагальнено на рис. 1 [5].
/55.jpg)
Ендогенні механізми захисту складаються з абсолютних і споріднених процесів. Фундаментальні механізми призводять до експресії генів і синтезу білка, які відіграють відновну роль. На інші компоненти клітини, такі як цитоплазма, мембрана чи цитозоль, впливають різні (відносні) механізми (наприклад, блокатори іонних каналів, агоністи/антагоністи рецепторів, антиоксиданти тощо), які визначають прояв нейропротекторної активності [1, 5, 10].
Фармакологічна нейропротекція має аналогічну організацію. Нейротрофічні фактори та нейротрофоподібні молекули контролюють абсолютні механізми, тоді як блокатори іонних каналів впливають на відносні механізми, агоністи та антагоністи певних рецепторів, антиоксиданти та інші мономодальні терапевтики [1, 5].
Нейропротекція, як частина ендогенної захисної активності нервової системи, визначається як сукупність усіх механізмів, які дозволяють нейронам адаптуватися до шкідливих факторів. Це короткочасний нейробіологічний процес. Основною метою нейросудинної протекції є збереження компонентів нервово-судинної одиниці, що складається з нейронів, гліальних клітин, ендотеліальних клітин, перицитів і матриксних білків. Будь-яке пошкодження частин нервово-судинної системи призводить до апоптозного процесу, що називається аноїкіс [5, 8, 10, 11].
Нервова система працює і регулює свою діяльність, функції та взаємозв’язки в асоціації зі структурними модифікаціями, у відповідь на шкідливу дію різних (внутрішніх і зовнішніх) факторів, ця здатність називається нейропластичністю. Нейропластичність відіграє важливу роль у процесі відновлення після інсульту завдяки її організаційній здатності, яка охоплює не лише структуру нейронів, але й функціональні аспекти та їх взаємозв’язок [1, 10, 12]. Вона перетинається з нейротрофічністю та нейропротекцією, з якими поділяє загальні механізми [10]. Не всі патофізіологічні процеси та зв’язки між цими двома процесами відомі. Однак між ними існує певний ступінь взаємодії [13]. Усі ці фундаментальні біологічні процеси, як згадувалося раніше, мають абсолютний та відносний аспекти, які суттєво контрастують [5, 8].
Як ексайтотоксичність, так і запалення мають бівалентний атрибут: роль, яку вони відіграють у розвитку ішемічного інсульту, є деструктивною та захисною. У той час як ексайтотоксичність виникає через надлишок глутамату та через послідовну надлишкову активацію NMDA-рецепторів, це призводить через протеоліз до пошкодження та клітинної смерті, а у випадку інсульту запальний процес поширюється через активовані імунні клітини. Ці два процеси також мають загальний механізм, який опосередковується нейротрофічними факторами, які сприяють виживанню нейронів. Будучи частиною нейропластичності та нейротрофічності (для ексайтотоксичності), відповідно (для запалення) ендогенні ефекти нейропротекції та нейропластичності відіграють захисну роль (хоча мають бути виконані певні умови, такі як підтримка протеолізу на оптимальному рівні) [5, 8, 14–19].
Нарешті, з патофізіологічних механізмів (на відміну від апоптозу, який є нормальним процесом в організмі людини та виконує підтримку та контроль клітинних популяцій) апоптозоподібні процеси завжди викликають негативні ефекти, що є причиною необхідності протидії через екзогенні та ендогенні механізми [5, 8, 20–22]. Підсумовуючи, необхідно зосередитися на спробі розробити фармакологічну терапію, яка б діяла таким чином, щоб припинити апоптозоподібні процеси і повернути баланс ексайтотоксичності та запалення в бік їх позитивних ефектів, на відміну від негативних ефектів [5, 8, 10, 22].
Інвалідність, що виникає після інсульту, дуже різноманітна, від порушення рухової функції до когнітивних та психоемоційних розладів. Тому за допомогою нейрореабілітації тривають спроби посилити нейропластичність нервової системи [11, 22].
Нейрогенез — це механізм, коли нові нейрони утворюються з нейронних стовбурових клітин, а нейротрофічність є механізмом, за допомогою якого клітина постійно підтримує свою нормальну структуру та експресію ДНК [5, 8, 23].
Нейротрофічні фактори, нейротрофоподібні фактори та генетичні параметри — це процеси, які ініціюють ендогенну захисну активність, а також її управління [5, 10]. Вони діють на основі абсолютних механізмів, які призводять до експресії генів і синтезу білка, що відіграють відновну роль. На інші клітинні сполуки, такі як цитоплазма, мембрана чи цитозоль, впливають різні (відносні) механізми (наприклад, блокатори іонних каналів, агоністи/антагоністи рецепторів, антиоксиданти тощо), які визначають прояв нейропротекторної активності [5, 10]. Отже, необхідність активації та акцентування ендогенних систем (як внутрішніх, так і фармакологічних) знаходиться в ефективній протидії патофізіологічним механізмам. Цього екзогенного збільшення можна досягти за допомогою різних втручань, від фармакологічних до психологічних. Доведено, що використання молекул, які відображають структуру та функцію ендогенних молекул, є корисним, враховуючи складні безперервні процеси, у яких вони беруть участь. Наприклад, відомо, що перші 72 години після ішемічної події є надзвичайно важливими з огляду на їх значення для механізмів нейропротекції, нейрогенезу та нейропластичності [5, 10]. Нейрореабілітація прагне посилити ці механізми для покращення результатів [5, 7, 8].
Фізіопатологічні процеси інсульту також відбуваються на стадії між судинною оклюзією та клітинним апоптозом, таким чином являючи собою мішень для фармакологічного втручання, рятуючи популяцію уражених нейронів [10, 11, 24]. Ці захисні механізми можуть бути активовані природним або фармакологічним шляхом [10, 11].
Останніми роками було зроблено багато спроб розробити нейропротекторні препарати, спрямовані на патофізіологічний каскад, який починається з ішемії та призводить до необоротного пошкодження тканин. Незважаючи на суперечливі результати численних клінічних досліджень, деякі з них виявилися успішними (цитиколін, Церебролізин, еритропоетин та ін.). Типова закономірність, яку поділяють усі ці молекули, полягає в тому, що вони демонструють плейотропний механізм проти ішемічного каскаду [10, 11, 13].
Важливою характеристикою, яку повинен мати ефективний сучасний нейропротекторний препарат, є мультимодальність, або здатність активувати численні біологічні механізми в зручний час. Мультимодальна дія є ще більш критичною, коли механізми нейропластичності та нейровідновлення страждають від довгострокового порушення, оскільки багато традиційних фармакологічних засобів впливають на один механізм [10]. Мультимодальний та плейотропний ефекти забезпечують, з фармакологічної точки зору, зв’язок між гострою частиною з нейропротекторною роллю та довгостроковою частиною з регенеративною роллю. Фармакологічні наслідки узагальнено на рис. 2 [5].
/56.jpg)
Сукупність патофізіологічних механізмів вказує на важливість мультимодальної дії фармакологічних терапевтичних засобів. Наприклад, глутамат спричиняє як ексайтотоксичну дію в перші хвилини та години після інсульту, так і нейрорегенеративну дію через кілька годин [5, 13]. Контроль цих змін, що є життєво важливими в питанні захисту мозку, покладено на мультимодальні фармакологічні препарати, що запускають перехід від нейропротекції до нейропластичності [5, 13]. Це одна причина, чому час експресії імплементованих генів з фармацевтичною ефективністю вищевказаних препаратів відіграє експоненціальну роль у патогенезі ішемії [9].
На сьогодні загальний терапевтичний термін (унімодальний плейотропний) відноситься до використання препаратів, які діють шляхом підвищення дії EDA екзогенно, зосереджуючись лише на нейропротекції [5, 9]. Таким чином, існує потреба зосередитися на фармакологічній ефективності та нейропротекторній дії препаратів із мультимодальною та плейотропною активністю (тобто біологічних агентів) на відміну від препаратів унімодальної дії, щодо яких отримано недостатньо послідовні результати [5]. Виходячи з цього принципу, Церебролізин є прикладом фармакологічного засобу з комплексним механізмом дії. Він спричиняє мультимодальну, плейотропну дію, яка забезпечує не тільки негайну нейропротекцію, але й тривалу нейрорегенерацію, активуючи ендогенні відповіді, які запускаються при певній кількості серцево-судинних і нейродегенеративних захворювань, включаючи інсульт [9].
Церебролізин є комплексною сполукою, яка складається з пептидів з нейротрофічною активністю та модуляцією і вільних амінокислот, які завдяки своїй мультимодальній дії сприяють нейротрофічній стимуляції (через виживання та підтримку фенотипу високодиференційованих клітин), модулюють нейропротекцію щодо шкідливих агентів (сприяє змінам пластичності нейронів і синапсів). Він сприяє метаболізму нейронів через підвищення стійкості до гіпоксії і запобігання накопиченню лактату (лактоацидоз) [9, 25, 26].
Ця мультимодальна дія Церебролізину була продемонстрована в дослідженнях на тваринах і in vitro. Вона полягає у зменшенні запрограмованої загибелі клітин і появи вільних радикалів, регуляції запальної відповіді та зменшенні токсичної дії нейромедіаторів (ексайтотоксичність). Все це призводить до нейропротекції, сповільнення регулюючого збільшення кількості синапсів, що забезпечує нейропластичність, а також до зменшення нейроваскулярної реконструкції, що сприяє нейрогенезу в зубчастій звивині [27–33].
Цей фармацевтичний засіб посилює нейрогенез і олігодендрогенез, активуючи шлях Sonic Hedgehog, який відіграє роль в еволюції та структуруванні мозку. Одним із прикладів є Gli-комплекс, який збільшує ней-ровідновлення [34]. Здатність Церебролізину індукувати нейровідновлення, поряд зі стандартним лікуванням інсульту, є причиною того, чому цей сильнодіючий препарат є ефективним засобом лікування в період реабілітації після інсульту [9]. Припускають, що Церебролізин має більш виражений вплив на нейрорегенерацію (нейропластичність і нейровідновлення), ніж на нейропротекцію [13].
3. Клінічні дослідження
3.1. Ефективність Церебролізину
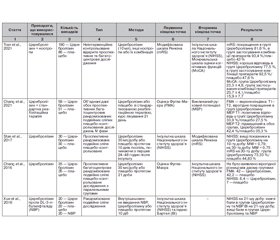
Церебролізин був предметом багатьох клінічних досліджень, більшість з яких продемонстрували обнадійливі результати щодо його мультимодальної та плейотропної активності. Різноманітні дослідження показали, що застосування Церебролізину внутрішньовенно (в/в) призводить до покращання неврологічного статусу у пацієнтів, які перенесли гострий ішемічний інсульт, а також продемонстрували позитивний ефект комбінації Церебролізину з іншими лікарськими засобами та видами фізичної, окупаційної або логопедичної терапії. Tran та співавт. вивчали вплив Церебролізину в комбінації з ноотропами в лікуванні хворих на гострий ішемічний інсульт. Отримані результати показали, що Церебролізин окремо або в комбінації з іншими фармацевтичними засобами є безпечним і ефективним у лікуванні гострої ішемії як в гострій стадії, так і на стадії відновлення, що свідчить про те, що його слід використовувати в повсякденній клінічній практиці [35]. Chang та співавт. досліджували ефективність комбінації Церебролізину зі стандартизованою реабілітаційною терапією. Результати показали, що в осіб із тяжкими руховими порушеннями, спричиненими гострим ішемічним інсультом, стандартна реабілітаційна терапія в поєднанні з Церебролізином забезпечує додаткові переваги щодо відновлення моторики порівняно з тільки традиційною реабілітаційною терапією [36]. Попереднє дослідження Chang та співавт. (у якому під час призначення Церебролізину використовували методи нейровізуалізації для оцінки пластичності рухової мережі) виявило позитивний вплив Церебролізину на ділянки мозку, пов’язані з руховою функцією, але вірогідної різниці між двома групами не виявлено [37]. Xue та співавт. провели клінічне дослідження для перевірки та оцінки ефективності та безпеки DL-3-n-бутилфталіду (NBP) і Церебролізину щодо мінімізації неврологічних та поведінкових порушень після гострого ішемічного інсульту. Результати свідчать про те, що 10-денне лікування NBP або Церебролізином є безпечним, і ці препарати мають позитивні переваги у пацієнтів з гострим ішемічним інсультом, особливо у легких випадках. Проте NBP виявився кращим, ніж Церебролізин, у поліпшенні короткострокового прогнозу гострого ішемічного інсульту [38].
Дослідження Muresanu та співавт., CARS 1, показало позитивний вплив Церебролізину як на функціональні, так і на загальні результати реабілітації після інсульту на ранніх стадіях. Точніше, у учасників, які отримували досліджуваний препарат, через 90 днів рухова функція верхніх кінцівок відновилася більшою мірою, ніж у пацієнтів, які отримували плацебо [4]. Дослідження Guekht та співавт., CARS 2, що мало такий самий дизайн, як і CARS 1, але у більшому масштабі, не підтвердило висновки CARS 1, але Церебролізин показав добру переносимість [39]. Razei та співавт. досліджували Церебролізин з метою встановити, як він впливає на неврологічні результати та кровообіг в мозку. Результати продемонстрували, що у пацієнтів із гострим вогнищевим ішемічним інсультом Церебролізин покращує неврологічну симптоматику та позитивно впливає на індекс пульсації (ІП) середньої мозкової артерії [40]. Lang та співавт. провели ще одне дослідження з метою вивчити безпечність та ефективність поєднання альтеплази (rt-PA) з Церебролізином у пацієнтів із гострим ішемічним інсультом. Вони дійшли висновку, що ней-ротрофічний препарат у поєднанні з rt-PA є безпечним для лікування гострого ішемічного інсульту, хоча не покращує прогноз через 90 днів. Проте порівняно з групою плацебо значно більше пацієнтів продемонстрували позитивну відповідь щодо показників неврологічних результатів протягом 10-денного періоду терапії Церебролізином [41]. Stan та співавт. оцінили ефективність Церебролізину в поєднанні з постінсультною ранньою реабілітацією, показавши позитивні результати в когорті пацієнтів, яким призначався Церебролізин. Автори повідомили про покращення загального неврологічного стану та зменшення порушень у пацієнтів, які отримували Церебролізин. У групі Церебролізину було на 28,5 % більше незалежних пацієнтів, ніж у контрольній групі, що свідчить про те, що позитивні результати цього дослідження можуть бути ефективно використані в сучасній клінічній практиці [42]. Дослідження Heiss та співавт. мало на меті з’ясувати ефективність та безпеку застосування Церебролізину у пацієнтів із гострим ішемічним інсультом. Кінцева точка в цьому дослідженні не виявила відмінностей між групами лікування. Однак у пацієнтів з тяжким ступенем інсульту, які отримували Церебролізин, спостерігалася тенденція до сприятливих результатів [43]. Додаткову інформацію щодо вищезазначених досліджень наведено в табл. 1.
/59.jpg)
/60.jpg)
3.2. Профіль безпеки Церебролізину
Безпека нейротрофічного препарату Церебролізин оцінювалася в різних дослідженнях, які мали неоднорідні результати щодо демографічних показників, часу включення, введеної дози та часу оцінки/контролю.
У дослідженні, опублікованому в 2012 році, йдеться про меншу кількість пацієнтів, які вибули з дослідження через побічні ефекти в групі Церебролізину порівняно з групою плацебо, і зроблено висновок про відсутність вірогідних відмінностей між двома групами. Порівняння двох кластерів (Церебролізин і плацебо) не виявило вірогідних відмінностей щодо побічних ефектів, серйозних побічних ефектів і смертності. Крім того, у пацієнтів, які отримували Церебролізин у гострій фазі ішемічного інсульту, не спостерігалося вірогідних змін життєво важливих параметрів або результатів лабораторних досліджень. Слід зазначити, що під час аналізу підкатегорії пацієнтів із NIHSS > 12 балів нижчий рівень смертності спостерігався в групі Церебролізину порівняно з групою плацебо [43].
В іншому рандомізованому клінічному дослідженні, яке включало Церебролізин, вказано про низький відсоток (менше 5 %) пацієнтів із групи застосування препарату, які були змушені залишити дослідження через побічні ефекти. Передчасно вибули з дослідження через побічні реакції лише двоє пацієнтів. Не було зареєстровано летальних випадків серед пацієнтів, які отримували нейротрофічний препарат Церебролізин. Що стосується побічних реакцій, то 2,9 % пацієнтів у цій групі та 6,7 % тих, хто отримував плацебо, мали виражену побічну реакцію, яку вважали не пов’язаною з введеним агентом. У групі лікування Церебролізином тяжкі побічні ефекти були представлені в основному гострим інфарктом міокарда, тяжкою периферичною ішемією та нирковою колькою, але всі ці стани купірували під час цього дослідження. Згідно з протоколом дослідження, поясненням низької частоти серйозних вторинних подій може бути тривала госпіталізація пацієнтів на додаток до ранньої реабілітації. Крім того, важливим для цього випадку була відсутність вірогідних змін у групі лікування Церебролізином порівняно з групою плацебо щодо життєвих і лабораторних параметрів [4].
Клінічні дослідження фази IV, які включали пацієнтів із помірною або тяжкою руховою дисфункцією після інсульту, продемонстрували подібні результати між групами втручання та плацебо щодо життєво важливих показників та лабораторних параметрів, при цьому в кожній групі повідомлялося про одну серйозну побічну подію. У групі Церебролізину це епізод холециститу, спричиненого жовчнокам’яною хворобою, який через деякий час минув [37].
Що стосується призначення Церебролізину пацієнтам, які отримували внутрішньовенну тромболітичну терапію альтеплазою (rt-PA), не повідомлялося про загальне збільшення частоти летальних випадків, тяжких побічних ефектів або будь-яких побічних ефектів порівняно з контрольною групою. Порівняно з іншими клінічними дослідженнями варто відзначити відмінності у часі введення rt-PA, менший час між початком інсульту та введенням rt-PA, час введення Церебролізину між групою плацебо та групою втручання та побічні ефекти (крововилив у мозок), які були притаманні альтеплазі. У цьому випадку також не було змін життєво важливих чи лабораторних показників, пов’язаних із застосуванням нейротрофічного препарату [41].
Метааналіз дев’яти рандомізованих клінічних досліджень показав нижчу смертність у групі Церебролізину порівняно з групою плацебо. Що стосується розрахованого OR, то воно показало дещо нижчі результати в групі плацебо, але не було статистично вірогідним.
Крім того, відсоток пацієнтів, які повідомили про серйозні побічні ефекти, і один пацієнт, який повідомив принаймні про один побічний ефект, були порівнянними між двома групами. Варто зазначити, що лише сім із восьми досліджень мали доступні дані щодо серйозних несприятливих явищ і небажаних явищ [44].
Інший метааналіз, зосереджений на результатах двох відповідних досліджень інсульту (CARS-1 і CARS-2, обидва наведені в табл. 1), оцінював переносимість і безпеку Церебролізину для відновлення рухової функції у пацієнтів після інсульту. Було відзначено, що кількість пацієнтів з групи Церебролізину, які повідомили про принаймні одну побічну дію (ПД), була подібною до аналогічних випадків у групі плацебо. Крім того, більшість ПД за ступенем тяжкості були оцінені як легкі. Що стосується серйозних побічних явищ (СПЯ), то їх частка в кожній з груп була менше ніж 5 %, і жодне не було пов’язане з Церебролізином [45]. Загалом більшість побічних реакцій, зареєстрованих у дослідженнях серед пацієнтів, які отримували Церебролізин, були транзиторними і не могли бути пов’язані з прийомом препарату [13].
Систематичний огляд і метааналіз 2021 року оцінили безпеку застосування Церебролізину після гострого ішемічного інсульту порівняно з плацебо. На основі аналізу 12 рандомізованих контрольованих досліджень профіль безпеки Церебролізину оцінювали не лише за популяцією 12 РКД (2202 пацієнти), а й за підгрупами. Під час аналізу СПЯ, смертності, ПД та нефатальних СПЯ в групі Церебролізину порівняно з плацебо Церебролізин продемонстрував хороший профіль безпеки.
Крім того, спостерігалася тенденція до зниження кількості СПЯ у підгрупі Церебролізину серед пацієнтів з інсультом середнього та тяжкого ступеня порівняно з плацебо [46].
Нарешті, в іншому систематичному огляді оцінювали переваги Церебролізину при лікуванні гострого ішемічного інсульту та потенційні ризики, які може викликати препарат під час лікування. За результатами огляду було зроблено висновок, що Церебролізин майже не впливає на ризик смерті з будь-якої причини після ішемічного інсульту, загальну кількість пацієнтів із СПЯ, кількість летальних СПЯ і загальну кількість пацієнтів, які мали менше СПЯ. Стосовно комбінації Церебролізину та стандартної терапії в огляді повідомляється про збільшення кількості пацієнтів із нелетальними СПЯ порівняно з групами, які отримували стандартну терапію (окремо або з плацебо) (4 дослідження — 1435 пацієнтів). Також в результатах огляду не знайшлося достатніх доказів щодо ризику смертності та потреби в безперервному догляді після закінчення досліджень [47].
Таким чином, у дослідженнях безпеки Церебролізину не було зареєстровано вірогідних відмінностей порівняно з плацебо щодо побічних ефектів (серйозних або летальних). Крім того, не встановлено вірогідних змін життєво важливих і лабораторних показників.
4. Оглядові дослідження ефективності
Часто застосування будь-якого препарату аналізується з точки зору ефективності клініцистами та чиновниками. Однією з відмінностей між такими концепціями є те, що дослідження ефективності (пояснювальні дослідження) намагаються отримати очікуваний результат за ідеальних умов. З іншого боку, дослідження ефективності (прагматичні дослідження) спрямовані на кількісне визначення ступеня позитивного ефекту в контексті обставин реальної практики. У зв’язку з цим важливо визнати, що дизайн дослідження та гіпотези досліджень ефективності розроблені з урахуванням звичайної клінічної практики та результатів, які планується отримати в клінічних умовах [48]. За допомогою Pubmed був проведений докладний аналіз літератури з акцентом на обсерваційні дослідження ефективності Церебролізину при інсульті. Було виявлено дуже мало спостережних досліджень; найбільш важливі з них подані нижче.
Ретроспективне дослідження ефективності Церебролізину при постінсультній спастичності проведено на 50 хворих (23 у групі Церебролізину та 27 у групі контролю). Церебролізин застосовували внутрішньом’язово по 10 мл/добу протягом 30 днів. Крім того, в обох групах мінімум 2 рази на тиждень використовували стандартизований комплекс фізичної та окупаційної реабілітаційної терапії. На 30-й день оцінювали ефективність лікування за модифікованою шкалою Ешворта (MAS), за допомогою мануально-м’язового тестування (MMT) та за модифікованою шкалою Ренкіна. Церебролізин виявився безпечним і ефективним; він продемонстрував вірогідне зменшення спастичності кінцівок порівняно з контрольною групою. У групі Церебролізину також відбувалося покращення загальної функції та показників м’язової сили [49].
В обсерваційному ретроспективному дослідженні, проведеному Kim та співавт., оцінювалася ефективність впливу Церебролізину на стан свідомості у пацієнтів, які перенесли інсульт та були у стані мінімальної свідомості. Протягом 3 років в це дослідження було включено 75 пацієнтів з ішемічним та/або геморагічним інсультом, ступінь свідомості яких за шкалою одужання після коми (CRS-R) був мінімальним. Основну групу становили пацієнти, які отримували Церебролізин 10 мл в/в протягом мінімум 20 днів; контрольну групу становили пацієнти, яким не вводили Церебролізин. Крім того, пацієнти проходили програму реабілітації — лікувальну фізкультуру та окупаційну терапію. Оцінку стану пацієнтів за шкалою CRS-R проводили під час виписки (~ 2 місяці) — було продемонстровано вірогідне покращення показників. Крім того, не було виявлено проблем з безпекою досліджуваного препарату [50]. Як ми встановили під час огляду літературних джерел, найбільш вірогідними були інтервенційні дослідження.
5. Дослідження «вартість — ефективність»
Окрім серйозних фізичних та когнітивних порушень, інсульт також спричиняє величезний економічний тягар у всьому світі. На інсульт припадає близько 3–4 % загальних витрат на охорону здоров’я в західних країнах [51]. Ґрунтуючись на нещодавньому систематичному огляді Rochman та співавт., було зазначено, що прямі медичні витрати становлять 86,2 %, а загальні — 13,8 % [52]. Ці витрати включають ліки, які відіграють величезну роль у терапії інсульту.
Аналіз економічної ефективності (АЕЕ) є надійним інструментом для зацікавлених сторін системи охорони здоров’я, які оцінюють цінність (що характеризується витратами та результатами протягом попередньо визначеного періоду часу) фармакологічної терапії [53, 54]. АЕЕ зазвичай супроводжується аналізом впливу на бюджет (BIA), який оцінює, наскільки доступним є фармакологічне втручання в системі з обмеженими ресурсами, перед процесом затвердження або відшкодування. Враховуючи високу конкуренцію за обмежені фінансові кошти в кожній країні та особливості національних систем страхування, АЕЕ та BIA рекомендується проводити для кожного альтернативного втручання [54]. Економічна ефективність фармакологічної терапії Церебролізином або її вплив на національні бюджети охорони здоров’я оцінювали в деяких дослідженнях.
Метою роботи Kulikov, Abdrashitova та співавт. було оцінити економічну ефективність Церебролізину порівняно зі стандартною терапією для пацієнтів з діагнозом «інсульт середнього та тяжкого ступеня». Результати показали економічні переваги Церебролізину, оскільки співвідношення ціни та ефективності було меншим (6920 євро), ніж таке у разі застосування стандартної терапії (9287 євро) [55]. Kulikov, Abdrashitova та співавт. з 2015 року також розробляють додатковий аналіз впливу на бюджет, який показав, що у разі застосування Церебролізину прямі витрати, пов’язані з медичною допомогою (стаціонарна та амбулаторна допомога, фармакотерапія, невідкладна допомога та ней-рореабілітація), та непрямі витрати (втрата здатності до праці, перебування на лікарняному, інвалідність і смерть) є нижчими. Витрати на менеджмент пацієнтів з інсультом, включених в групу Церебролізину, були зменшені на 1314 євро порівняно з сумою витрат пацієнтів, які отримували стандартну терапію (7552 євро) [56]. Walter та співавт. показали, що у пацієнтів з діагнозом «гострий ішемічний гемісферний інсульт», які отримували комбінацію альтеплази та Церебролізину, повідомлялося про нижчі витрати (61 468,67 євро) порівняно з пацієнтами, які отримували лише альтеплазу. Стратегія лікування із застосуванням нейропротекторів знижує витрати, пов’язані з доглядом за пацієнтами з гострою ішемією та за мешканцями будинків престарілих [57].
Незважаючи на те, що досліджень небагато, можна стверджувати, що Церебролізин є економічно ефективним і має потенціал для зменшення економічного тягаря на національні бюджети як стандартне лікування пацієнтів із різним ступенем тяжкості інсульту [55, 56], а також в комбінації з іншими фармакологічними засобами (наприклад, з альтеплазою) [57] у країнах з різними типами медичного страхування [58, 59].
6. Церебролізин рекомендований в настановах
Церебролізин згадується в різних настановах як рекомендований до застосування в гострій фазі інсульту, а також у хронічній фазі завдяки доказам його позитивної ролі у постінсультній реабілітації [46]. У 2020 році Церебролізин було рекомендовано в «Клінічному довіднику із реабілітації після інсульту» для застосування в реабілітації верхньої кінцівки з геміплегією. Зверталася увага на позитивну роль Церебролізину у покращенні рухової функції, спритності та впевненості в собі під час повсякденної діяльності. Рекомендація ґрунтувалася на рандомізованих контрольованих дослідженнях із в/в застосуванням Церебролізину в дозі 30 мл на 70 мл фізіологічного розчину 1 раз на добу протягом 3 тижнів у поєднанні з фізичною або окупаційною терапією, або в тій самій дозі та з тим самим способом введення, що й раніше, але протягом 6 тижнів у поєднанні зі стандартною реабілітаційною терапією [60].
В оновленій в 2020 році настанові Німецького товариства нейрореабілітації щодо реабілітації паретичної верхньої кінцівки Церебролізин був рекомендований як частина фармакологічної реабілітації у пацієнтів після інсульту з ураженням верхньої кінцівки і порушенням моторики. Згідно з настановою, Церебролізин слід призначати в гострій і підгострій фазі інсульту пацієнтам із вираженим руховим дефіцитом верхньої кінцівки, в ідеалі через 24–72 години після інсульту, внутрішньовенно, щодня протягом 21 доби (за умови доброї переносимості). Метою застосування Церебролізину є відновлення рухової функції верхніх кінцівок і загальне функціональне поліпшення разом із реабілітацією. На сьогодні Церебролізин схвалений в Австрії [61].
Настанови Європейської академії неврології та Європейської федерації нейрореабілітаційних товариств 2021 року щодо фармакологічної підтримки під час ранньої рухової реабілітації після гострого ішемічного інсульту рекомендують використовувати два фармакологічні засоби, а саме Церебролізин і циталопрам. Церебролізин рекомендовано як фармакологічне доповнення до заходів ранньої рухової реабілітації при гострому інсульті у дозі 30 мл/добу в/в протягом мінімум 10 днів [62]. На основі доказів щодо ролі та ефективності Церебролізину при гострому інсульті були розроблені рекомендації робочою групою, до складу якої входили представники Європейської академії неврології (EAN) та Європейської федерації нейрореабілітації (EFNR) та фахівці з 6 європейських країн [62]. Для класифікаційної шкали було застосовано 6 метааналізів: первинними та вторинними були показники раннього рухового відновлення через 30 і 90 днів. Для характеристики профілю безпеки під час створення рекомендацій враховувалися неврологічний статус та загальний функціональний результат через 30 і 90 днів. При отриманні даних проводився метааналіз [62].
У Рекомендаціях AHA/ASA 2019 з раннього менеджменту пацієнтів з гострим ішемічним інсультом (оновлення 2019 року Рекомендацій 2018) аспекти нейропротективної терапії коротко викладені в розділі «Загальна підтримуюча терапія та невідкладна допомога». Незважаючи на те, що у разі застосування нейропротекторних препаратів був рівень доказовості A, не брався до уваги позитивний вплив на стан пацієнта, тому клас рекомендацій визначався як III. З цієї причини в настанові не рекомендується застосування будь-яких медикаментозних і немедикаментозних засобів з передбачуваною нейропротекторною активністю в гострій фазі ішемічного інсульту. Однак жодне рандомізоване контрольоване дослідження Церебролізину не було включено в процес оцінки, який охоплював лише інфузію високих доз альбуміну та магнію [63]. Подібний підхід до рекомендацій з фармакологічного втручання після інсульту та сприяння нейрореабілітації використовувався у рекомендаціях AHA/ASA щодо реабілітації та відновлення після інсульту 2016 року [64].
7. Висновки
Враховуючи високу частоту та несприятливий прогноз гострого ішемічного інсульту, життєво важливо знайти ефективні лікарські засоби, які допоможуть людям із цим захворюванням покращити неврологічні та когнітивні функції. З огляду на складноий патофізіологічний каскад, пов’язаний з ішемією головного мозку, ключовим підходом до лікування має бути мультимодальний підхід, спрямований на різні критичні механізми. Препарати, які проявляють ендогенну активність, слід вважати основними складовими терапії, спрямованої на захист і відновлення мозку у разі гострого ураження. Потенціал для дії цих фармакологічних засобів розгортається на рівні ДНК, з активацією синергічних молекулярних механізмів, які забезпечують реінтеграцію гомеостазу пошкоджених неврологічних тканин [5]. Мультимодальна та плейотропна дія Церебролізину призводить до негайної нейропротекції та тривалої регенерації [9]. Суттєвою перевагою цього нейропротекторного препарату є те, що він може бути широко використаний без відповідних обмежень. Крім того, для введення Церебролізину не існує обмежень у часі, він демонструє високий профіль безпеки та добре переноситься. Не менш важливо, що існує значна кількість доказів того, що Церебролізин захищає мозок від впливу ішемічного каскаду та підтримує весь процес реорганізації нейронів [10, 13].
Пластичність мозку є найважливішим процесом синаптичного феномена, який в основному є стимулзалежним. Відновлення після інсульту — це трудомісткий і складний процес, у якому конкретні великі ураження головного мозку вимагають не тільки нових анатомічних субстратів, але й відновлення або створення нових мережевих зв’язків. Важливо розуміти, що інсульт — це не лише регіонарне ураження зони ішемії; у процес залучені нейронні мережі усього мозку, що призводить до широкого спектра дисфункцій та інвалідності [5]. У той же час для функціонального результату після інсульту найважливіше значення має гостра реабілітація з акцентом на терміни та інтенсивність. Хоча рання мобілізація після інсульту рекомендована в клінічних настановах, вона залишається суперечливою, оскільки за умов високої інтенсивності може завдати шкоди [64].
Неврологічні розлади є серйозним тягарем у всьому світі, з регіональною варіабельністю. На жаль, незалежно від регіону, частота інсульту переважає. Метою медичного втручання при інсульті, починаючи від первинної профілактики і закінчуючи невідкладним лікуванням, госпіталізацією, вторинною профілактикою та реабілітацією, є зниження частоти інсульту, інвалідності та смертності [62]. Вирішальну роль належної ранньої моторної реабілітації для зменшення виснажливих наслідків інсульту може доповнити фармакологічна підтримка [13, 60–62]. Потрібна подальша робота, особливо над розумінням балансу між збуджуючими та гальмівними сигналами, визначенням впливу на них травми та, звичайно, ідентифікацією тих ланцюгів, які можуть ефективно контролювати та підтримувати рівновагу. Такий рівень інформації сприяв би точному модулюванню нейронної мережі, що призвело б до активації локалізованого механізму пластичності, зберігаючи при цьому стабільність в інших ділянках мозку [65].
Церебролізин робить свій внесок в арсенал фармакологічних препаратів, який мають у своєму розпорядженні клініцисти в багатьох країнах світу [9, 10, 13]. Незважаючи на достатню кількість наукових літературних джерел щодо ефективності та безпеки застосування Церебролізину в комплексі нейрореабілітації після інсульту, деякі обмеження клінічних досліджень (наприклад, малий розмір вибірки) вимагають додаткового вивчення препарату у великих високоякісних підтверджуючих дослідженнях, а також проведення клінічних досліджень та дослідження економічної ефективності [4, 35–43]. Удосконалення цієї сукупності доказів у майбутньому вплине на поточні рекомендації клінічних настанов щодо застосування Церебролізину після ішемічного інсульту [60–62].
Список литературы
1. Chugh C. Acute Ischemic Stroke: Management Approach. Indian J. Crit. Care Med. Peer-Rev. Off. Publ. Indian Soc. Crit. Care Med. 2019. 23. S140-S146.
2. Warburton E., Alawneh J.A., Clatworthy P.L., Morris R.S. Stroke Management. BMJ Clin. Evid. 2011. 6. 201.
3. Phipps M.S., Cronin C.A. Management of Acute Ischemic Stroke. BMJ. 2020. 368. l6983.
4. Muresanu D.F., Heiss W.-D., Hoemberg V., Bajenaru O., Popescu C.D., Vester J.C., Rahlf V.W., Doppler E., Meier D., Moessler H., et al. Cerebrolysin and Recovery After Stroke (CARS). A randomized, placebo-controlled, double-blind, multicenter trial. Stroke. 2016. 47. 151-159.
5. Muresanu D.F., Buzoianu A., Florian S.I., von Wild T. Towards a Roadmap in Brain Protection and Recovery. J. Cell. Mol. Med. 2012. 16. 2861-2871.
6. Teng H., Li C., Zhang Y., Lu M., Chopp M., Zhang Z.G., Melcher-Mourgas M., Fleckenstein B. Therapeutic effect of Cerebrolysin on reducing impaired cerebral endothelial cell permeability. Neuroreport. 2021. 32. 359-366.
7. Carey L., Walsh A., Adikari A., Goodin P, Alahakoon D., De Silva D., Ong K.L., Nilsson M., Boyd L. Finding the Intersection of Neuroplasticity, Stroke Recovery, and Learning: Scope and Contributions to Stroke Rehabilitation. Neural. Plast. 2019. 2019. 5232374.
8. Muresanu D.F. Management of Acute Stroke: Neuroprotection. In: Stroke. Bornstein N.M., Ed. Karger: Basel, Switzerland, 2009. Р. 128-136.
9. Muresanu D.F., Strilciuc S., Stan A. Current Drug Treatment of Acute Ischemic Stroke: Challenges and Opportunities. CNS Drugs. 2019. 33. 841-847.
10. Muresanu D.F. Neuroprotection and neuroplasticity — A holistic approach and future perspectives. J. Neurol. Sci. 2007. 257. 38-43.
11. Muresanu D.F. Neuroplasticity and Neurorecovery. In: Stroke. Bornstein N.M., Ed. Karger: Basel, Switzerland, 2009. Р. 37-49.
12. Puderbaugh M., Emmady P.D. Neuroplasticity. In: StatPearls. StatPearls Publishing: Treasure Island, FL, USA, 2021.
13. Brainin M. Cerebrolysin: A Multi-Target Drug for Recovery after Stroke. Expert Rev. Neurother. 2018. 18. 681-687.
14. Brunet A., Datta S.R., Greenberg M.E. Transcription-Dependent and -Independent Control of Neuronal Survival by the PI3K-Akt Signaling Pathway. Curr. Opin. Neurobiol. 2001. 11. 297-305.
15. Hutter-Paier B., Grygar E., Fruhwirth M., Temmel I., Windisch M. Further evidence that Cerebrolysin® protects cortical neurons from neurodegeneration in vitro. J. Neural Transm. Suppl. 1998. 53. 363-372.
16. Iseda T., Nishio T., Kawaguchi S., Kawasaki T., Wakisaka S. Spontaneous Regeneration of the Corticospinal Tract after Transection in Young Rats: Collagen Type IV Deposition and Astrocytic Scar in the Lesion Site Are Not the Cause but the Effect of Failure of Regeneration. J. Comp. Neurol. 2003. 464. 343-355.
17. Masliah E., Díez-Tejedor E. The Pharmacology of Neurotrophic Treatment with Cerebrolysin: Brain Protection and Repair to Counteract Pathologies of Acute and Chronic Neurological Disorders. Drugs Today. 2012. 48. 3-24.
18. Wu H.-Y., Yuen E.Y., Lu Y.-F., Matsushita M., Matsui H., Yan Z., Tomizawa K. Regulation of N-Methyl-D-Aspartate Receptors by Calpain in Cortical Neurons. J. Biol. Chem. 2005. 280. 21588-21593.
19. Kotter M.R., Setzu A., Sim F.J., Van Rooijen N., Franklin R.J.M. Macrophage Depletion Impairs Oligodendrocyte Remyelination Following Lysolecithin-Induced Demyelination. Glia. 2001. 35. 204-212.
20. Windhagen A., Newcombe J., Dangond F., Strand C., Woodroofe M.N., Cuzner M.L., Hafler D.A. Expression of Costimulatory Molecules B7-1 (CD80), B7-2 (CD86), and Interleukin 12 Cytokine in Multiple Sclerosis Lesions. J. Exp. Med. 1995. 182. 1985-1996.
21. Hardingham G.E., Arnold F.J., Bading H. A calcium microdomain near NMDA receptors: On switch for ERK-dependent synapse-tonucleus communication. Nat. Neurosci. 2001. 4. 565-566.
22. Paul S., Candelario-Jalil E. Emerging Neuroprotective Strategies for the Treatment of Ischemic Stroke: An Overview of Clinical and Preclinical Studies. Exp. Neurol. 2021. 335. 113518.
23. Kandel E. Principles of Neural Science. 5th ed. Appleton and Lange; McGraw Hill: New York, NY, USA, 2006.
24. Auriel E., Bornstein N.M. Neuroprotection in acute ischemic stroke-current status. J. Cell. Mol. Med. 2010. 14. 2200-2202.
25. Chen H., Tung Y.-C., Li B., Iqbal K., Grundke-Iqbal I. Trophic Factors Counteract Elevated FGF-2-Induced Inhibition of Adult Neurogenesis. Neurobiol. Aging 2007. 28. 1148-1162.
26. Zhang C., Chopp M., Cui Y., Wang L., Zhang R., Zhang L., Lu M., Szalad A., Doppler E., Hitzl M., et al. Cerebrolysin enhances neurogenesis in the ischemic brain and improves functional outcome after stroke. J. Neurosci. Res. 2010. 88. 3275-3281.
27. Wronski R., Tompa P., Hutter-Paier B., Crailsheim K., Friedrich P., Windisch M. Inhibitory effect of a brain derived peptide preparation on the intracellular Calcium Ca++- dependent protease, calpain. J. Neural Transm. 2000. 107. 145-157.
28. Sugita Y., Kondo T., Kanazawa A., Itou T., Mizuno Y. Protective effect of FPF 1070 (Cerebrolysin) on delayed neuronal death in the gerbil-detection of hydroxyl radicals with salicylic acid. No Shinkei = Brain Nerve. 1993. 45. 325-331.
29. Alvarez X.A., Lombardi V.R.M., Fernandez-Novoa L., Garda M., Sampedro C., Cagiao A., Cacabelos R., Windisch M. Cerebrolysin reduces microglial activation in vivo and in vitro: A potential mechanism of neuroprotection. J. Neural Transm. 2000. 59. 281-292.
30. Hutter-Paier B., Grygar E., Windisch M. Death of cultured telencephalon neurons induced by glutamate is reduced by the peptide derivate Cerebrolysin. J. Neural Transm. 1996. 47. 267-273.
31. Rockenstein E., Adame A., Mante M., Moessler H., Windisch M., Masliah E. The neuroprotective effects of Cerebrolysin trade mark in a transgenic model of Alzheimer’s disease are associated with improved behavioral performance. J. Neural Transm. 2003. 110. 1313-1327.
32. Rockenstein E., Mante M., Adame A., Crews L., Moessler H., Masliah E. Effects of Cerebrolysin on neurogenesis in an APP transgenic model of Alzheimer's disease. Acta Neuropathol. 2007. 113. 265-275.
33. Jin Y., Barnett A., Zhang Y., Yu X., Luo Y. Poststroke sonic hedgehog agonist treatment improves functional recovery by enhancing neurogenesis and angiogenesis. Stroke. 2017. 48. 1636-1645.
34. Zhang L., Chopp M., Meier D.H., Winter S., Wang L., Szalad A., Lu M., Wei M., Cui Y., Zhang Z.G. Sonic hedgehog signaling pathway mediates cerebrolysin-improved neurological function after stroke. Stroke. 2013. 44. 1965-1972.
35. Tran L., Alvarez X.A., Le H.-A., Nguyen D.-A., Le T., Nguyen N., Nguyen T., Nguyen T., Vo T., Tran T., et al. Clinical Efficacy of Cerebrolysin and Cerebrolysin plus Nootropics in the Treatment of Patients with Acute Ischemic Stroke in Vietnam. CNS Neurol. –Disord. — Drug Targets. 2021. 20. 281-292.
36. Chang W.H., Lee J., Shin Y.-I., Ko M.-H., Kim D.Y., Sohn M.K., Kim J., Kim Y.-H. Cerebrolysin Combined with Rehabilitation Enhances Motor Recovery and Prevents Neural Network Degeneration in Ischemic Stroke Patients with Severe Motor Deficits. J. Pers. Med. 2021. 11. 545.
37. Chang W.H., Park C., Kim D.Y., Shin Y.-I., Ko M.-H., Lee A., Jang S.Y., Kim Y.-H. Cerebrolysin Combined with Rehabilitation Promotes Motor Recovery in Patients with Severe Motor Impairment after Stroke. BMC Neurol. 2016. 16. 31.
38. Xue L.-X., Zhang T., Zhao Y.-W., Geng Z., Chen J.-J., Chen H. Efficacy and Safety Comparison of DL-3-n-Butylphthalide and Cerebrolysin: Effects on Neurological and Behavioral Outcomes in Acute Ischemic Stroke. Exp. Ther. Med. 2016. 11. 2015-2020.
39. Guekht A., Heiss D., Gusev E., Vester J., Doppler E., Muresanu D. Cerebrolysin and Recovery after Stroke (CARS 2): A Rando-mized, Placebo-Controlled, Double-Blind, Multicenter Clinical Study. J. Neurol. Sci. 2015. 357. e103.
40. Rezaei Y., Amiri-Nikpour M.R., Nazarbaghi S., Ahmadi-Salmasi B., Mokari T., Tahmtan O. Cerebrolysin Effects on Neurological Outcomes and Cerebral Blood Flow in Acute Ischemic Stroke. Neuropsychiatr. Dis. Treat. 2014. 10. 2299.
41. Lang W., Stadler C.H., Poljakovic Z., Fleet D. A Prospective, Randomized, Placebo-Controlled, Double-Blind Trial about Safety and Efficacy of Combined Treatment with Alteplase (Rt-PA) and Cerebrolysin in Acute Ischaemic Hemispheric Stroke. Int. J. Stroke. 2013. 8. 95-104.
42. Stan A., Birle C., Blesneag A., Iancu M. Cerebrolysin and Early Neurorehabilitation in Patients with Acute Ischemic Stroke: A Prospective, Randomized, Placebo-Controlled Clinical Study. J. Med. Life. 2017. 10. 216-222.
43. Heiss W.-D., Brainin M., Bornstein N.M., Tuomilehto J., Hong Z. Cerebrolysin in Patients With Acute Ischemic Stroke in Asia: Results of a Double-Blind, Placebo-Controlled Randomized Trial. Stroke. 2012. 43. 630-636.
44. Bornstein N.M., Guekht A., Vester J., Heiss W.-D., Gusev E., Homberg V., Rahlfs V.W., Bajenaru O., Popescu B.O., Muresanu D. Safety and Efficacy of Cerebrolysin in Early Post-Stroke Recovery: A Meta-Analysis of Nine Randomized Clinical Trials. Neurol. Sci. Off. J. Ital. Neurol. Soc. Ital. Soc. Clin. Neurophysiol. 2018. 39. 629-640.
45. Guekht A., Vester J., Heiss W.-D., Gusev E., Hoemberg V., Rahlfs V.W., Bajenaru O., Popescu B.O., Doppler E., Winter S., et al. Safety and Efficacy of Cerebrolysin in Motor Function Recovery after Stroke: A Meta-Analysis of the CARS Trials. Neurol. Sci. 2017. 38. 1761-1769.
46. Strilciuc S., Vecsei L., Boering D., Praznikar A., Kaut O., Riederer P., Battistin L. Safety of Cerebrolysin for Neurorecovery after Acute Ischemic Stroke: A Systematic Review and Meta-Analysis of Twelve Randomized-Controlled Trials. Pharmaceuticals. 2021. 14. 1297.
47. Ziganshina L.E., Abakumova T., Hoyle C.H. Cerebrolysin for Acute Ischaemic Stroke. Cochrane Database Syst. Rev. 2020. 7. CD007026.
48. Gartlehner G. Criteria for Distinguishing Effectiveness From Efficacy Trials in Systematic Reviews. Technical Reviews; Agency for Healthcare Research and Quality: Rockville, MD, USA, 2006.
49. Martinez R.M. Efficacy of Cerebrolysin in the Reduction of Spasticity during Stroke Rehabilitation. J. Med. Life. 2017. 10. 161-166.
50. Kim J.Y., Kim H.J., Choi H.S., Park S.Y., Kim D.Y. Effects of Cerebrolysin® in Patients With Minimally Conscious State After Stroke: An Observational Retrospective Clinical Study. Front. Neurol. 2019. 10. 803.
51. Katan M., Luft A. Global Burden of Stroke. Semin. Neurol. 2018. 38. 208-211.
52. Rochmah T.N., Rahmawati I.T., Dahlui M., Budiarto W., Bilqis N. Economic Burden of Stroke Disease: A Systematic Review. Int. J. Environ. Res. Public. Health. 2021. 18. 7552.
53. Hay J.W., Smeeding J., Carroll N.V., Drummond M., Garrison L.P., Mansley E.C., Mullins C.D., Mycka J.M., Seal B., Shi L. Good Research Practices for Measuring Drug Costs in Cost Effectiveness Analyses: Issues and Recommendations: The ISPOR Drug Cost Task Force Report — Part I. Value Health. 2010. 13. 3-7.
54. Mauskopf J.A., Sullivan S.D., Annemans L., Caro J., Mullins C.D., Nuijten M., Orlewska E., Watkins J., Trueman P. Principles of Good Practice for Budget Impact Analysis: Report of the ISPOR Task Force on Good Research Practices — Budget Impact Analysis. Value Health. 2007. 10. 336-347.
55. Kulikov A., Abdrashitova G. Cost-Effectiveness Analysis of Cerebrolysin In The Treatment of Patients With Acute Ischemic Stroke Moderate and Severe Degrees of Severity In The Russian Federation. Value Health. 2015. 18. A705.
56. Kulikov A., Abdrashitova G. Budget Impact Analysis of Cerebrolysin In The Treatment of Acute Ischemic Stroke of Moderate and Severe Degrees of Severity In The Russian Federation. Value Health. 2015. 18. A699.
57. Walter E., Bauer M., Ressl S. Cost-Effectiveness Of Combined Treatment With Alteplase (Rt-Pa) And Cerebrolysin In Acute Ischemic Hemispheric Stroke In Austria. Value Health. 2015. 18. A390.
58. European Observatory of Health Systems and Policies Austria HiT. 2018. Available online: https://www.euro.who.int/en/about- us/partners/observatory-old/publications/health-system-reviews-hits/full-list-of-country-hits/austria-hit-2018 (accessed on 12 January 2022).
59. Russian Federation Russian Federation: Health System Review. 2011. Available online: https://eurohealthobservatory.who.int/publications/i/russian-federation-health-system-review-2011 (accessed on 12 January 2022).
60. Teasell R., Hussein N., Mirkowski M., Vanderlaan D., Saikaley M., Longval M., Iruthayarajah J. Stroke Rehabilitation Clinician Handbook; Heart and Stroke Foundation: London, ON, Canada, 2020.
61. Platz T., Fheodoroff K., Mehrholz J. S3 Guideline Rehabilitation Therapy for Arm Paresis after Stroke of the DGNR Long Version; Springer: Greifswald, Germany, 2020.
62. Beghi E., Binder H., Birle C., Bornstein N., Diserens K., Groppa S., Homberg V., Lisnic V., Pugliatti M., Randall G., et al. European Academy of Neurology and European Federation of Neurorehabilitation Societies guideline on pharmacological support in early motor rehabilitation after acute ischaemic stroke. Eur. J. Neurol. 2021. 28. 2831-2845.
63. Powers W.J., Rabinstein A.A., Ackerson T., Adeoye O.M., Bambakidis N.C., Becker K., Biller J., Brown M., Demaerschalk B.M., Hoh B., et al. Guidelines for the Early Management of Patients With Acute Ischemic Stroke: 2019 Update to the 2018 Guidelines for the Early Management of Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2019. 50. e344-e418.
64. Winstein C.J., Stein J., Arena R., Bates B., Cherney L.R., Cramer S.C., Deruyter F., Eng J.J., Fisher B., Harvey R.L., et al. Guidelines for Adult Stroke Rehabilitation and Recovery: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2016. 47. e98-e169.
65. Nagappan P.G., Chen H., Wang D.-Y. Neuroregeneration and Plasticity: A Review of the Physiological Mechanisms for Achieving Functional Recovery Postinjury. Mil. Med. Res. 2020. 7. 30.
Оригінал статті надруковано
в J. Clin. Med. 2022. 11(5). 1273.
https://doi.org/10.3390/jcm11051273

/55.jpg)
/56.jpg)
/59.jpg)
/60.jpg)