Журнал «Здоровье ребенка» Том 17, №7, 2022
Вернуться к номеру
Вплив miR-155 грудного молока на стан здоров’я недоношених новонароджених
Авторы: Абатуров О.Є. (1), Товарницька А.О. (2)
(1) — Дніпровський державний медичний університет, м. Дніпро, Україна
(2) — ТОВ «Дніпровський медичний інститут традиційної і нетрадиційної медицини», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
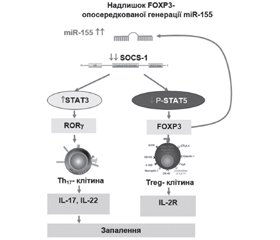
Актуальність. Грудне молоко (ГМ) — важливе джерело мікроРНК (miR). МікроРНК мають високу стійкість до впливу ферментів шлунково-кишкового тракту і добре всмоктуються в кишечнику. Однією з найбільш представлених miR у ГМ є miR-155. На сьогодні практично не вивчений вплив miR-155 ГМ на стан здоров’я передчасно народжених немовлят. Мета дослідження: встановити вплив miR-155 ГМ на стан здоров’я недоношених новонароджених дітей. Матеріали та методи. Нами обстежено 74 новонароджених, які проходили лікування в неонатальних відділеннях. Нами визначено рівень miR-155 у ГМ 44 матерів дітей, які перебували на виключно грудному вигодовуванні (ГВ). Паралельно проводилось визначення експресії генів фактора транскрипції FOXP3 у зскрібку букальної слизової оболонки всіх новонароджених. Було виділено три групи порівняння: першу становили новонароджені до 37 тижнів гестації на ГВ (32 дитини); другу — недоношені новонароджені на штучному вигодовуванні (ШВ) (30 дітей); контрольну — доношені новонароджені на ГВ (12 дітей). Результати. Медіана гестаційного віку дітей 1-ї групи становила 33 (31; 34) тижні; 2-ї — 32,5 (32; 35) тижня і була вищою в групі контролю (р < 0,001) — 40 (39; 41) тижнів. Неонатальна енцефалопатія як основний діагноз зустрічалась частіше серед доношених новонароджених (р < 0,001). Діти 1-ї та 2-ї груп суттєво не відрізнялись за частотою випадків респіраторного дистрес-синдрому й тривалістю необхідної респіраторної підтримки (р > 0,05). У 2-й групі порівняно з 1-ю вірогідно частіше (р < 0,05) зустрічались прояви некротизуючого ентероколіту (НЕК): 30,0 ± 8,4 % проти 9,4 ± 5,2 %. Результати оцінки рівня експресії miR-155 у ГМ матерів 1-ї групи доводять перевищення відповідного показника в контрольній групі в середньому в 6,2 раза (р < 0,001). Аналіз рівня FOXP3 у зскрібку букальної слизової оболонки немовлят показав, що в усіх недоношених дітей рівень FOXP3 був вірогідно нижчий, ніж у доношених (< 0,001). Проте в немовлят 2-ї групи експресія цього фактора була найнижчою (< 0,001): 0,08 (0,04; 0,16) ум.од. у 2-й групі проти 0,21 (0,14; 0,38) ум.од. у 1-й групі. Нами виявлено прямий помірний зв’язок між рівнями експресії miR-155 ГМ і експресією FOXP3 у клітинах слизової оболонки недоношених новонароджених, які перебували на ГВ: r = 0,442 (p = 0,014). Нами встановлено вірогідне зниження експресії FOXP3 у дітей з виявленим НЕК (0,11 (0,04; 0,25) ум.од.) порівняно з новонародженими без такої патології (0,22 (0,09; 0,91) ум.од.) (p < 0,05). Висновки. Результати дослідження підтверджують меншу кількість випадків НЕК серед недоношених дітей на ГВ. ГМ матерів, чиї діти народились передчасно, має вищий рівень експресії miR-155, що сприяє експресії FOXP3 слизових оболонок. Отже, miR-155 ГМ вірогідно стимулює дозрівання й підтримує рівень T-reg-клітин слизових оболонок, що перешкоджає розвитку НЕК у недоношених немовлят.
Background. Breast milk (BM) is an important source of microRNAs (miRs). MicroRNAs are highly resistant to gastrointestinal enzymes and are well absorbed in the intestine. MiR-155 is one of the most expressed miR of BM. Currently, the effect of miR-155 of BM on the health of preterm neonates has not been almost studied. The objective was to determine the effect of miR-155 of BM on the health of preterm neonates. Materials and methods. We examined 74 newborns, who were treated in neonatal departments. We determined the level of miR-155 in the BM of 44 mothers of exclusively breastfed children. In parallel, we evaluated gene expression of the transcription factor FOXP3 in buccal smears of all neonates. Three comparison groups were selected: group 1 consisted of 32 newborns of up to 37 weeks of gestation; group 2 — of 30 preterm newborns on artificial feeding; control group — of 12 full-term breastfed newborns. Results. The gestational age median in group 1 was 33 (31; 34) weeks; in group 2 — 32.5 (32; 35) weeks; it was higher in the control group (p < 0.001) — 40 (39; 41) weeks. Neonatal encephalopathy as the main diagnosis occurred more often among full-term newborns (p < 0.001). Children of groups 1 and 2 did not differ significantly in the frequency of respiratory distress syndrome and the duration of the necessary respiratory support (p > 0.05). In group 2 compared to group 1, manifestations of necrotizing enterocolitis were detected significantly more often (p < 0.05): 30.0 ± 8.4 % vs 9.4 ± 5.2 %. The results of evaluating the miR-155 expression level in the BM of mothers of group 1 children prove that the corresponding indicator in the control group was exceeded by an average of 6.2 (4.1; 9.2) times (p < 0.001). Analysis of FOXP3 levels in buccal smears showed that all preterm newborns had significantly lower FOXP3 levels than that of full-term neonates (< 0.001). However, the expression of this factor was the lowest in group 2 (< 0.001): 0.08 (0.04; 0.16) c.u. in group 2 vs 0.21 (0.14; 0.38) c.u. in group 1. We found a direct moderate correlation between the expression levels of miR-155 of the BM and the FOXP3 in the mucosal cells of breastfed preterm neonates: r = 0.442 (p = 0.014). A significant decrease was noted in the expression of FOXP3 in children with necrotizing enterocolitis (0.11 (0.04; 0.25) c.u.) compared to newborns without such pathology (0.22 (0.09; 0.91) c.u.) (p < 0.05). Conclusions. The results of the study confirm a lower number of necrotizing enterocolitis cases among preterm breastfed babies. BM of mothers, whose children were born prematurely, has a higher level of miR-155 expression, which promotes FOXP3 expression of mucous membranes. Thus, it is likely that miR-155 of BM stimulates maturation and maintains the level of T-reg cells of the mucous membranes that prevents the development of necrotizing enterocolitis in premature infants.
miR-155; FOXP3; недоношені діти; некротизуючий ентероколіт
miR-155; FOXP3; preterm neonates; necrotizing enterocolitis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Zempleni J., Sukreet S., Zhou F., Wu D., Mutai E. Milk-Derived Exosomes and Metabolic Regulation. Annu. Rev. Anim. Biosci. 2019 Feb 15. 7. 245-262. doi: 10.1146/annurev-animal-020518-115300. Epub 2018 Oct 4. PMID: 30285461.
- Carr L.E., Virmani M.D., Rosa F., Munblit D., Matazel K.S., Elolimy A.A., Yeruva L. Role of Human Milk Bioactives on Infants’ Gut and Immune Health. Front. Immunol. 2021 Feb 12. 12. 604080. doi: 10.3389/fimmu.2021.604080. PMID: 33643310; PMCID: PMC7909314.
- Golan-Gerstl R., Elbaum Shiff Y., Moshayoff V., Schecter D., Leshkowitz D., Reif S. Characterization and biological function of milk-derived miRNAs. Mol. Nutr. Food Res. 2017 Oct. 61(10). doi: 10.1002/mnfr.201700009. Epub 2017 Jul 31. PMID: 28643865.
- Toscano M., De Grandi R., Grossi E., Drago L. Role of the Human Breast Milk-Associated Microbiota on the Newborns’ Immune System: A Mini Review. Front. Microbiol. 2017 Oct 25. 8. 2100. doi: 10.3389/fmicb.2017.02100. PMID: 29118752; PMCID: PMC5661030.
- Rubio M., Bustamante M., Hernandez-Ferrer C., Fernandez-Orth D., Pantano L., Sarria Y. et al. Circulating miRNAs, isomiRs and small RNA clusters in human plasma and breast milk. PLoS One. 2018 Mar 5. 13(3). e0193527. doi: 10.1371/journal.pone.0193527. PMID: 29505615; PMCID: PMC5837101.
- Tingö L., Ahlberg E., Johansson L., Pedersen S.A., Chawla K., Sætrom P. et al. Non-Coding RNAs in Human Breast Milk: A Systematic Review. Front. Immunol. 2021 Sep 1. 12. 725323. doi: 10.3389/fimmu.2021.725323. PMID: 34539664; PMCID: PMC8440964.
- Lokossou G.A.G., Kouakanou L., Schumacher A., Zenclussen A.C. Human Breast Milk: From Food to Active Immune Response With Disease Protection in Infants and Mothers. Front. Immunol. 2022 Apr 5. 13. 849012. doi: 10.3389/fimmu.2022.849012. PMID: 35450064; PMCID: PMC9016618.
- Rodríguez-Galán A., Fernández-Messina L., Sánchez-Madrid F. Control of Immunoregulatory Molecules by miRNAs in T Cell Activation. Front. Immunol. 2018 Sep 25. 9. 2148. doi: 10.3389/fimmu.2018.02148. PMID: 30319616; PMCID: PMC6167432.
- Hatmal M.M., Al-Hatamleh M.A.I., Olaimat A.N., Alshaer W., Hasan H., Albakri K.A. et al. Immunomodulatory Properties of Human Breast Milk: MicroRNA Contents and Potential Epigenetic Effects. Biomedicines. 2022 May 24. 10(6). 1219. doi: 10.3390/biomedicines10061219. PMID: 35740242; PMCID: PMC9219990.
- Mahesh G., Biswas R. MicroRNA-155: A Master Regulator of Inflammation. J. Interferon Cytokine Res. 2019 Jun. 39(6). 321-330. doi: 10.1089/jir.2018.0155. Epub 2019 Mar 20. PMID: 30998423; PMCID: PMC6591773.
- Cuna A., George L., Sampath V. Genetic predisposition to necrotizing enterocolitis in premature infants: Current knowledge, challenges, and future directions. Semin. Fetal Neonatal Med. 2018 Dec. 23(6). 387-393. doi: 10.1016/j.siny.2018.08.006. Epub 2018 Aug 18. PMID: 30292709; PMCID: PMC6626706.
- Alsaied A., Islam N., Thalib L. Global incidence of Necrotizing Enterocolitis: a systematic review and meta-analysis. BMC Pediatr. 2020 Jul 13. 20(1). 344. doi: 10.1186/s12887-020-02231-5. PMID: 32660457; PMCID: PMC7359006.
- Yu W., Haque I., Venkatraman A., Menden H.L., Mabry S.M., Roy B.C. et al. SIGIRR Mutation in Human Necrotizing Enterocolitis (NEC) Disrupts STAT3-Dependent microRNA Expression in Neonatal Gut. Cell. Mol. Gastroenterol. Hepatol. 2022. 13(2). 425-440. doi: 10.1016/j.jcmgh.2021.09.009. Epub 2021 Sep 23. PMID: 34563711; PMCID: PMC8688179.
- Patel A.L., Kim J.H. Human milk and necrotizing enterocolitis. Semin. Pediatr. Surg. 2018 Feb. 27(1). 34-38. doi: 10.1053/j.sempedsurg.2017.11.007. Epub 2017 Nov 6. PMID: 29275815.
- Thai J.D., Gregory K.E. Bioactive Factors in Human Breast Milk Attenuate Intestinal Inflammation during Early Life. Nutrients. 2020 Feb 23. 12(2). 581. doi: 10.3390/nu12020581. PMID: 32102231; PMCID: PMC7071406.
- Carrillo-Lozano E., Sebastian-Valles F., Knott-Torcal C. Circulating microRNAs in Breast Milk and Their Potential Impact on the Infant. Nutrients. 2020. 12(10). 3066. Published 2020 Oct 8. doi: 10.3390/nu12103066.
- Melnik B.C., Stremmel W., Weiskirchen R., John S.M., Schmitz G. Exosome-Derived MicroRNAs of Human Milk and Their Effects on Infant Health and Development. Biomolecules. 2021. 11. 851. https://doi.org/10.3390/biom11060851.
- Guo M.M., Zhang K., Zhang J.H. Human Breast Milk-Derived Exosomal miR-148a-3p Protects Against Necrotizing Enterocolitis by Regulating p53 and Sirtuin 1. Inflammation. 2022 Jun. 45(3). 1254-1268. doi: 10.1007/s10753-021-01618-5. Epub 2022 Jan 29. PMID: 35091894.
- Guo J., Liao M., Wang J. TLR4 signaling in the development of colitis-associated cancer and its possible interplay with microRNA-155. Cell. Commun. Signal. 2021 Sep 3. 19(1). 90. doi: 10.1186/s12964-021-00771-6. PMID: 34479599; PMCID: PMC8414775.
- Ceppi M., Pereira P.M., Dunand-Sauthier I., Barras E., Reith W., Santos M.A., Pierre P. MicroRNA-155 modulates the interleukin-1 signaling pathway in activated human monocyte-derived dendritic cells. Proc. Natl. Acad. Sci. USA. 2009 Feb 24. 106(8). 2735-40. doi: 10.1073/pnas.0811073106. Epub 2009 Feb 4. PMID: 19193853; PMCID: PMC2650335.
- Alivernini S., Gremese E., McSharry C., Tolusso B., Ferraccioli G., McInnes I.B., Kurowska-Stolarska M. MicroRNA-155 at the Critical Interface of Innate and Adaptive Immunity in Arthritis. Front. Immunol. 2018 Jan 5. 8. 1932. doi: 10.3389/fimmu.2017.01932. PMID: 29354135; PMCID: PMC5760508.
- Lu L.F., Thai T.H., Calado D.P., Chaudhry A., Kubo M., Tanaka K. et al. Foxp3-dependent microRNA155 confers competitive fitness to regulatory T cells by targeting SOCS1 protein. Immunity. 2009 Jan 16. 30(1). 80-91. doi: 10.1016/j.immuni.2008.11.010. PMID: 19144316; PMCID: PMC2654249.
- Yao R., Ma Y.L., Liang W., Li H.H., Ma Z.J., Yu X., Liao Y.H. MicroRNA-155 modulates Treg and Th17 cells differentiation and Th17 cell function by targeting SOCS1. PLoS One. 2012. 7(10). e46082. doi: 10.1371/journal.pone.0046082. Epub 2012 Oct 16. PMID: 23091595; PMCID: PMC3473054.
- Kunze-Schumacher H., Krueger A. The Role of MicroRNAs in Development and Function of Regulatory T Cells — Lessons for a Better Understanding of MicroRNA Biology. Front. Immunol. 2020 Sep 9. 11. 2185. doi: 10.3389/fimmu.2020.02185. PMID: 33013919; PMCID: PMC7509487.
- Weinberg S.E., Singer B.D. Toward a Paradigm to Distinguish Distinct Functions of FOXP3+ Regulatory T Cells. Immunohorizons. 2021 Dec 10. 5(12). 944-952. doi: 10.4049/immunohorizons.2100046. PMID: 34893512; PMCID: PMC8691855.
- Naqvi R.A., Datta M., Khan S.H., Naqvi A.R. Regulatory roles of MicroRNA in shaping T cell function, differentiation and polarization. Semin. Cell. Dev. Biol. 2022 Apr. 124. 34-47. doi: 10.1016/j.semcdb.2021.08.003. Epub 2021 Aug 24. PMID: 34446356.
- Xu M., Zuo D., Liu X., Fan H., Chen Q., Deng S. et al. MiR-155 contributes to Th17 cells differentiation in dextran sulfate sodium (DSS)-induced colitis mice via Jarid2. Biochem. Biophys. Res. Commun. 2017 Jun 17. 488(1). 6-14. doi: 10.1016/j.bbrc.2017.04.143. Epub 2017 Apr 28. PMID: 28461115.
- Motaei J., Yaghmaie M., Ahmadvand M., Pashaiefar H., Kerachian M.A. MicroRNAs as Potential Diagnostic, Prognostic, and Predictive Biomarkers for Acute Graft-versus-Host Disease. Biol. Blood Marrow Transplant. 2019 Dec. 25(12). e375-e386. doi: 10.1016/j.bbmt.2019.08.004. Epub 2019 Aug 13. PMID: 31419566.
- Zhang Y., Xie Y., Zhang L., Zhao H. MicroRNA-155 Participates in Smoke-Inhalation-Induced Acute Lung Injury through Inhibition of SOCS-1. Molecules. 2020 Feb 25. 25(5). 1022. doi: 10.3390/molecules25051022. PMID: 32106541; PMCID: PMC7179228.