Вступ
У цей складний час наше відділення не припиняє надавати якісну медичну допомогу дітям з різноплановою неврологічною патологією. Час відкритої воєнної агресії несе не лише пряму загрозу для життя та здоров’я дітей, але й уводить їх та їхні сім’ї в умови хронічного стресу.
Стрес — реакція організму на стимули середовища, зовнішнього (вибухи, спостереження активного чи пасивного насилля, зруйнованих об’єктів інфраструктури, воєнних дій) чи внутрішнього (голод, спрага, біль, недостатність сну), що в умовах воєнного стану стала хронічною для багатьох сімей, у тому числі сімей, що виховують дітей з розладами нейророзвитку [1].
Типи реакцій організму на стрес можна розділити так:
а) реакція тривоги (пришвидшення метаболізму, стимуляція ендокринної системи гіпоталамо-гіпофізарним комплексом із виділенням катехоламінів (адреналіну та норадреналіну) та кортикостероїдів (кортизолу та глюкокортикостероїдів);
б) реакція адаптації;
в) реакція виснаження.
Реакція тривоги змінюється реакцією адаптації залежно від тривалості дії стресогенного тригера та резервних сил організму і закінчується пристосуванням до стресу за допомогою стреслімітуючих систем або реакцією виснаження при їх вичерпанні чи дисфункції.
На сьогодні відомі такі стреслімітуючі системи:
а) ГАМКергічна система, ключовим нейромедіатором якої є гамма-аміномасляна кислота, яка чинить гальмівну дію на нейрони;
б) серотонінергічна система, ключовим нейромедіатором якої є серотонін, який впливає як на мигдалину, так і на складові кортико-стріато-таламічно-кортикального шляху: префронтальну кору, смугасте тіло й таламус;
в) опіоїдергічна система, ключовими речовинами якої є опіоїдні пептиди, що секретуються клітинами гіпофіза та чинять виражену гальмівну дію;
г) кортиколіберинова та простагландинова системи, що регулюють виділення гальмівних речовин;
д) антиоксидантна система.
Таким чином, стійкість до стресорних ушкоджень значною мірою визначається співвідношенням активності стресактивуючих і стреслімітуючих систем. Оскільки активність протистресових факторів у дітей із розладами нейророзвитку знижена внаслідок дисфункції префронтальної кори та дофамінергічної системи, їх виснаження наступає значно раніше, ніж у нормотипових дітей. Відповідно, у пацієнтів цієї групи стрес швидше спричиняє реакції виснаження із розвитком стресових субсиндромів та розладів.
Розлади нейророзвитку (neurodevelopmental disorders) являють собою групу патологічних станів, що супроводжуються порушенням нормального розвитку нервової системи та найчастіше проявляються аномальним розвитком рухових, когнітивних, соціальних та поведінкових навичок [2].
У широкому розумінні до розладів нейророзвитку відносять, зокрема, розлади аутистичного спектра (РАС), синдром гіперактивності з дефіцитом уваги, епілепсії та епілептичні енцефалопатії, порушення навчальних навичок, інтелектуальну недостатність, поведінкові розлади, дитячий церебральний параліч, порушення зору та слуху тощо.
Відомо, що поширеність та тяжкість порушень нічного сну у дітей з розладами нейророзвитку є більшими, ніж у нормотипових дітей. Приблизно 40–80 % дітей з розладами нейророзвитку страждають на такі порушення нічного сну, як труднощі із засинанням, часті нічні пробудження, нічні жахи, порушення дихання під час сну або нічний енурез [3].
Міжнародна класифікація порушень сну виділяє понад 100 окремих видів порушень сну, умовно поділених на 8 груп: інсомнії, гіперсомнії, парасомнії, порушення циркадних ритмів, пов’язані зі сном порушення дихання та інші [4].
Інсомнії, або розлади нічного сну, — недостатня тривалість нічного сну або відсутність відчуття відпочинку після звичної тривалості сну.
Парасомнії — рухові, поведінкові або вегетативні феномени, що виникають у специфічному зв’язку з процесом сну, але необов’язково пов’язані з розладом сну або надмірною сонливістю.
Порушення ритму «сон — неспання», або розлади циркадних ритмів, являють собою розлади циркадних ритмів, зумовлені екзогенними та ендогенними факторами, і проявляються інсомнією вночі та гіперсомнією вдень, порушенням пам’яті та концентрації уваги.
Гіперсомнії — група розладів, що проявляються підвищеною денною сонливістю або патологічним збільшенням тривалості нічного сну.
Інсомнії (безсоння) у дітей визначаються як стійке порушення засинання, тривалості, підтримання та якості сну, що призводить до порушення денного функціонування дитини або її родини. Поведінкові інсомнії зазвичай проявляються спротивом або відмовою вкладатися спати, відкладенням часу відходу до сну або частими нічними пробудженнями, що потребують втручання батьків. Виділяють три типи поведінкової інсомнії [5]:
— розлад асоціацій при засинанні (sleep onset association disorder);
— розлад сну, пов’язаний з порушенням меж засинання (limit-settings sleep disorders);
— комбінований тип.
Поширеність інсомній у дітей становить 10–40 % та є вищою у дітей з порушеннями нервово-психічного розвитку, а також у дівчаток вікової групи 10–12 років (30,6 %). Поняття інсомнії містить труднощі із засинанням та підтриманням сну, занадто ранні пробудження та низьку якість сну та будь-яке поєднання вищенаведених скарг [6].
Однією з найчастіших форм поведінкових інсомній є розлад асоціацій при засинанні. Цей розлад найчастіше зустрічається в дітей між 6-м і 36-м місяцями життя, причому у хлопчиків у 3 рази частіше, ніж у дівчаток. Причина в тому, що дитина не вміє засинати самостійно. При засинанні дитини завжди присутні мати або батько, які здійснюють певні дії для того, щоб дитина заснула: гойдають, гладять по спині, тримають на руках, дають соску. Таким чином, створюються певні обставини, які асоціюються в дитини із засинанням [10].
У нормі під час нічного сну відбувається чергування фаз глибокого повільного сну й поверхневого швидкого сну. Ця фаза сну супроводжується рухами очей під опущеними повіками, звідси й походить її назва — rapid eye movement sleep, або REM-сон. Відразу після засинання настає фаза глибокого сну. Надалі фази REM-cну з’являються кілька разів за ніч, іноді під час них дитина може прокидатися на короткий час і швидко засинати, якщо вона має звичку це робити самостійно. Тобто в дитини наявні навички самозаспокоєння, регуляції своїх емоцій, для розвитку яких немає необхідності у присутності батьків. У дитини з розладом асоціацій процес засинання довший. У подальшому кожні 2–3 години виникають пробудження, пов’язані з фазами REM-сну. Під час них дитині потрібне повторення обставин, які зазвичай супроводжують засинання, для погашення інстинкту самозбереження, що активується підкірковими структурами головного мозку. Наприклад, дитина, яка звикла засинати під час годування груддю, із соскою або під час гойдання, починає при пробудженні шукати звичні обставини засинання [5–7].
У дітей дошкільного віку розлад асоціацій засинання може мати менш очевидні форми. Наприклад, коли один або обидва батьки перебувають у кімнаті дитини під час її засинання, а потім залишають приміщення, нічні пробудження можуть супроводжуватися вставанням з ліжка та пошуком батьків по оселі.
Від порушень нічного сну страждає не тільки дитина, але й батьки. За даними досліджень, у сім’ях, у яких дитина страждає від розладу асоціацій при засинанні, у батьків більш високий рівень депресії й нижчий показник сімейної близькості. Перш за все депривація сну негативно впливає на матерів — у них відмічається підвищений рівень тривожності та депресії. Ключ до розв’язання цієї проблеми — навчити дитину засинати самостійно [6–8].
У дітей дошкільного віку (3–6 років) частіше зустрічається вид поведінкової інсомнії, при якій дитина відмовляється лягати спати. Щовечора вкладання у ліжко перетворюється на сутичку з бурею емоцій. Це може бути проявом розладу сну, що називається limit-settings sleep disorders — розлад сну, пов’язаний із порушенням меж засинання. Ознака цього порушення — відмова дитини лягати спати в певний час. Це супроводжується протестами, сльозами і криком. Також дитина йде на різні хитрощі для того, щоб відкласти час вкладання в ліжко. Батьки вкладають дитину спати, але вона знову і знову кличе їх і вимагає уваги [9].
Найчастіше, щоб відтягнути момент засинання, дитина може:
— просити пити;
— проситися в туалет;
— кидати речі;
— ставити одне запитання за іншим;
— просити розповісти ще одну казку, заспівати пісеньку;
— просити знову обійняти, потерти спинку;
— скаржитися на те, що їй страшно (без явних ознак страху) тощо.
Про розлад засинання йдеться тоді, коли час засинання відкладається більше ніж на 1 годину. Корекція цього розладу зазвичай немедикаментозна, застосовується методика поступового погашення негативної поведінки.
На відміну від нормотипових дітей у дітей із РАС проблеми зі сном є більш поширеними та стійкими, складно піддаються корекції поведінковими методами. Проблеми із засинанням та тривалістю сну мають 44–86 % дітей з аутизмом [9, 10]. Найчастіші порушення сну в дітей із РАС [11]:
— відмова лягати спати, неможливість заснути без присутності дорослого;
— тривале засинання;
— часті пробудження;
— мала тривалість сну;
— денна сонливість, дратівливість, порушення уваги, пов’язані з регулярною нестачею сну.
Американська академія неврології в новому керівництві щодо розладів сну в дітей і підлітків з аутизмом рекомендує починати з виключення можливої побічної дії лікарських засобів на сон, а також із корекції соматичних проблем (наприклад, розладів шлунково-кишкового тракту). Ефективні поведінкові методи корекції порушень сну, рекомендовані для дітей із РАС [12–14]:
— дотримання режиму сну з постійним графіком часу засинання та пробудження;
— уникнення тривалого сну вдень та пізнього вкладання на денний сон;
— збільшення фізичної активності вдень;
— виключення переїдання на ніч;
— виключення перегляду гаджетів перед сном;
— дотримання оптимальних умов для сну — темрява, тиша і прохолода в спальні;
— використання ліжка тільки для сну;
— привчання дитини до самостійного засинання у власному ліжку;
— призначення мелатоніну при неефективності поведінкових методів.
Спеціалізуючись на роботі із дітьми з розладами ней-
ророзвитку, ми відмітили, що порушення засинання та підтримання сну, а також парасомнії є одними із ключових скарг батьків при обстеженні в період з початку повномаштабного вторгнення, тому прийнято рішення про проведення роботи із дослідження їх поширеності та структури порівняно із контрольною групою.
Мета роботи: визначити поширеність порушень нічного сну у дітей з розладами нейророзвитку в період воєнного часу, порівняти їх з відповідними показниками у здорових дітей та оцінити ефективність їх корекції за допомогою нейроадаптогену Фломма.
Матеріали та методи
Проведено онлайн-опитування батьків 529 дітей віком від 1 до 7 років (середній вік 3,6 ± 2,8 року), у тому числі 354 (66,9 %) хлопчиків та 175 (33,1 %) дівчаток. Було опитано батьків 184 (34,7 %) дітей з розладами аутистичного спектра, 102 (19,2 %) — із затримкою мовленнєвого розвитку (ЗМР), 27 (5,1 %) — з епілепсією, 24 (4,5 %) — з гіперактивним розладом з дефіцитом уваги (ГРДУ), 15 (2,8 %) — з тиками, 15 (2,8 %) — з генетичними синдромами, 20 (3,8 %) — з церебральним паралічем, а також 142 (26,8 %) здорових дітей.
Розроблений нами опитувальник містив запитання щодо віку, статі та діагнозу дитини, наявності скарг, характерних для інсомній, парасомній та гіперсомній.
Для оцінки ефективності корекції порушень сну у дітей застосовувався адаптований опитувальник Children’s Sleep Habits Questionnaire (CSHQ) в адаптації Ю. Вакуленко [15].
Результати та обговорення
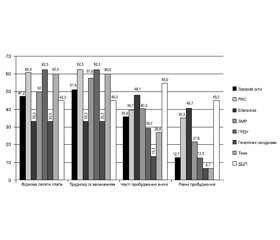
Загальна поширеність розладів сну серед усіх опитаних дітей становила 94,5 % (500/529), у тому числі серед здорових дітей 93,6 % (133/142), а серед дітей з розладами нейророзвитку — 94,8 % (367/387). Статистично вірогідних відмінностей показника поширеності розладів сну серед дітей з різними діагнозами виявлено не було (рис. 1).
Блок запитань, які стосувалися симптомів порушень засинання та підтримання сну, містив 4 запитання:
1. Чи бувають у вас труднощі з вкладанням дитини, коли вона відмовляється вкладатися до ліжка?
2. Чи є у дитини труднощі, пов’язані з тривалим засинанням вночі?
3. Чи турбують вас часті пробудження дитини під час нічного сну?
4. Чи турбують вас занадто ранні пробудження дитини вранці?
Загальна поширеність труднощів із вкладанням у здорових дітей становила 47,2 % (67/142), а у дітей з розладами нейророзвитку — 54,3 % (210/387). Найчастіше ця скарга відмічалася у дітей з РАС — 60,9 % (112/184), ГРДУ — 62,5 % (15/24) та тиками — 60,0 % (9/15).
Тривале засинання відмічалося у 51,4 % здорових дітей (73/142) та у 56,8 % (220/387) дітей з розладами нейророзвитку. Найчастіше ця скарга відмічалася у дітей з РАС — 62,5 % (115/184), ГРДУ — 62,5 % (15/24), тиками — 60,0 % (9/15), ЗМР — 57,8 % (59/102).
Часті нічні пробудження відмічалися у 35,9 % здорових дітей (51/142) та у 39,0 % дітей з розладами нейророзвитку (151/387). Часті пробудження були характерними для дітей з ДЦП — 55,0 % (11/20), епілепсією — 48,1 % (13/27), ЗМР — 40,2 % (41/102), РАС — 39,7 % (73/184).
Занадто ранні пробудження відмічалися у 12,7 % здорових дітей (18/142) та у 29,2 % дітей з розладами ней-
ророзвитку (113/387). Найчастіше ранні пробудження відмічалися у дітей з ДЦП — 45 % (9/20), РАС — 35,3 % (65/184) та епілепсією — 40,7 (11/27) (рис. 2).
У корекції синдрому розладів засинання та підтримання сну у дітей із розладами нейророзвитку нами широко застосовуються нейроадаптогени.
Проведене клінічне спостереження ефективності використання нейроадаптогену Фломма у дітей як із ізольованими порушеннями сну, так і за їх наявності як суміжної скарги у комплексі розладів ней-ророзвитку. Обстежено 70 дітей, що проходили лікування на базі відділення психоневрології ДУ «ІПАГ ім. О.М. Лук’янової НАМН України» в період воєнного часу та мали розлади засинання та підтримання сну як одну із домінуючих скарг.
Віковий діапазон обстежених дітей становив від 3 до 7 років (середній вік 4,00 ± 2,34 року). Усі діти були розподілені на 2 групи: 1-ша група — 42 дитини із діагностованими розладами нейророзвитку; 2-га група — 28 нормотипових дітей із ізольованими розладами засинання та підтримання сну.
Критеріями включення у дослідження були такі:
1) вік від 3 до 7 років;
2) наявність стійких порушень сну та засинання, що турбують більше ніж 3 міс.;
3) відсутність соматичної патології, що може спровокувати порушення нічного сну;
4) згода на проведення запропонованої терапії при детальному ознайомленні із складом та механізмом дії;
5) підписання інформованої згоди.
Дослідження було схвалене комісією з біоетики та деонтології ДУ «ІПАГ ім. О.М. Лук’янової НАМН України».
У дітей 1-ї групи частіше відмічалися такі розлади сну, як часті та ранні пробудження, міоклонії сну, сплутані пробудження, інсомнії, парасомнії, розлади дихання під час сну тощо. Наслідками порушеного нічного сну у дітей з розладами нейророзвитку можуть бути порушення поведінки, роздратованість та зниження уваги у денний час. Причинами розладів нічного сну можуть бути порушення синтезу мелатоніну, гіперчутливість до подразників навколишнього середовища, синдром затримки фаз сну, епілептичні напади та епілептиформна активність під час сну, розлади дихання під час сну тощо. У дітей 2-ї групи домінували труднощі із вкладанням та тривале засинання в рамках поведінкової інсомнії, часті пробудження та нічний неорганічний енурез (табл. 1).
/27_2.jpg)
З огляду на те, що значна частина дітей в умовах воєнного стану перебувала в хронічному стресі, порушення сну часто розвивалися на фоні невротичних розладів. Невротична симптоматика проявлялася у вигляді страхів, підвищеної тривожності, логоневрозів та тикозних розладів. У дітей з розладами нейророзвитку відмічалося наростання агресії та автоагресії, підвищення симптомів сенсорних порушень (надмірна чутливість до тактильних, слухових, зорових чи смакових стимулів чи, навпаки, зниження їх сприйняття), гіпер-активна поведінка, збільшення нав’язливих рухів та самостимуляцій.
З метою корекції розладів сну усім дітям призначався нейроадаптоген Фломма протягом 30 діб у дозуванні 5 мл 1 раз на добу.
Нейроадаптоген Фломма містить у складі один із протеїнів, що отримують при гідролізі коров’ячого αs1-казеїну, — альфа-казозепін.
Альфа-казозепін (α-CZP) є біоактивним декапептидом, що відповідає фрагменту 91–100 (YLGYLEQLLR) αs1-казеїну бичачого молока, є компонентом, що має анксіолітичну активність триптичного гідролізату [16]. N-кінцевий пептид YLGYL був раніше ідентифікований після протеолізу вихідного пептиду в моделі травлення in vitro [17]. Подібні до анксіолітика ефекти триптичного гідролізату бичачого αs1-казеїну були виявлені після внутрішньоочеревинного та перорального введення гризунам, котам, собакам, коням і поні [18–21]. Гідролізат також продемонстрував протисудомну дію. Клінічні випробування показали, що він мав позитивний вплив як на фізичні, так і на психологічні симптоми тривоги у людей [22]. α-CZP також демонстрував анксіолітичну активність у щурів і мишей і модулював нейрональну активність у кількох ділянках мозку, пов’язану з регуляцією тривоги у мишей; у дослідженні за допомогою імунофлуоресценції оцінювали та порівнювали ефекти α-CZP і діазепаму, еталонного анксіолітика-бензодіазепіну.
Властивості альфа-казозепіну близькі до властивостей сімейства бензодіазепінів, за винятком таких супутніх побічних ефектів, як звикання або седація, тому останнім часом альфа-казозепін частіше застосовують як дієтичну добавку для поліпшення сну та усунення стресових розладів [23].
Анксіолітичні ефекти альфа-казозепіну за останні 20 років підтверджені багатьма дослідженнями. Встановлено, що альфа-казозепін впливає на сон, модулюючи його архітектуру, при цьому не справляючи седативного ефекту, що робить його схожим на мелатонін. Вплив альфа-казозепіну на сон пов’язаний із рецепторами ГАМК. Виявлено, що при транспортуванні пептиду через гематоенцефалічний бар’єр виділяється С-кінцевий залишок триптофану, попередника серотоніну, що є важливим нейромедіатором у регуляції настрою та насичення. Доведено безпосередню модуляцію альфа-казозепіном рецепторів ГАМК, у тому числі в нейронах гіпоталамуса [24, 25].
Два пептиди показали деякі значні відмінності порівняно з діазепамом з точки зору модуляції експресії c-Fos у префонтальній корі, мигдалеподібному тілі, ядрі tractus solitarius, періакведуктальному сірому ядрі та ядрі великого шва, що вказує на потенційно інший спосіб дії. Крім того, YLGYL модулював експресію c-Fos у мигдалеподібному тілі та в одному з ядер шва, демонструючи дещо подібну схему активації, як α-CZP. Тим не менше, між двома пептидами також були помічені деякі відмінності, що дозволило сформулювати гіпотезу про те, що ці пептиди можуть по-різному діяти на регуляцію тривоги. У сукупності ці результати показали, що YLGYL може сприяти загальній дії α-CZP in vivo [26].
За результатами клінічних випробувань, альфа-казозепін позитивно впливав як на фізичну, так і на психологічну симптоматику тривожності. Показано, що застосування альфа-казозепіну сприяє більш швидкому відновленню після стресової реакції, що проявляється меншими показниками артеріального тиску та частоти серцевих скорочень у період релаксації (після стресу) порівняно з періодом відпочинку (до індукції стресу) [27].
Таким чином, нейроадаптоген Фломма є перспективним для застосування при різних функціональних розладах нервової системи, порушеннях сну, тривожних станах, у комплексному лікуванні пацієнтів із судинною дистонією, у тому числі в дитячому віці.
Загальну поширеність порушень сну в обстежених дітей з РАС визначено за допомогою опитувальника CSHQ-A до та після лікування (табл. 2).
Позитивна динаміка була відмічена вже після першого тижня застосування нейроадаптогену Фломма у 18 дітей (43 %) 1-ї та 11 дітей (39 %) 2-ї групи. Порівнюючи результати після курсу лікування, можна дійти висновку, що серед пацієнтів першої групи розлади сну скоротились у цілому на 71 % (з 42 до 12 дітей), при цьому позитивна динаміка стосувалась усіх наявних розладів. У 2-й групі частота порушень сну зменшилася на 75 % (з 28 до 7 дітей) (табл. 3).
/28.jpg)
Таким чином, після 30 діб застосування нейроадаптогену Фломма відмічалося зменшення частоти усіх видів розладів сну та зниження балів за усіма субшкалами опитувальника CSHQ як у нормотипових дітей, так і у дітей з розладами нейророзвитку, що дозволяє рекомендувати цю дієтичну добавку до застосування у комплексній корекції порушень засинання та підтримання сну. Також важливим є те, що поряд із нормалізацією сну та засинання батьками було відмічено зменшення рівня загальної тривожності та підвищення якості денної активності, поліпшення поведінки та уваги.
Висновки
Порушення засинання та підтримання сну у дітей з розладами нейророзвитку залишаються однією з найскладніших проблем сучасної нейропедіатрії. Підходи до диференційної діагностики та лікування інсомній є спірними у сомнології. Критерії діагнозу та прогнозу, тактика лікування — ось неповний перелік питань, які ставить перед собою дитячий невролог, спостерігаючи дитину з розладами сну. Значний рівень поширеності хронічного стресу у дітей в період воєнного часу призводить до зростання частоти порушень засинання та підтримання сну, що обумовлює необхідність пошуку ефективних та безпечних засобів для їх корекції.
На основі клінічного спостереження показано високу ефективність застосування нейроадаптогену Фломма при розладах сну та засинання як у вигляді самостійного розладу у нормотипових дітей, так і у вигляді симптому у дітей з розладами нейророзвитку, особливо в умовах гострого та хронічного стресу, обумовленого воєнним станом.
Призначення дієтичної добавки (нейроадаптогену) Фломма дітям із розладами нейророзвитку, які мають порушення нічного сну, сприяє швидкій нормалізації засинання, зменшенню кількості пробуджень, парасомній, зменшенню рівня тривоги, підвищенню якості життя та поліпшенню денного функціонування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 18.10.2022
Рецензовано/Revised 01.11.2022
Прийнято до друку/Accepted 10.11.2022
Список литературы
1. Кирилова Л.Г., Мірошников О.О. Диференціальна діагностика синдрому ранньої дитячої нервовості у практиці педіатра. Здоров’я дитини. 2020. № 15 (5). С. 24-32.
2. Devnani P.A., Hegde A.U. Autism and sleep disorders. Journal of Pediatric Neurosciences. 2015. 10 (4). 304-307. doi: 10.4103/1817-1745.174438.
3. Agargun M.Y., Cilli A.S., Sener S., Bilici M., Ozer O.A., Selvi Y., Karacan E. The prevalence of parasomnias in preadolescent school-aged children: a Turkish sample. Sleep. 2004. 27 (4). 701-705. doi: 10.1093/sleep/27.4.701.
4. Sateia M.J. International classification of sleep disorders-third edition: highlights and modifications. Chest. 2014. 146 (5). 1387-1394. doi: 10.1378/chest.14-0970.
5. Кирилова Л.Г., Шевченко О.А., Грабовенська І.О., Мірошников О.О. Гіперсомнії у дітей: нарколепсія та синдром Клейна-Левіна-Крічлі. Укр. мед. альманах. 2012. № 15 (4). С. 69-74.
6. Кирилова Л.Г., Мірошников О.О., Юзва О.О., Берегела О.В. Найбільш поширені розлади сну у дітей та підходи до їх фармакологічної та нефармакологічної корекції. Здоров’я дитини. 2021. Т. 16 (1). URL: http://www.mif-ua.com/archive/article/50345.
7. Kotagal S. Parasomnias of childhood. Current Opini–on іn Pediatrics. 2008. 20 (6). 659-665. doi: 10.1097/MOP.0b013e328316bd9d.
8. Ekambaram V., Maski K. Non-Rapid Eye Movement Arousal Parasomnias in Children. Pediatric Аnnals. 2017. 46 (9). e327-e331. doi: 10.3928/19382359-20170814-01.
9. Irwanto, Rehatta N.M., Hartini S., Takada S. Sleep Problem of Children with Autistic Spectrum Disorder Assessed by Children Sleep Habits Questionnaire-Abbreviated in Indonesia and Japan. The Kobe Journal оf Medical Sciences. 2016. 62 (2). E22-E26.
10. Al-Biltagi M.A. Childhood epilepsy and sleep. World Journal оf Clinical Pediatrics. 2014. 3 (3). 45-53. doi: 10.5409/wjcp.v3.i3.45.
11. Ming X., Sun Y.M., Nachajon R.V., Brimacombe M., Walters A.S. Prevalence of parasomnia in autistic children with sleep disorders. Clinical Medicine. Pediatrics. 2009. 3. 1-10. doi: 10.4137/cmped.s1139.
12. Schenck C.H., Mahowald M.W. REM sleep behavior disorder: clinical, developmental, and neuroscience perspectives 16 years after its formal identification in SLEEP. Sleep. 2002. 25 (2). 120-138. doi: 10.1093/sleep/25.2.120.
13. Singh S., Kaur H., Singh S., Khawaja I. Parasomnias: A Comprehensive Review. Cureus. 2018. 10 (12). e3807. doi: 10.7759/cureus.3807.
14. Leung A., Leung A., Wong A., Hon K.L. Sleep Terrors: An Updated Review. Current Pediatric Reviews. 2020. 16 (3). 176-182. doi: 10.2174/1573396315666191014152136.
15. Вакуленко Ю. Children’s Sleep Habits Questionnaire (CSHQ): адаптація на українській вибірці. Проблеми сучасної психології. 2020. № 48. С. 35-58.
16. Мікло Л., Перрен Е., Дріу А., Пападопулос В., Бужрад Н., Вандересс Р., Будьє Дж.Ф., Десор Д., Лінден Г., Гай-яр Ж.-Л. Характеристика альфа-казозепіну, триптичного пептиду з бичачого альфа(s1)-казеїну з бензодіазепіноподібною активністю. FASEB J. 2001. 15. 1780-1782. doi: 10.1096/fj.00-0685fje.
17. Messaoudi M., Lalonde R., Schroeder H., Desor D. Анксіолітичні ефекти та профіль безпеки триптичного гідролізату з бичачого альфа-s1-казеїну у щурів. Fundament. Clin. Pharmacol. 2009. 23. 323-330. doi: 10.1111/j.1472-8206.2009.00672.x.
18. Beata C., Beaumont-Graff E., Coll V., Cordel J., Marion M., Massal N., Marlois N., Tauzin J. Вплив альфа-казозепіну (Zylkene) на тривогу у котів. J. Vet. Clin. 2007. 2. 40-46. doi: 10.1016/j.jveb.2007.02.002.
19. Beata C., Beaumont-Graff E., Diaz C., Marion M., Massal N., Marlois N., Muller G., Lefranc-Millot C. Ефекти альфа-казозепіну (Zylkene) проти селегіліну гідрохлориду (Selgian , Аніприл) на тривожні розлади у собак. J. Vet. Clin. 2007. 2. 175-183. doi: 10.1016/j.jveb.2007.08.001.
20. McDonnell S.M., Miller J., Vaala W. Заспокійлива користь від короткочасного прийому добавок альфа-казозепіну під час адаптації до домашнього середовища та базового наземного навчання дорослих напівздичавілих поні. J. Equine Vet. 2013. 33. 101-106. doi: 10.1016/j.jevs.2012.05.060
21. McDonnell S.M., Miller J., Vaala W. Скромне покращення комплаєнсу та очевидного комфорту коней з відразою до звичайних медичних процедур, що викликають помірну аверсію, після короткочасного прийому альфа-казозепіну. J. Equine Vet. 2014. 34. 1016-1020. doi: 10.1016/j.jevs.2014.06.003.
22. Lanoir D., Canini F., Messaoudi M., Lefranc-Millot C., Demagny B., Martin S., Bourdon L. Довгостроковий вплив гідролізату казеїну альфа-s1 бичачого молока на здорових людей, які реагують на низький і високий рівень стресу. Стрес. 2002. 5. 124.
23. Messaoudi M., Lefranc-Millot C., Desor D., Demagny B., Bourdon L. Вплив триптичного гідролізату з альфаS1-казеїну бичачого молока на гемодинамічні реакції у здорових добровольців, які стикаються з послідовними психічними та фізичними стресовими ситуаціями. Eur J. Nutr. 2005. 44. 128-132. doi: 10.1007/s00394-004-0534-7.
24. Kim J.H., Desor D., Kim Y.T., Yoon W.J., Kim K.S., Jun J.S., Pyun K.H., Shim I. Ефективність гідролізату альфа-1-казеїну на симптоми, пов’язані зі стресом у жінок. Eur J. Clin. Nutr. 2007. 61. 536-541. doi: 10.1038/sj.ejcn.1602553.
25. Cakir-Kiefer C., Le Roux Y., Balandras F., Trabalon M., Dary A., Laurent F., Gaillard J.-L., Miclo L. Засвоюваність in vitro α-казозепіну, бензодіазепін-подібного пептиду з бичачого казеїну, і біологічна активність його основного протеолітичного фрагмента. J. Agric. Food Chem. 2011. 59. 4464-4472. doi: 10.1021/jf104089c.
26. Mizushige T., Sawashi Y., Yamada A., Kanamoto R., Ohinata K. Характеристика Tyr-Leu-Gly, нового анксіолітикоподібного пептиду, який виділяється з бичачого αS-казеїну. FASEB J. 2013. 27. 2911-2917. doi: 10.1096/fj.12-225474.
27. Benoit S., Chaumontet C., Schwarz J., Cakir-Kiefer C., Tomé D., Miclo L. Картування ділянок мозку мишей, залучених до анксіолітичних властивостей α-казозепіну, триптичного пептиду, отриманого з бичачого α s1-казеїну. J. Funct. Foods. 2017. 38. 464-473. doi: 10.1016/j.jff.2017.09.014.

/26.jpg)
/27.jpg)
/27_2.jpg)
/28.jpg)