На сьогодні відзначається зростання інтересу до проблеми когнітивних порушень. Це обумовлено розкриттям нових патогенетичних механізмів зниження когнітивних функцій (КФ), розробкою на цій основі підходів до відновлення нейронів головного мозку і збільшенням частки людей похилого і старечого віку [1, 2].
Найбільш тяжкою формою когнітивних порушень є деменція. Нині у світі близько 55 млн осіб страждають від деменції, причому 2/3 з них проживають у країнах з низьким і середнім рівнем доходу. Очікується, що до 2030 року цей показник зросте до 82 млн, а до 2050 року становитиме вже 152 млн [3]. Кількість пацієнтів із деменцією в Україні на сьогодні становить близько 500 тис. [11].
Деменція є однією з основних причин інвалідності й залежності серед людей похилого віку в усьому світі. Вона чинить фізичний, психологічний, соціальний та економічний вплив не тільки на людей, які страждають від цієї патології, але і на осіб, які здійснюють догляд за ними, на сім’ї і суспільство в цілому [3]. За даними експертів ВООЗ, витрати на догляд за хворими на деменцію у 2019 році досягли 1,3 трлн доларів. Прогнозується, що до 2050 року вони становитимуть 2,8 трлн доларів на рік [10].
Дефініція деменції та її критерії
Деменція — синдром, що характеризується набутим, часто прогресуючим зниженням КФ (сприйняття, пам’ять, психомоторна функція, мовлення, увага, керуючі функції, соціальний інтелект), що виникає у результаті органічних уражень головного мозку й призводить до порушення соціальної адаптації пацієнта, тобто робить його нездатним до продовження професійної діяльності і/або порушує його побутову незалежність, обмежуючи можливості самообслуговування [4, 5].
Для діагностики деменції використовуються діагностичні критерії МКХ-11 [6]:
— порушення пам’яті — нездатність до запам’ято-вування нового матеріалу, у більш тяжких випадках — утруднення здатності до відтворення раніше засвоєної інформації;
— порушення виконавчих функцій, уваги, мовлення, соціального пізнання і судження, психомоторної швидкості, зорово-перцептивних або зорово-просторових здібностей;
— відсутність затьмарення свідомості, делірію;
— тривалість симптомів не менше ніж 6 місяців.
Згідно з DSM-V (Diagnostic and Statistical Manual of mental disorders), термін «деменція» замінений на «малий нейрокогнітивний розлад» (МНКР) і «великий нейрокогнітивний розлад» (ВНКР). Для МНКР характерні такі критерії:
— когнітивний дефіцит (КД) не порушує незалежність у повсякденному житті, порушуються пристосувальні стратегії;
— КД відхиляється від норми на 1–2 стандартних відхилення (standard deviation, SD).
Для ВНКР:
— КД порушує незалежність у повсякденному житті (потрібна хоча б мінімальна допомога);
— КД відхиляється від норми більше ніж на 2–3 SD.
Причому пам’ять не є облігатним доменом нейрокогнітивних розладів.
Деменцію діагностують при порушенні пам’яті в поєднанні щонайменше з двома із таких розладів: афазія, апраксія, агнозія і порушення регуляторних функцій, що призводять до функціонального дефекту [7]. Останніми роками ці діагностичні критерії нерідко піддаються критиці через виділення порушень пам’яті як самостійного і облігатного діагностичного критерію деменції. Тоді як при деяких варіантах судинної деменції мнестичні порушення виражені незначно або навіть відсутні [1, 5]. Особливо слід зазначити, що найважливішим критерієм діагностики деменції є дезадаптація у повсякденному житті [1, 5].
Класифікація деменцій
Деменції класифікують за декількома категоріями, а саме: за функціональним статусом, переважною локалізацією ураження (синдромальна класифікація) і нозологією.
За функціональним статусом виділяють чотири основні ступені тяжкості деменції:
— легка, при якій втрачається працездатність і частково здатність до виконання більш складних, інструментальних дій, але при цьому в побуті пацієнт загалом може себе обслуговувати і має потребу лише в епізодичній допомозі;
— середньої тяжкості, при якій втрачається здатність як до інструментальної, так і до неінструментальної повсякденної активності, результатом чого є часткова втрата побутової незалежності, і пацієнт потребує хоч і дещо обмеженої, проте регулярної (часто щоденної) допомоги;
— тяжка, при якій пацієнт не здатний обслуговувати себе й потребує постійного догляду;
— украй тяжка, для якої характерними є втрата мовленнєвого контакту і здатності самостійно пересуватися [6].
За синдромальною класифікацією деменції залежно від локалізації ураження умовно поділяються на кіркову, підкіркову й кіркову-підкіркову деменцію. При кірковій деменції страждає переважно кора великих півкуль. Вона спостерігається при хворобі Альцгеймера (ХА) і хворобі Піка (лобно-скроневій деменції), інфаркті кутової звивини. Підкіркові структури вражаються при підкірковій деменції, що характерна для хвороби Паркінсона, хвороби Гентінгтона, судинної патології. Кірково-підкіркова деменція — це деменція з тільцями Леві (ДТЛ), мультиінфарктна деменція [6].
За нозологією деменція поділяється на необоротну й оборотну, необоротна буває первинною (хвороба Альцгеймера, хвороба Піка (лобно-скронева деменція), деменція з тільцями Леві, хвороба Гентінгтона) і вторинною неінфекційною (судинна деменція) та інфекційною (нейросифіліс, СНІД-деменція, хронічний менінгіт, хвороба Крейтцфельдта — Якоба). Оборотна деменція може бути метаболічною (дефіцит вітаміну В12, захворювання щитоподібної залози, гіпонатріємія, гіперкальціємія, печінкова, ниркова недостатність, депресія, гідроцефалія нормального тиску) і токсичною (алкоголь, ліки) [10].
Безумовними лідерами серед причин деменції є хвороба Альцгеймера (25–50 %), цереброваскулярні захворювання (судинна деменція — 10–15 %), змішана деменція (хвороба Альцгеймера в поєднанні з цереброваскулярними розладами — 10–25 %) і деменція з тельцями Леві (5–15 %) [12].
До факторів ризику розвитку деменції належать: відсутність фізичного навантаження, низький рівень освіти, алкоголізм, паління, діабет, надлишкова вага, артеріальна гіпертензія, депресія [13].
Від патогенезу до патогенетичного лікування деменцій
Відомо, що провідним нейрохімічним механізмом розвитку деменцій (ХА, а також змішані нейродегенеративно-судинні форми) є виражена дегенерація холінергічних нейронів і, відповідно, значне зниження рівня ацетилхоліну в корі й підкіркових структурах [14], що є потужним фактором накопичення в головному мозку патологічного білка — бета-амілоїду у вигляді сенільних бляшок — одного з головних нейроморфологічних субстратів ХА. Сьогодні чітко показано, що вираженість холінергічного дефіциту безпосередньо корелює з вираженістю когнітивного дефіциту й психопатологічної симптоматики [15] і проявляється при всіх нозологічних формах деменцій. При цьому власне когнітивні порушення визначаються переважно недостатністю ацетилхоліну в корі, а поведінкові, афективні й психотичні реакції — дефіцитом холінергічних впливів у лімбічній системі [16]. Саме холінергічна недостатність є пусковим механізмом нейромедіаторного дисбалансу в ЦНС і вторинного залучення моноамінергічних, глутаматергічних і пептидергічних систем у патологічний процес при деменціях [17].
Разом з тим відомо, що ослаблення холінергічних процесів у мозку є одним з найбільш характерних феноменів старіння мозку, що створює той фундамент, на якому розвиваються як власне вікове зниження когнітивних функцій, так і дементні порушення [18, 19]. Тому холінергічна фармакотерапія сьогодні може розглядатися як реально обґрунтований патогенетичний вплив на механізми розвитку всіх форм деменцій незалежно від їх нозологічної приналежності, клінічної симптоматики й тяжкості перебігу патологічного процесу.
Одним з основних шляхів компенсації холінергічної дисфункції є використання інгібіторів ацетилхолінестерази (АХЕ). У даний час інгібітори АХЕ розглядаються як препарати першої лінії терапії ХА [20].
Клінічні дослідження інгібіторів АХЕ другого покоління (донепезил, ривастигмін, галантамін) показали, що вони є більш сприятливими як щодо клінічної ефективності, так і щодо переносимості порівняно з інгібіторами АХЕ першого покоління [22]. Вони підвищують рівень ацетилхоліну в базальних відділах і кіркових частинах головного мозку, що призводить до зменшення когнітивних розладів, поліпшення пам’яті, уваги й інтелектуальних операцій, нормалізації поведінки, регресу психічних розладів, зменшення вираженості розладів циклу «сон — неспання» і підвищення рівня повсякденної активності.
Порівняльна оцінка донепезилу з таким центральним інгібітором ацетилхолінестерази, як галантамін, проведена в 14 європейських центрах [42], показала більш високу ефективність донепезилу, при тому що він викликав побічні реакції у 2 рази рідше. Порівняння донепезилу з ривастигміном показало, що при практично однаковій клінічній ефективності (вірогідних відмінностей між групами хворих, які отримували ці препарати, за шкалами ADAS-Cog і MMSE виявлено не було) на тлі терапії донепезилом побічні реакції виникають у 2 рази рідше [43]. При цьому максимально переносимої дози препарату, яка визначає кращий ефект, вдалося досягти у 87,5 % хворих, які отримували донепезил, і лише в 47,3 % пацієнтів, які отримували ривастигмін [43].
Донепезил — високоспецифічний оборотний інгібітор центральної АХЕ, схвалений FDA для лікування легкої та помірної форм деменції
Донепезил — найбільш часто використовуваний препарат з групи інгібіторів холінестерази, який зареєстрований більше ніж у 100 країнах світу. Його розробка була розпочата в 1983 р. японською фармацевтичною компанією Eisai. З 1996 р. донепезил схвалений FDA для лікування хвороби Альцгеймера, з 1997 р. він почав застосовуватись і в Європі. У більшості країн його схвалено для лікування легкої/помірної деменції при ХА [25]. У США, Канаді Японії — для лікування легкої/помірної/тяжкої деменції при ХА [26].
З 2018 року FDA рекомендує використання донепезилу для лікування симптомів легкої, помірної і тяжкої форм ХА, застосування комбінації донепезилу і мемантину (антагоніст NMDA-рецепторів) — у терапії помірної і тяжкої форм деменції.
В уніфікованому клінічному протоколі медичної допомоги (МОЗ України, 2016) інгібітори АХЕ рекомендовані для лікування легкої і помірної форм деменції альцгеймерівського типу, мемантин — при помірній формі деменції альцгеймерівського типу, коли є непереносимість інгібіторів АХЕ або протипоказання до їх застосування, тяжких формах деменції альцгеймерівського типу і при поведінкових порушеннях при деменції альцгеймерівського типу, зокрема агресії/ажитації [24].
Також є достатньо підстав для застосування донепезилу і при інших захворюваннях, що перебігають з розвитком деменції. Так, показана його ефективність при хворобі тілець Леві [27, 28], черепно-мозковій травмі [29], судинній деменції [30] і хворобі Паркінсона з деменцією [31].
Донепезил — похідне піперидину — є високоспецифічним оборотним інгібітором центральної АХЕ. Донепезил переважно інгібує ацетилхолінестеразу, а не бутирилхолінестеразу, що пояснює його кращу переносимість порівняно з іншими інгібіторами ацетилхолінестерази, має більш значну селективність дії щодо ацетилхолінестерази [32, 33]. При використанні донепезилу рівень екстрацелюлярного ацетилхоліну в гіпокампі й корі головного мозку підвищується, збільшуються рівні екстрацелюлярного норадреналіну і дофаміну, що покращує когнітивні функції і увагу [32].
За деякими експериментальними даними, додатковим механізмом дії донепезилу може бути його здатність підвищувати щільність Н-холінорецепторів у корі головного мозку [20]. Останнє видається досить важливим, оскільки при ХА відзначається зменшення числа постсинаптичних Н-холінергічних рецепторів, з дисфункцією яких певною мірою пов’язують порушення пам’яті та зниження здатності до навчання. Це зменшення кількості Н-холінергічних рецепторів при ХА виникає вже на початкових стадіях захворювання, найбільш значно — у скроневих і лобових відділах головного мозку. Дія на пресинаптичні Н-холінергічні рецептори приводить до активації інших нейромедіаторних систем, дефіцит яких спостерігається при цьому захворюванні, а також зменшує токсичну дію бета-амілоїду на нейрони [34].
Препарат має високу біодоступність (100 %). Пік його концентрації в плазмі крові настає через 3–4 години після перорального прийому. Період напіввиведення становить близько 70 годин, що дозволяє призначати препарат один раз на добу на ніч [35]. Це дуже важливо, оскільки пацієнти з деменцією нерідко не тільки забувають вчасно прийняти призначений препарат або зовсім пропускають його прийом, але й можуть прийняти більшу, ніж призначено лікарем, дозу, що загрожує виникненням виражених побічних ефектів. Так, частота порушень режиму прийому лікарських препаратів у пацієнтів з ХА при прогресуванні захворювання зростає, досягаючи 75 %. Однак спрощення режиму прийому, зокрема призначення одноразового прийому препарату замість дворазового, знижує цей показник на 10–20 %.
Донепезил має порівняно невелику активність щодо периферичної АХЕ і, як правило, добре переноситься. Рекомендована доза для донепезилу становить 5 мг/добу протягом 4 тижнів, а потім підвищується до 10 мг/добу. Абсорбція препарату не залежить від прийому їжі. Донепезил виводиться нирками в незмінному вигляді й метаболізується цитохромом Р450 у печінці. Через відсутність гепатотоксичності застосування препарату не вимагає проведення в процесі терапії досліджень функцій печінки [23]. Мінімальна тривалість терапії становить 3 місяці, максимальна, у разі доброї переносимості, не обмежена і триває, поки зберігається клінічний ефект. Він настає при інгібуванні ацетилхолінестерази (зазвичай її рівень вимірюють в еритроцитах — як сурогатний маркер) на 60 % і більше і досягає плато при інгібуванні на 80–90 % [33]. Середня активність ацетилхолінестерази при використанні донепезилу в дозі 5 мг на добу становить 63,7 % [33].
У кокрейнівському огляді порівнювали переносимість плацебо і донепезилу у 12 дослідженнях за участю 2846 пацієнтів. Було встановлено, що учасники, які отримували донепезил, частіше виходили з досліджень до закінчення лікування порівняно з плацебо — 24 та 20 % відповідно. У другому огляді, який включав 195 200 пацієнтів, було виявлено, що пацієнти із групи донепезилу частіше відчували побічну дію під час досліджень порівняно з плацебо (72 проти 65 %).
Найпоширеніші побічні реакції, що призводили до припинення лікування, були визначені як такі, що виникали у принаймні 2 % пацієнтів і вдвічі або частіше, ніж у пацієнтів, які приймали плацебо. Серед них найчастіше виникали нудота, діарея та блювання при використанні донепезилу у дозі 10 мг/добу (3, 3, 2 % відповідно).
У відкритому дослідженні, яке тривало 15–30 тижнів, такі побічні реакції, як нудота, діарея, безсоння, втома, блювання, м’язові судоми та анорексія, також найчастіше виникали у групі донепезилу 10 мг/добу (> 5 % порівняно з плацебо). При титруванні дози 10 мг/добу протягом 6 тижнів побічні реакції були на рівні таких у пацієнтів, які отримували 5 мг/добу.
Ефективність і безпека донепезилу для лікування легкої/помірної форми хвороби Альцгеймера
У даний час застосування донепезилу розглядається як один з провідних методів терапії ХА (препарат першої лінії) [20, 36]. Його ефективність і безпека доведені результатами численних клінічних досліджень.
У багатоцентровому подвійному сліпому плацебо-контрольованому дослідженні S. Rogers et al., що проводилося протягом 24 тижнів, взяли участь близько 900 пацієнтів з легкою/помірною ХА, які приймали донепезил або плацебо [37]. Оцінка когнітивних функцій проводилась за допомогою шкали ADAS-Cog.
Результати дослідження показали, що застосування донепезилу вірогідно покращує когнітивні функції хворих. Протягом лікування стан більшості (80 %) пацієнтів, які отримували донепезил, покращився або залишився на початковому рівні. Аналогічний терапевтичний ефект мав місце тільки для 30 % хворих конт-рольної групи, які отримували плацебо. Була встановлена більш висока ефективність дозування 10 мг/добу препарату порівняно з 5 мг/добу. Дослідники відзначили, що позитивний ефект препарату порівняно з плацебо зберігався протягом 6 тижнів після завершення прийому донепезилу.
В. Winblad et al. [39] оцінювали довгострокову клінічну ефективність і безпеку донепезилу порівняно з плацебо протягом 1 року у 286 пацієнтів з ХА легкого і середнього ступеня тяжкості. Хворі з можливою або ймовірною ХА в п’яти країнах північної Європи отримували донепезил (5 мг/день протягом 28 днів, потім 10 мг/день) або плацебо. Дослідження завершили 66,9 % пацієнтів, які отримували донепезил, і 67,4 % пацієнтів, які отримували плацебо. При оцінці симптомів деменції за шкалою GBS на 24, 36 і 52-му тижні була продемонстрована перевага донепезилу порівняно з плацебо. Також користь донепезилу спостерігалася в когнітивній і повсякденній діяльності (ADL).
К. Rockwood et al. [9] виконали мультицентрове 52-тижневе відкрите дослідження у хворих з легкою/помірною стадією ХА. При цьому вдалося визначити актуальні мішені позитивної терапевтичної дії донепезилу залежно від оцінки, даної лікарем або опікуном хворого. За оцінкою клініциста терапевтичними мішенями донепезилу є: когнітивні функції (85 % усіх хворих); функціональні можливості пацієнтів (68 %); порушення поведінки (57 %); соціальна взаємодія (52 %); дозвілля (20 %).
Доглядачі також оцінили терапевтичні мішені донепезилу: функціональну активність (86 %); пізнавальні функції (83 %); дозвілля (76 %); поведінку (57 %); соціальну взаємодію (49 %).
В огляді J.S. Birks [38], у який були включені 16 досліджень і 4365 пацієнтів з легкою/помірною ХА, оцінювалися когнітивні функції і загальний клінічний стан пацієнтів при використанні донепезилу або плацебо. Через 24 тижні спостерігалося статистично значуще поліпшення когнітивних функцій як для 5 мг, так і для 10 мг донепезилу порівняно з плацебо (за шкалою ADAS-Cog –2,02 і –2,92 бала відповідно). Крім того, за оцінкою лікаря, у групах донепезилу 5 мг і 10 мг відзначалося деяке поліпшення загального клінічного стану порівняно з плацебо через 12 і 24 тижні. Користь від лікування донепезилом також була помічена щодо показників повсякденної активності й поведінки.
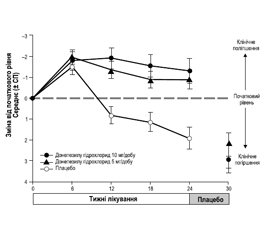
У дослідженні, яке тривало 30 тижнів, взяли участь 473 пацієнти з легкою/помірною ХА. Усі вони були розподілені на 3 групи: 1-ша група приймала 24 тижні донепезил 5 мг, 6 тижнів — плацебо; 2-га — 4 тижні донепезил 5 мг, 20 тижнів — донепезил 10 мг, 6 тижнів — плацебо; 3-тя — 30 тижнів плацебо. Після 24 тижнів лікування за когнітивною шкалою оцінки ADAS-Cog середні відмінності в показниках змін становили: –2,8 бала для донепезилу 5 мг/день і плацебо і –3,1 бала для донепезилу 10 мг/день і плацебо. Через 6 тижнів на плацебо пацієнти, які були на донепезилі, не відрізнялися від тих, які отримували лише плацебо протягом 30 тижнів (рис. 1).
За 24 тижні лікування за шкалою загального враження від змін CIBIC+ середня різниця балів донепезил/плацебо становила: 0,35 од. для донепезилу 5 мг/день і плацебо і 0,39 од. для донепезилу 10 мг/день і плацебо. Відмінності були статистично значущими (рис. 2).
У другому дослідженні за участю 365 пацієнтів з легкою/помірною ХА тривалістю 6 місяців проводився аналіз ефективності лікування донепезилом 5 і 10 мг/добу [40]. Оцінка результатів здійснювалася шляхом об’єднання 3 критеріїв: за шкалою ADAS-Сog (показник когнітивної функції), шкалою для оцінки стану пацієнта лікарем або особами, які доглядають за пацієнтом (шкала CIBIC+, показник загальної функції), підшкалою для оцінки повсякденної активності при клінічних ознаках деменції (ADCS-ADL-sev). Визначався показник здатності виконувати суспільні справи, домашню роботу, улюблені справи й обслуговувати себе. Було показано, що залежно від дози донепезил спричиняв статистично вірогідне збільшення відносної кількості пацієнтів, у яких виникала реакція на лікування.
/36_2.jpg)
Метою аналізу, проведеного вченими Великої Британії та опублікованого у 2018 році в Кокрейнівській базі даних систематичних оглядів, була оцінка клінічної ефективності й безпеки донепезилу в людей з легкою, помірною або тяжкою деменцією при хворобі Альцгеймера, а також порівняння ефективності й безпеки різних доз цього лікарського засобу для формування оптимальних клінічних рекомендацій [41].
У цей огляд були включені тільки рандомізовані подвійні сліпі плацебо-контрольовані дослідження, у яких лікування різними дозами донепезилу здійснювалося в людей з легкою, помірною або тяжкою деменцією через хворобу Альцгеймера протягом 12 тижнів або більше.
Тридцять досліджень за участю 8257 пацієнтів відповідали критеріям включення в огляд. Учасники 21 дослідження мали легкий і помірний ступінь деменції, 5 — середній і тяжкий, 4 — тяжкий ступінь.
Метааналіз виявив переваги щодо когнітивної функції, виміряної за допомогою шкали оцінки когнітивних функцій при хворобі Альцгеймера ADAS-Cog, при застосуванні більш високої дози донепезилу порівняно з плацебо протягом 12 і 24 тижнів терапії. Коротка оцінка когнітивних функцій за шкалою MMSE показала подібні результати на користь донепезилу в більш високому дозуванні порівняно з плацебо протягом 12, 24–26 і 52 тижнів терапії, а також донепезилу в дозі 5 мг/добу протягом 24 тижнів. Крім того, метааналіз виявив користь щодо когнітивної функції, яка була виміряна за допомогою шкали оцінки когнітивних функцій при тяжкій деменції — SIB, завдяки прийому донепезилу в низькій і більш високій дозі протягом 24 тижнів.
Виявлено одне дослідження для оцінки діяльності в повсякденному житті з використанням шкали оцінки прогресуючого погіршення PDS. Доза 10 мг/добу донепезилу показала перевагу порівняно з плацебо протягом 52 тижнів терапії (MD 3,80; 95% довірчий інтервал 1,70–5,90; p = 0,0004; 1 дослідження, 276 учасників).
У двох інших дослідженнях активність у повсякденному житті оцінювалася з використанням шкали оцінки непрацездатності при деменції DAD і шкали інструментальної активності в повсякденному житті/шкали оцінки здатності до самообслуговування IADL. Виявлено докази користі 10 мг/добу донепезилу протягом 24 тижнів.
Не було виявлено відмінностей між донепезилом і плацебо щодо поведінкових симптомів і якості життя, виміряних за таками шкалами:
— нейропсихіатричний огляд (NPI). Середня відмінність MD –1,62 (95% ДІ від –3,43 до 0,19; 1035 учасників, 4 дослідження);
— шкала поведінки при ХА (BEHAVE-AD). Середня відмінність MD 0,4 (95% ДІ від –1,28 до 2,08; 194 учасники, 1 дослідження);
— шкала оцінки якості життя (QoL). Середня відмінність MD –2,79 (95% ДІ від –8,15 до 2,56; 815 учасників, 2 дослідження).
Донепезил мав низьку частоту розвитку серйозних побічних ефектів. У дослідженнях повідомлялося про виникнення 53 різних побічних ефектів, включно з нудотою, блюванням і діарею. Їх поява була пов’язана із застосуванням дози донепезилу 10 мг/добу порівняно з 5 мг/добу або плацебо. Метааналіз випадків летальності не показав різниці між групами, які приймали донепезил 5 мг/добу і плацебо, 10 мг/добу і плацебо протягом 12, 24–26 і 52 тижнів.
Отже, пацієнти з легкою/помірною ХА, які прий-мали донепезил у дозі 10 мг/день протягом 6 місяців, почувалися краще, ніж особи, які приймали плацебо, за параметрами когнітивного функціонування — мислення й запам’ятовування, керування щоденною діяльністю за загальним враженням підготовленого доглядача.
Дослідження комбінованого застосування препаратів донепезил + мемантин
Деякі прохолінергічні побічні ефекти інгібіторів холінестерази можуть бути зменшені при одночасному застосуванні мемантину. Мемантин як неконкурентний низькоафінний антагоніст глутаматних NMDA-рецепторів рекомендований при деменції [51]. Його механізм дії може бути пов’язаний із модулюванням глутаматергічної передачі, що опосередковує кортикальні й кортико-субкортикальні взаємозв’язки в головному мозку.
Додавання мемантину до раніше призначеного донепезилу підвищує ефективність терапії і є безпечним для пацієнтів з ХА. Це показано у 24-тижневому плацебо-контрольованому дослідженні, яке було проведено D. Weycker et al. [53]. У дослідження були включені 404 пацієнти з помірною і тяжкою стадією ХА, яким до стабільно призначеного донепезилу додавали мемантин у дозі 20 мг на добу. При переведенні на комбіновану терапію відзначено поліпшення в когнітивній, функціональній, поведінковій сферах, а також поліпшення за загальною шкалою клінічного враження [53].
C.H. van Dyck et al. [52] опублікували дані рандомізованого клінічного дослідження, яке продемонструвало безпеку, добру переносимість та ефективність комбінованої терапії при помірній і тяжкій ХА, при якій пацієнти отримували стабільні дози донепезилу протягом двох років, продовжували терапію донепезилом і згодом були рандомізовані для отримання (після титрування) мемантину 10 мг двічі на день або плацебо [52]. Комбінована терапія була пов’язана зі значно кращими результатами щодо показників когнітивних функцій порівняно з прийманням плацебо, вищою частотою завершення дослідження і кращою переносимістю лікування.
Дослідження A. Atri et al. [54] об’єднало дані 1408 пацієнтів із середньою і тяжкою формою ХА, включених до чотирьох шестимісячних рандомізованих досліджень монотерапії мемантином (n = 570) і додаткової терапії (підгрупа донепезилу: n = 847). Зміни площі під кривою (ППК) за показниками когнітивних функцій (SIB), функціональності (ADCS-ADL19), поведінки (NPI), загального стану (CIBIC+) і зведеного індексу (4D-CI: усі чотири показники рівнозважені) були розраховані з використанням правила трапеції і оцінені за допомогою коваріантного аналізу (ANCOVA) (двосторонній рівень значущості = 0,05). Результати аналізу ППК порівнювалися зі змінами показників «від візиту до візиту» щодо вихідного рівня з використанням змішаної моделі повторних вимірювань (MMRM).
Шість місяців монотерапії плацебо супроводжувалися значним кумулятивним погіршенням усіх результатів. Комбінація мемантин + донепезил показала статистично більш значуще поліпшення ППК за критеріями SIB, NPI і CIBIC+ порівняно з поєднанням плацебо + донепезил (SIB: 68,4 проти 32,0; P = 0,019; NPI: –74,3 проти –28,2; P = 0,003; CIBIC+: –2,5 проти 1,4; P = 0,006) і монотерапією мемантином (SIB: 68,4 проти 12,0; p < 0,001; NPI: –74,3 проти –7,4; P < 0,001; CIBIC+: –2,5 проти 2,7; P < 0,001). Різниця за критерієм ADCS-ADL19 була статистично незначущою: мемантин + донепезил (1,4) проти плацебо + донепезил (–0,9); p = 0,407; проти монотерапії мемантином (–12,2), p = 0,310. Аналіз зведеного індексу продемонстрував значні кумулятивні переваги комбінації мемантин + донепезил (630,0) перед поєднанням плацебо + донепезил (344,7; p < 0,001) і монотерапією мемантином (152,1; p < 0,001). Комбінація мемантину й донепезилу мала адитивний ефект.
Цей великий об’єднаний аналіз площі під кривою, проведений з використанням даних рандомізованих досліджень ХА середнього і тяжкого ступеня, забезпечує вірогідне підтвердження доброго сумарного клінічного ефекту при додаванні мемантину до постійного прийому донепезилу. Ефект є адитивним і, на відміну від ефекту монотерапії, продовжує накопичуватися протягом шести місяців лікування, а його вираженість як мінімум на 50 % вище, ніж у монотерапії. Крім того, було показано, що додавання мемантину в схему лікування пацієнтів, які приймають донепезил, є безпечним, комбінація препаратів добре переноситься.
Місце донепезилу в лікуванні судинної деменції
У даний час показано, що донепезил ефективний не тільки при ХА, але й при судинній деменції [46]. На користь концепції ацетилхолінергічного дефекту при судинній деменції свідчать не тільки клінічні, але й експериментальні й патоморфологічні дані [45]. У спеціально виведеної лінії щурів зі спадковою схильністю до артеріальної гіпертензії та інсультів (експериментальна модель судинної деменції) виявляється значне зменшення ацетилхоліну і холіну в корі головного мозку, гіпокампі й цереброспінальній рідині [45]. За даними автопсії, у пацієнтів із судинною деменцією спостерігається ацетилхолінергічний дефіцит у корі, гіпокампі й стріатумі, а також зниження концентрації ацетилхоліну при посмертному дослідженні церебро-спінальної рідини [45]. Крім того, підкіркові судинні вогнища можуть призводити до центрального ацетилхолінергічного дефекту навіть у разі відсутності супутніх альцгеймерівських змін. Центральні холінергічні структури, збереження яких вкрай важливе в здійсненні когнітивних функцій, схильні до ураження в умовах ішемії, при цьому атрофія гіпокампа може виявлятися в пацієнтів із судинною деменцією навіть за відсутності супутньої ХА [45].
D. Goldsmith і L. Scott [46] вважають доцільним призначення донепезилу при судинній деменції. Наявні дані свідчать про поліпшення стану хворих порівняно з прийомом плацебо, при цьому дозування 5 і 10 мг на добу добре переносяться хворими [47]. Це поліпшення було відзначено D. Wilhineson і співавт. [40] як на когнітивних тестах (MMSE, ADAS-Cog), так і за шкалами загального враження про динаміку стану хворого (CIBIC+). Важливо підкреслити, що у включених в це дослідження хворих були переконливі ознаки судинного, а не первинно-дегенеративного (альцгеймерівского) ураження головного мозку (наявність вираженого системного атеросклерозу, артеріальна гіпертензія, гіперхолестеринемія, вказівка на гостре порушення мозкового кровообігу в анамнезі, високий бал за модифікованою шкалою Хачинського, раптовий початок захворювання і його ступінчасте прогресування).
За даними кокрейнівського огляду [48], який ґрунтувався на результатах застосування донепезилу протягом 24 тижнів у дозах від 5 до 10 мг на добу порівняно з плацебо, у 1219 хворих з можливою або ймовірною судинною деменцією на тлі терапії цим препаратом відзначені кращі результати в когнітивній сфері за шкалами ADAS-Cog і MMSE. При цьому використання більш високих доз донепезилу приводило до більш значного поліпшення за шкалою CDR (Clinical Dementia Rating), а також збільшення активності хворих у повсякденному житті.
Ефективність донепезилу в лікуванні деменції з тільцями Леві
Фармакотерапія деменції з тільцями Леві є однією з найскладніших проблем, що обумовлено поєднанням когнітивних, психоневрологічних, вегетативних і моторних порушень.
У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні E. Mori et al. [50] взяли участь 140 пацієнтів з ДТЛ із 48 спеціалізованих центрів у Японії. Усі вони були рандомізовані для отримання плацебо або 5/10 мг донепезилу щодня протягом 12 тижнів. Вплив на когнітивні функції оцінювали за допомогою обстеження психічного стану (MMSE), зміни в поведінці — за допомогою шкали NPI, навантаження на вихователів — за допомогою інтерв’ю (Zarit Caregiver Burden).
Донепезил у дозах 5 і 10 мг/добу значно перевершував плацебо за обома показниками MMSE (5 мг: середня різниця 3,8; 95% ДІ 2,3–5,3; р < 0,001; 10 мг: середня різниця 2,4; 95% ДІ 0,9–3,9; р = 0,001). Також відзначалося поліпшення в поведінкових показниках (р < 0,001) при прийомі 5 і 10 мг/добу і навантаженні на осіб, які здійснюють догляд (р = 0,004), при прийомі 10 мг/добу.
Довгострокова ефективність і безпека 10 мг донепезилу в пацієнтів з деменцією тілець Леві була підтверджена у 52-тижневому дослідженні ІІІ фази [49]. Воно складалося з 16-тижневого рандомізованого плацебо-контрольованого і 36-тижневого відкритого розширеного дослідження. З 142 пацієнтів з ДТЛ, включених у фазу рандомізованого контрольованого дослідження (три групи: плацебо, 5 і 10 мг), 110 перей-шли до відкритого етапу. Група плацебо фази рандомізованого контрольованого дослідження розпочала активне лікування на 16-му тижні, а активні групи підтримували призначене лікування й дози до 24-го тижня. Через 24 тижні всі пацієнти отримували 10 мг донепезилу. Оцінювався психічний стан (MMSE) для визначення когнітивних функцій і поведінкові симптоми (NPI) пацієнтів. Оцінка безпеки включала реєстрацію небажаних явищ (НЯ).
Дослідження завершили 100 осіб. Поліпшення когнітивних функцій зберігалося протягом 52 тижнів (MMSE на 52-му тижні в дозі 10 мг: 2,8 ± 3,5 (середнє ± стандартне відхилення); P < 0,001; парний t-критерій Стьюдента). У тих, хто отримував плацебо на етапі рандомізованого контрольованого дослідження, після початку активного лікування спостерігалося поліпшення. NPI покращувався в усіх групах протягом усього дослідження, включно з періодом плацебо. У групі, яка приймала 5 мг, без помітного поліпшення когнітивних або поведінкових функцій на 24-му тижні, подальше поліпшення спостерігалося після збільшення дози до 10 мг. Частота будь-яких НЯ не збільшувалася з плином часу.
Отже, результати рандомізованих клінічних досліджень, що були присвячені донепезилу, підтверджують його сприятливий вплив на когнітивні функції при деменції з тільцями Леві.
Дисперговані таблетки донепезилу в Україні
В Україні доступні дисперговані таблетки донепезилу, що розпадаються в ротовій порожнині, або таблетки для розсмоктування. Ця лікарська форма доступна для обмеженого діапазону медичних препаратів. Форма відрізняється від традиційних таблеток, оскільки розроблена для розсмоктування на язику. Переваги диспергованих таблеток донепезилу безсумнівні: їх легко вживати, тому вони зручні у використанні в педіатрії, геріатрії та психіатрії; вони зручні у використанні для пацієнтів похилого віку, після перенесеного інсульту, прикутих до ліжка, з нирковою недостатністю, пацієнтів, які відмовляються ковтати чи мають дисфагію — проблеми з ковтанням; мають підвищену біодоступність, що гарантує швидше всмоктування, а завдяки всмоктуванню до потрапляння в шлунок дія препарату наступає швидше; не потребують води, що може краще підходити для людей з обмеженими можливостями, прикутих до ліжка; можливість застосування у випадках, де є питання із згодою на лікування, тому форма з більшою біодоступністю краще гарантує, що препарат буде вжито.
Висновки
— Деменція є однією з основних причин інвалідності й залежності серед людей похилого віку в усьому світі. Вона справляє фізичний, психологічний, соціальний та економічний вплив не тільки на людей, які страждають від цієї патології, але й на людей, які здійснюють догляд за ними, на сім’ї і суспільство в цілому.
— Одним з основних шляхів компенсації холінергічної дисфункції при деменції є використання інгібіторів ацетилхолінестерази. У даний час інгібітори АХЕ розглядаються як препарати першої лінії терапії ХА. Найбільш часто використовуваний препарат із групи інгібіторів холінестерази — донепезил, який зареєстрований більше ніж у 100 країнах світу. FDA рекомендує використання донепезилу для лікування симптомів легкої і помірної форм ХА.
— Донепезил переважно інгібує ацетилхолінестеразу, а не бутирилхолінестеразу, що пояснює його кращу переносимість порівняно з іншими інгібіторами ацетилхолінестерази, і має більш значну селективність дії щодо ацетилхолінестерази. Додатковим механізмом дії донепезилу може бути його здатність підвищувати щільність Н-холінорецепторів у корі головного мозку, що приводить до активації інших нейромедіаторних систем, дефіцит яких спостерігається при цьому захворюванні, а також зменшує токсичну дію бета-амілоїду на нейрони. Препарат показав свою ефективність як щодо когнітивного функціонування хворих на легку/помірну ХА, так і щодо корекції поведінкових порушень у багатьох рандомізованих дослідженнях, у тому числі в кокрейнівському огляді.
— Додавання мемантину до раніше призначеного донепезилу підвищує ефективність терапії і є безпечним для пацієнтів з помірною/тяжкою ХА. При переведенні на комбіновану терапію відзначено поліпшення в когнітивній, функціональній, поведінковій сферах, а також поліпшення за загальною шкалою клінічного враження.
— Ефективність донепезилу доведена при судинній деменції і деменції з тільцями Леві.
— Препарат донепезилу в Україні — дисперговані таблетки, що розпадаються в ротовій порожнині, або таблетки для розсмоктування. Переваги цієї форми безсумнівні: їх легко вживати, тому вони зручні у використанні в педіатрії, геріатрії та психіатрії; вони зручні у використанні для пацієнтів похилого віку, після перенесеного інсульту, прикутих до ліжка, з нирковою недостатністю, пацієнтів, які відмовляються ковтати чи мають дисфагію — проблеми з ковтанням; мають підвищену біодоступність, що гарантує швидше всмоктування, а завдяки всмоктуванню до потрапляння в шлунок дія препарату настає швидше; не потребують води, що може краще підходити для людей з обмеженими можливостями, прикутих до ліжка; можливість застосування у випадках, де є питання зі згодою на лікування, тому форма з більшою біодоступністю краще гарантує, що препарат буде вжито.
UA-DONE-PUB-042023-005
Список литературы
1. Graham N.L., Emery Т., Hodges J.R. Distinctive cognitive profiles in Alzheimer’s disease and subcortical vascular dementia. J. Neurol. Neurosurg. Psihiatry. 2004. 75(l). 61-71.
2. Diamond P.T. Rehabilitative management of post-stroke visuospatial inattention. Disabil. Rehab. 2001. 23(10). 407-412.
3. Dementia. https://www.who.int/news-room/fact-sheets/detail/dementia.
4. Diagnostic and statistical manual of mental diseases. https://cdn.website-editor.net/30f11123991548a0af708722d458e476/files/uploaded/DSM%2520V.pdf.
5. Копчак О.О. Поведінкові розлади у пацієнтів з деменцією: клініка, діагностика та лікування. Міжнародний неврологічний журнал. 2017. Вип. 8. № 94. С. 44-50.
6. ICD-11. International Statistical Classification of Diseases and Related Health Problems, 10 revision. https://psychiatr.ru/news/181?fbclid=IwAR3wouSX1wMXN6snMhCKdefyGoqZjCsRDMH1SmptjUaF1MW2OHeUeXxsPkI.
7. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, Fourth Edition, Text Revision: DSM–V-TR. Washington, DC: American Psychiatric Publishing, Inc., 2013.
8. Демченко А.В. Сучасні аспекти діагностики та лікування деменції. НейроNEWS. 2020. № 2(112). С. 35-40.
9. Кількість людей з деменцією зростає, але їм приділяється мало уваги. https://news.un.org/ru/story/2021/09/1409232.
10. Lobo A., Launer L., Fratiglioni L. et al. Prevalence of dementia and major subtypes in Europe. Neurology. 2000. 72. 310-314.
11. Слободін Т.М. Деменція: чи готові ми до нової пандемії? Здоров’я України 21 сторіччя. 2021. № 11–12 (504–505).
12. Козьолкін О.А., Ревенько А.В., Мєдвєдкова С.О. Алгоритм діагностики та лікування деменції. Запоріжжя, 2021.
13. Livingston G., Huntley J., Sommerlad A. et al. Dementia prevention, intervention, and care. Lancet. 2020. 396. Aug. 8.
14. Hock C. Biochemical aspects of dementia. Dial. Clin. Neurosci. 2003. Vol. 5. P. 27-34.
15. Davis H.S., Rockwood K. Conceptualization of mild cognitive impairment: a review. Int. J. Geriatr. Psychiat. 2004. Vol. 19. P. 313-319.
16. Grossberg G.T. The ABC of Alzheimer’s disease: behavioural symptoms and their treatment. Int. Psychogeriat. 2002. Vol. 14. Suppl. 1. P. 27-49.
17. Shanks M., Kivipelto M., Bullock R. et al. Cholinesterase inhibition: is their evidence for disease-modifying effects? Curr. Med. Res. Opin. 2009. Vol. 25. P. 2439-2446.
18. Бурчинський С.Г. Вікзалежна патологiя центральної нервової системи: вiд фармакології до фармакотерапії. Рац. фармакотер. 2010. № 2. С. 30-33.
19. Anand A., Patience A.A., Sharma N. et al. The present and future of pharmacotherapy of Alzheimer’s disease: a comprehensive review. Eur. J. Pharmacol. 2017. Vol. 815. P. 364-375.
20. Delrieu J., Piau A., Caillaud C. et al. Managing cognitive dysfunction through the continuum of Alzheimer’s disease. Role of pharmacotherapy. CNS Drugs. 2011. 25. 213-26.
21. Forette F., Boller F. Drug development in Alzheimer’s Disease. In: Gauthier S. (ed). London: Martin Dunitz, 1988. 1-15.
22. Schneider L.S. New therapeutic approaches to Alzheimer’s disease. J. Clin. Psychiatry. 1996. 57 (Suppl. 14). 30-6.
23. Yamanishi Y., Ogura H., Kosasa T. et al. Inhibitory action of E2020, a novel acetylcholinesterase inhibitor, on cholinesterase: comparison with other inhibitors. New York: Plenum Press, 1990. 2. 409-13.
24. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) та паліативної медичної допомоги. Деменція. Затверджено наказом МОЗ України 19.07.2016 № 736.
25. Whitehead A., Perdomo C., Pratt R.D., Birks J., Wilcock G.K., Evans J.G. Donepezil for the symptomatic treatment of patients with mild to moderate Alzheimer’s disease: a meta-analysis of individual patient data from randomised controlled trials. Int. J. Geriatr. Psychiatry. 2004. 19(7). 624-633.
26. Adlimoghaddam A., Neuendorff M., Roy B., Albensi B.C. A review of clinical treatment considerations of donepezil in severe Alzheimer’s disease. CNS Neurosci Ther. 2018. 24(10). 876-888.
27. Barrett M.J., Cloud L.J., Shah H., Holloway K.L. Therapeutic approaches to cholinergic deficiency in Lewy body diseases. Expert Rev. Neurother. 2020. 20(1). 41-53.
28. Tahami Monfared A.A., Meier G., Perry R., Joe D. Burden of Disease and Current Management of Dementia with Lewy Bodies: A Literature Review. Neurol. Ther. 2019. 8(2). 289-305.
29. Ballesteros J., Güemes I., Ibarra N., Quemada J.I. The effectiveness of donepezil for cognitive rehabilitation after traumatic brain injury: a systematic review. J. Head Trauma Rehabil. 2008. 23(3). 171-180.
30. Jin B.R., Liu H.Y. Comparative efficacy and safety of cognitive enhancers for treating vascular cognitive impairment: systematic review and Bayesian network meta-analysis. Neural Regen. Res. 2019. 14(5). 805-816.
31. Meng Y.H., Wang P.P., Song Y.X., Wang J.H. Cholinesterase inhibitors and memantine for Parkinson’s disease dementia and Lewy body dementia: A meta-analysis. Exp. Ther. Med. 2019. 7(3). 1611-1624.
32. Dooley M., Lamb H.M. Donepezil. A review of its use in Alzheimer’s disease. Drugs & Aging. 2000. 16. 199-226.
33. Goldsmith D.R., Scott L.J. Donepezil in vascular dementia. Drugs Aging. 2003. 20. 1127-1136.
34. Bourin M., Ripoll N., Dailly E. Nicotinic receptors and Alzheimer’s disease. Curr. Med. Res. Opin. 2003. 19. 3. 1-9.
35. Orgogozo J.-M. Treatment of Alzheimer’s disease with cholinesterase inhibitors. An update on currently used drugs. In: Alzheimer’s Disease and Related Disorders: Research Advances. Ed. by K. Iqbal, B. Winblad. Bucharest: Ana Aslan, 2003. 663-675.
36. Hort J., O’Brien J.T., Gainotti G. et al. EFNS guidelines for the diagnosis and management of Alzheimer’s disease. Eur. J. Neurol. 2010. 17. 1236-1248.
37. Rogers S.L., Friedhoff L.T., and Donepezil Study Group. The efficacy and safety of donepezil in patients with Alzheimer’s disease: results of a US multicentre, randomized, double-blind, placebo-controlled trial. Dementia. 1996. 7. 293-303.
38. Birks J.S., Harvey R. Donepezil for dementia due to Alzhei-mer’s disease. Cochrane Database Syst. Rev. 2003. 3. CD001190. doі: 10.1002/14651858.CD001190.
39. Winblad B., Egedal K., Soininen H. et al. A 1-year, rando-mized, placebo-controlled study of donepezil in patients with mild to moderate AD. Neurology. 2001. 57. 489-495.
40. Інструкція із застосування препарату Донекс®. https://compendium.com.ua/info/557472/824780.
41. Birks J.S., Harvey R.J. Donepezil for dementia due to Alzheimer’s disease. Cochrane Database Syst. Rev. 2018. 6. CD001190.
42. Jones R.W., Soininen H., Hager K. et al. A multinational, randomised, 12-week study comparing the effects of donepezil and galantamine in patients with mild to moderate Alzheimer’s disease. Int. J. Geriatr Psychiat. 2004. 19. 58-67.
43. Wilkinson D., Passmore A.P., Bullock R. et al. A multinational, randomized, 12-week, comparative study of donepezil and ri-vastigmine in patients with mild to moderate Alzheimer’s disease. Int. J. Clin. Pract. 2002. 56. 441-446.
44. Desmond D.W. Vascular dementia. Clin. Neurosci Res. 2004. 3. 437-448.
45. Erkinjuntti T., Roman G., Gauthier S. et al. Emerging therapies for vascular dementia and vascular cognitive impairment. Stroke. 2004. 35. 1010-1017.
46. Goldsmith D.R., Scott L.J. Donepezil in vascular dementia. Drugs Aging. 2003. 20. 1127-1136.
47. Wilkinson D., Doody R., Helme R. et al. Donepezil in vascular dementia: A randomized, placebo-controlled study. Neurology. 2003. 61. 479-486.
48. Malouf R., Birks J. Donepezil for vascular cognitive impairment. Cochrane Database of Systematic Reviews. 2004. Issue 1. CD004395. DOI: 0.1002/14651858.CD004395.pub2.
49. Mori E., Ikeda M., Nagai R., Matsuo K., Nakagawa M., Kosaka K. Long-term donepezil use for dementia with Lewy bodies: results from an open-label extension of Phase III trial. Alzheimer’s Research & Therapy. 2015. Vol. 7. № 5.
50. Mori Е., Ikeda М., Kosaka К. Donepezil for dementia with Lewy bodies: a randomized, placebo-controlled trial. Ann. Neurol. 2012. 72(1). 41-52.
51. Бачинська Н.Ю., Рожелюк І.Ф., Холін В.О. та ін. Ефективність лікування мемантину гідрохлоридом хворих похилого віку із синдромом деменції. Журнал неврології ім. Б.М. Маньковського. 2015. Вип. 3. № 1. С. 58-64.
52. van Dyck C.H. A 24-week randomized, controlled trial of memantine in patients with moderate-to-severe Alzheimer disease. Alz-heimer Dis. Assoc. Disord. 2007. Vol. 21. P. 136-143.
53. Weycker D.,Taneja C., Edelsberg J. et al. Cost-effectiveness of memantine in moderate-to-severe Alzheimer’s disease patients recei-ving donepezil. Curr. Med. Res. Opin. 2007. 23. 1187-1197.
54. Atri A., Shaughnessy L.W., Locascio J.J., Growdon J.H. Long-term course and effectiveness of combination therapy in Alzheimer disease. Alzheimer Dis. Assoc. Disord. 2008. 22. 209-221.

/36.jpg)
/36_2.jpg)