Архив офтальмологии Украины Том 11, №1, 2023
Вернуться к номеру
Структурні особливості решітчастої пластинки склери як чинник розвитку ретинальної нейродегенерації при цукровому діабеті 2-го типу
Авторы: Карлійчук М.А. (1, 3), Бездітко П.А. (2), Пінчук С.В. (3)
(1) — Буковинський державний медичний університет, м. Чернівці, Україна
(2) — Харківський національний медичний університет, м. Харків, Україна
(3) — Центр мікрохірургії ока «Ваш Зір», м. Чернівці, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
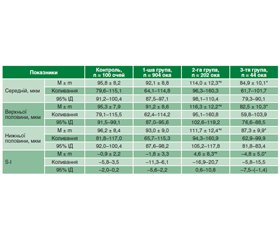
Актуальність. Останніми роками все частіше висувається гіпотеза про те, що ретинальна нейродегенерація виникає до судинних змін, які класично асоціюються з діабетичною ретинопатією, і зумовлює патогенез захворювання. У низці досліджень був встановлений розвиток ранньої нейроретинальної дегенерації при цукровому діабеті (ЦД). Відомо, що структурні зміни решітчастої пластинки склери можуть призвести до деформації пор та безпосереднього пошкодження нервових волокон зорового нерва, які проходять крізь них. Логічно припустити існування взаємозв’язку між структурними властивостями решітчастої пластинки склери у хворих на ЦД 2-го типу та змінами шару перипапілярних нервових волокон і комплексу гангліонарних клітин сітківки (ГКС). Мета дослідження: визначити особливості змін шару перипапілярних нервових волокон та комплексу ГКС у хворих на ЦД 2-го типу залежно від товщини решітчастої пластинки склери. Матеріали та методи. Обстежено 575 хворих на ЦД 2-го типу (1150 очей) та 50 здорових осіб (50 очей) віком 55,9 ± 7,8 року. На додаток до стандартних офтальмологічних методів виконували оптичну когерентну томографію сітківки та зорового нерва. Аналізували середню товщину шару перипапілярних нервових волокон та товщину цього шару у верхній і нижній половинах, а також стан комплексу ГКС: середню товщину, середню товщину у верхньому та нижньому сегментах, показник локального витончення комплексу ГКС (індекс фокальної втрати об’єму Focal loss volume — FLV) та показник загального витончення комплексу ГКС (індекс глобальної втрати об’єму Global loss volume — GLV). Результати. У 1-й групі (78,9 % очей хворих на ЦД) спостерігали незначне потовщення решітчастої пластинки склери (< 700 мкм); у 17,6 % очей (2-га група) — помірне потовщення решітчастої пластинки склери (700–900 мкм) та у 3,8 % очей — значне потовщення решітчастої пластинки склери (> 900 мкм). У хворих на ЦД 2-го типу встановлені томографічні особливості ураження зорового нерва залежно від товщини решітчастої пластинки склери: середня товщина шару перипапілярних волокон сітківки при помірному потовщенні решітчастої пластинки на 38,9 % перевищує, а при значному її потовщенні — на 15,5 % менше відповідних показників здорових осіб відповідного віку. Найменший показник середньої товщини перипапілярних волокон сітківки відмітили у хворих 3-ї групи, який був на 16,3 % менше такого показника у 1-й групі та на 64,3 % — у 2-й групі (р < 0,001). Аналогічна тенденція спостерігалась щодо товщини шару перипапілярних нервових волокон сітківки верхньої та нижньої половин: найменша середня товщина відмічена у хворих 3-ї групи зі значним потовщенням решітчастої пластинки склери. Показник FLV у хворих із середнім та значним потовщенням решітчастої пластинки склери у 13,2 та 16,4 раза відповідно перевищує аналогічний показник здорових осіб відповідного віку; показник GLV у хворих із середнім та значним потовщенням решітчастої пластинки склери у 2,9 та 5,3 раза відповідно перевищує показник здорових осіб відповідного віку. Висновки. У результаті досліджень встановлено потовщення решітчастої пластинки склери у хворих на ЦД 2-го типу порівняно зі здоровими особами. Виявлені морфометричні зміни шару перипапілярних нервових волокон сітківки та комплексу ГКС при ЦД 2-го типу залежать від стану решітчастої пластинки склери, зміни товщини якої можна розглядати як один із патогенетичних чинників розвитку ретинальної нейродегенерації при ЦД 2-го типу.
Background. In recent years, retinal neurodegeneration is being increasingly hypothesized to occur prior to the vascular changes that are classically associated with diabetic retinopathy and contribute to disease pathogenesis. In several studies, the development of early neuroretinal degeneration in diabetes mellitus (DM) has been detected. It is known that structural changes in lamina cribrosa sclerae can lead to deformation of the pores and direct damage to the nerve fibers of the optic nerve that pass through them. It is logical to assume the existence of a relationship between the structural features of the lamina cribrosa sclerae in patients with type 2 diabetes and changes in the layer of peripapillary nerve fibers and the retinal ganglion cell complex (GCC). The purpose was to define the peculiarities of the peripapillary retinal nerve fiber layer and GCC changes in patients with DM depending on the lamina cribrosa sclerae thickness. Materials and methods. Five hundred and seventy-five patients (1,150 eyes) with type 2 diabetes and 50 healthy persons (50 eyes) aged 55.9 ± 7.8 years were examined. In addition to standard ophthalmologic methods, optical coherent tomography of the retina and optic nerve was performed. An average peripapillary retinal nerve fiber layer thickness and thickness of this layer in the superior and inferior hemispheres were analyzed, as well as the state of the retinal GCC: average thickness, average thickness in the upper and lower segments, index of local thinning of the GCC (focal loss volume) and index of general thinning of the GCC (global loss volume). Results. In the group 1 (78.9 % of eyes of DM patients), a mild thickening of lamina cribrosa sclerae (< 700 μm) was observed; in 17.6 % of eyes (group 2), a moderate thickening (700–900 μm), and in 3.8 % of eyes (group 3), a significant thickening (> 900 μm) was detected. In patients with type 2 DM, tomographic features of optic nerve damage were found depending on the thickness of the lamina cribrosa sclerae: the average thickness of the peripapillary retinal fiber layer with moderate thickening of the lamina cribrosa exceeds the corresponding indicators in healthy persons of the corresponding age by 38.9 %, and with its significant thickening, it is by 15.5 % lower. The average retinal peripapillary nerve fiber layer thickness was minimal in patients of the group 3 that was 16.3 % less than the corresponding one in the first group, and 64.3 % less than that of the group 2 (р < 0.001). The similar tendency was observed for the peripapillary retinal nerve fiber thickness of the superior and inferior hemispheres: the minimal average thickness was noted in patients of the group 3 with significant thickening of the lamina cribrosa sclerae. The focal loss volume index in patients with moderate and significant thickening of the lamina cribrosa sclerae is 13.2 and 16.4 times higher, respectively, than the similar indices of healthy individuals of the corresponding age; the global loss volume index in patients with moderate and significant thickening of the lamina cribrosa sclerae is 2.9 and 5.3 times higher, respectively, than the index of healthy individuals of the corresponding age. Conclusions. As a result of the studies, thickening of the lamina cribrosa sclerae was detected in patients with type 2 DM compared to healthy individuals. The detected morphometric changes in the peripapillary retinal nerve fiber layer and retinal GCC in type 2 DM depend on the state of the lamina cribrosa sclerae, changes in the thickness of which can be considered as one of the pathogenetic factors for the development of retinal neurodegeneration in type 2 DM.
решітчаста пластинка склери; шар перипапілярних нервових волокон; комплекс гангліонарних клітин сітківки; цукровий діабет
lamina cribrosa sclerae; peripapillary nerve fiber layer; retinal ganglion cell complex; diabetes mellitus
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Zafar S., Sachdeva M., Frankfort B.J. et al. Retinal Neurodegeneration as an Early Manifestation of Diabetic Eye Disease and Potential Neuroprotective Therapies. Curr. Diab. Rep. 2019. 19. 17. doi.org/10.1007/s11892-019-1134-5.
- Barber A.J. Diabetic retinopathy: recent advances towards understanding neurodegeneration and vision loss. Sci. China Life Sci. 2015. 58(6). 541-549. doi.org/10.1007/s11427-015-4856-x.
- Satue M., Cipres M., Melchor I., Gil-Arribas L., Vilades E., Garcia-Martin E. Ability of Swept source OCT technology to detect neurodegeneration in patients with type 2 diabetes mellitus without diabetic retinopathy. Jpn. J. Ophthalmol. 2020 Jul. 64(4). 367-377. doi: 10.1007/s10384-020-00729-0.
- Ciprés M., Satue M., Melchor I., Gil-Arribas L., Vilades E., Garcia-Martin E. Retinal neurodegeneration in patients with type 2 diabetes mellitus without diabetic retinopathy. Arch. Soc. Esp. Oftalmol. (Engl. Ed). 2022 Apr. 97(4). 205-218. doi: 10.1016/j.oftale.2022.02.009.
- Sachdeva M.M. Retinal Neurodegeneration in Diabetes: an Emerging Concept in Diabetic Retinopathy. Curr. Diab. Rep. 2021. 65. doi.org/10.1007/s11892-021-01428-x.
- Carpineto P., Toto L., Aloia R., Ciciarelli V., Borrelli E., et al. Neuroretinal alterations in the early stages of diabetic retinopathy in patients with type 2 diabetes mellitus. Eye (Lond). 2016 May. 30(5). 673-9. doi.org/10.1038/eye.2016.13.
- El-Fayoumi D., Badr Eldine N.M., Esmael A.F., Ghalwash D., Soliman H.M. Retinal Nerve Fiber Layer and Ganglion Cell Complex Thicknesses Are Reduced in Children with Type 1 Diabetes with No Evidence of Vascular Retinopathy. Invest. Ophthalmol. Vis. Sci. 2016 Oct 1. 57(13). 5355-5360. doi: 10.1167/iovs.16-19988.
- Gundogan F.C., Akay F., Uzun S., Yolcu U., Çağıltay E., Toyran S. Early Neurodegeneration of the Inner Retinal Layers in Type 1 Diabetes Mellitus. Ophthalmologica. 2016. 235(3). 125-32. doi: 10.1159/000442826.
- Chen X., Nie C., Gong Y., Zhang Y., Jin X., Wei S., Zhang M. Peripapillary retinal nerve fiber layer changes in preclinical diabe–tic retinopathy: a meta-analysis. PLoS One. 2015 May 12. 10(5). e0125919. doi: 10.1371/journal.pone.0125919.
- Voorhees A.P., Jan N.J., Sigal I.A. Effects of collagen microstructure and material properties on the deformation of the neural tissues of the lamina cribrosa. Acta Biomater. 2017 Aug. 58. 278-290. doi: 10.1016/j.actbio.2017.05.042.
- Kim J.H., Lee T.Y., Lee J.W., Lee K.W. Comparison of the thickness of the lamina cribrosa and vascular factors in early normal-tension glaucoma with low and high intraocular pressures. Korean J. Ophthalmol. 2014 Dec. 28(6). 473-8. doi: 10.3341/kjo.2014.28.6.473.
- Lapolla A., Fedele D., Reitano R., Bonfante L., Pastori G., et al. Advanced glycation end products/peptides: an in vivo investigation. Ann. NY Acad. Sci. 2005 Jun. 1043. 267-75. doi: 10.1196/annals.1333.032.
- Mabuchi F., Lindsey J.D., Aihara M., Mackey M.R., Weinreb R.N. Optic nerve damage in mice with a targeted type I collagen mutation. Invest. Ophthalmol. Vis. Sci. 2004 Jun. 45(6). 1841-5. doi: 10.1167/iovs.03-1008.
- Spoerl E., Boehm A.G., Pillunat L.E. The influence of va–rious substances on the biomechanical behavior of lamina cribrosa and peripapillary sclera. Invest. Ophthalmol. Vis. Sci. 2005 Apr. 46(4). 1286-90. doi: 10.1167/iovs.04-0978.
- Bezditko P.A., Karliychuk M.A., Lukhanin O.O., Zavoloka O.V. Pecularities of spectral optical coherent tomography using for investigation of the scleral lamina cribrosa thickness and the area of its scleral channel. Kharkiv Surgical School. 2017. № 3–4 (84–85). 63-69.
- Zhang L., Inoue M., Dong K., Yamamoto M. Alterations in retrograde axonal transport in optic nerve of type I and type II diabetic rats. Kobe J. Med. Sci. 1998. 44(5–6). 205-215.
- Van Dijk H.W., Verbraak F.D., Kok P.H., Stehouwer M., Garvin M.K., et al. Early neurodegeneration in the retina of type 2 dia–betic patients. Invest. Ophthalmol. Vis. Sci. 2012. 53 (6). 2715-2719. doi: 10.1167/iovs.11-8997.
- Ng D.S., Chiang P.P., Tan G., Cheung C.G., Cheng C.Y., et al. Retinal ganglion cell neuronal damage in diabetes and diabetic retinopathy. Clin. Exp. Ophthalmol. 2016 May. 44(4). 243-50. doi: 10.1111/ceo.12724.
- Pekel E., Tufaner G., Kaya H., Kaşıkçı A., Deda G., Pekel G. Assessment of optic disc and ganglion cell layer in diabetes mellitus type 2. Medicine (Baltimore). 2017 Jul. 96(29). e7556. doi: 10.1097/MD.0000000000007556.
- Rodrigues E., Müller U., Fernando P., Badaró E., Novais E., Meirelles R., et al. Diabetes induces changes in neuroretina before retinal vessels: a spectral-domain optical coherence tomography study. Int. J. Retina Vitreous. 2015 Apr 15. 1. 4. doi: 10.1186/s40942-015-0001-z.
- Simó R., Stitt A.W., Gardner T.W. Neurodegeneration in diabetic retinopathy: does it really matter? Diabetologia. 2018. 61. 1902-1912. doi.org/10.1007/s00125-018-4692-1.
- Jia X., Zhong Z., Bao T., Wang S., Jiang T. et al. Evaluation of Early Retinal Nerve Injury in Type 2 Diabetes Patients Without Diabetic Retinopathy. Front Endocrinol. (Lausanne). 2020 Sep 29. 11. 475672. doi: 10.3389/fendo.2020.475672.
- Toyama T., Kawai H., Hashimoto Y., Azuma K., Shiraya T., Numaga J., Obuchi S., Ueta T.; OTASSHA Study Group. Macular and peripapillary retinal nerve fiber layer thinning in eyes with prediabetes in the elderly population: OTASSHA study. Graefes Arch. Clin. Exp. Ophthalmol. 2022 Dec 1. doi: 10.1007/s00417-022-05925-x.
- Araszkiewicz A., Zozulińska-Ziółkiewicz D., Meller M., Bernardczyk-Meller J., Piłaciński S. et al. Neurodegeneration of the retina in type 1 diabetic patients. Pol. Arch. Med. Wewn. 2012. 122(10). 464-70.
- Jonas J.B., Mardin C.Y., Schlötzer-Schrehardt U., Naumann G.O. Morphometry of the human lamina cribrosa surface. Invest. Ophthalmol. Vis. Sci. 1991. 32(2). 401-405.
- Winkler M., Jester B., Nien-Shy C., Massei S., Minckler D.S., Jester J.V., Brown D.J. High resolution three-dimensional reconstruction of the collagenous matrix of the human optic nerve head. Brain Res. Bull. 2010 Feb 15. 81(2-3). 339-48. doi: 10.1016/j.brainresbull.2009.06.001.
- Coudrillier B., Campbell I.C., Read A.T., Geraldes D.M., Vo N.T., Feola A., Mulvihill J. et al. Effects of Peripapillary Scleral Stiffening on the Deformation of the Lamina Cribrosa. Invest. Ophthalmol. Vis. Sci. 2016 May 1. 57(6). 2666-77. doi: 10.1167/iovs.15-18193.
- Sigal I.A., Flanagan J.G., Ethier C.R. Factors influencing optic nerve head biomechanics. Invest. Ophthalmol. Vis. Sci. 2005 Nov. 46(11). 4189-99. doi: 10.1167/iovs.05-0541.