Журнал "Гастроэнтерология" Том 57, №2, 2023
Вернуться к номеру
Характер порушень кишкової мікрофлори при кардіоваскулярних захворюваннях
Авторы: Степанов Ю.М. (1), Будзак І.Я. (2)
(1) — ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
(2) — Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
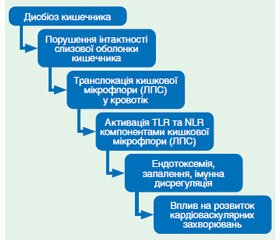
У статті проведено огляд літератури стосовно взаємозв’язку кишкової мікрофлори та кардіометаболічних порушень. Давно відоме та доведене патофізіологічне значення порушення мікрофлори у розвитку кишкової патології. Проте наукові дослідження останніх десятиліть впевнено довели, що позитивна роль кишкової мікробіоти не обмежується лише кишечником. Порушення кишкової мікробіоти можуть впливати на інші органи та системи, зокрема на кардіометаболічні процеси. Механізм взаємозв’язку між дисбіотичними порушеннями та кардіоваскулярною системою може відбуватися шляхом погіршення бар’єрної функції кишечника та шляхом впливу різних метаболітів кишкової мікрофлори на кардіометаболічні процеси. При погіршенні інтестинального бар’єра прозапальні шкідливі компоненти кишкової мікрофлори — ліпополісахариди — можуть негативно впливати на кардіоваскулярну систему. Серед метаболітів кишкової мікрофлори, які можуть різнобічно впливати на кардіометаболічні процеси, найбільш вагоме значення мають коротколанцюгові жирні кислоти, жовчні кислоти, триметиламіно-N-оксид. Накопичені дані досліджень, що вказують на можливий вплив порушень кишкової мікрофлори на атеросклероз, артеріальну гіпертензію, хронічну серцеву недостатність. Проводиться пошук методів корекції кишкової флори, які б дозволили усунути вказаний негативний вплив.
The article reviews the literature on the relationship between intestinal microflora and cardiometabolic disorders. The pathophysiological significance of microflora disturbance in the development of intestinal pathology has long been known and proven. However, scientific research in recent decades has convincingly proven that the positive role of intestinal microbiota is not limited only to the intestines. Disturbances of the intestinal microbiota can affect other organs and systems, in particular, cardiometabolic processes. The mechanism of the relationship between dysbiotic disorders and the cardiovascular system can occur due to the deterioration of the intestinal barrier function and through the influence of various metabolites of the intestinal microflora on cardiometabolic processes. When the intestinal barrier deteriorates, pro-inflammatory harmful components of the intestinal microflora such as lipopolysaccharides can have a negative effect on the cardiovascular system. Short-chain fatty acids, bile acids, and trimethylamine N-oxide are of the greatest importance among the metabolites of the intestinal microflora, which can have a diverse effect on cardiometabolic processes. Accumulated research data indicate the possible impact of intestinal microflora disturbances on atherosclerosis, hypertension, and chronic heart failure. The search for methods of correcting the intestinal flora is underway, which would allow to eliminate the specified negative impact.
кишкова мікрофлора; дисбіоз; кардіоваскулярні захворювання; метаболічні порушення
intestinal microflora; dysbiosis; cardiovascular diseases; metabolic disorders
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Patterson E., Ryan P.M., Cryan J.F., et al. Gut microbiota, obesity and diabetes. Postgrad Med J. 2016 May. 92(1087). 286-300. doi: 10.1136/postgradmedj-2015-133285.
- Bhat M.A., Mishra A.K., Tantray J.A., et al. Gut Microbiota and Cardiovascular System: An Intricate Balance of Health and the Diseased State. Life (Basel). 2022 Nov 28. 12(12). 1986. doi: 10.3390/life12121986.
- Liu J., Tan Y., Cheng H., Zhang D., Feng W., Peng C. Functions of Gut Microbiota Metabolites, Current Status and Future Perspectives. Aging Dis. 2022 Jul 11. 13(4). 1106-1126. doi: 10.14336/AD.2022.0104.
- Vancamelbeke M., Vermeire S. The intestinal barrier: a fundamental role in health and disease. Expert Rev Gastroenterol Hepatol. 2017. 11. 821-834. doi: 10.1080/17474124.2017.1343143.
- Perino A., Demagny H., Velazquez-Villegas L., Schoonjans K. Molecular physiology of bile acid signaling in health, disease, and aging. Physiol Rev. 2021. 101. 683-731. doi: 10.1152/physrev.00049.2019.
- Wang L., Wang S., Zhang Q., He C., Fu C., Wei Q. The role of the gut microbiota in health and cardiovascular diseases. Mol Biomed. 2022 Oct 11. 3(1). 30. doi: 10.1186/s43556-022-00091-2.
- David L.A., Maurice C.F., Carmody R.N., et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014 Jan 23. 505(7484). 559-63. doi: 10.1038/nature12820.
- Kazemian N., Mahmoudi M., Halperin F., Wu J.C., Pakpour S. Gut microbiota and cardiovascular disease: opportunities and challenges. Microbiome. 2020 Mar 14. 8(1). 36. doi: 10.1186/s40168-020-00821-0.
- Kong L.C., Holmes B.A., Cotillard A., et al. Dietary patterns differently associate with inflammation and gut microbiota in overweight and obese subjects. PLoS One 2014. 9. e109434. doi: 10.1371/journal.pone.0109434.
- Caesar R., Tremaroli V., Kovatcheva-Datchary P., et al. Crosstalk between gut microbiota and dietary lipids aggravates WAT inflammation through TLR signaling. Cell Metab. 2015. 22. 658-68. doi: 10.1016/j.cmet.2015.07.026.
- Schoeler M., Caesar R. Dietary lipids, gut microbiota and lipid metabolism. Rev Endocr Metab Disord. 2019 Dec. 20(4). 461-472. doi: 10.1007/s11154-019-09512-0.
- Amar J., Chabo C., Waget A., et al. Intestinal mucosal adherence and translocation of commensal bacteria at the early onset of type 2 diabetes: molecular mechanisms and probiotic treatment. EMBO Mol Med. 2011. 3. 559-72. doi: 10.1002/emmm.201100159.
- Amar J., Serino M., Lange C., et al. Involvement of tissue bacteria in the onset of diabetes in humans: evidence for a concept. Diabetologia. 2011. 54. 3055-61. doi: 10.1007/s00125-011-2329-8.
- Ahmadmehrabi S., Tang W.H.W. Gut microbiome and its role in cardiovascular diseases. Curr Opin Cardiol. 2017 Nov. 32(6). 761-766. doi: 10.1097/HCO.0000000000000445.
- Kimura I., et al. The gut microbiota suppresses insulin-media–ted fat accumulation via the short-chain fatty acid receptor GPR43. Nat Commun. 2013 May. 4. 1829. doi: 10.1038/ncomms2852.
- Psichas A., et al. The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents. Int J Obes 2005. 2015 Mar. 39(3). 424-429. doi: 10.1038/ijo.2014.153.
- Qian B., Zhang K., Li Y., Sun K. Update on gut microbiota in cardiovascular diseases. Front Cell Infect Microbiol. 2022 Nov 10. 12. 1059349. doi: 10.3389/fcimb.2022.1059349.
- Turnbaugh P.J., Hamady M., Yatsunenko T., et al. A core gut microbiome in obese and lean twins. Nature. 2009. 457. 480-4. doi: 10.1038/nature07540.
- Ley R.E., Turnbaugh P.J., Klein S., et al . Microbial ecology: human gut microbes associated with obesity. Nature. 2006. 444. 1022-3. doi: 10.1038/4441022a.
- Kallus S.J., Brandt L.J. The Intestinal Microbiota and Obesity. J Clin Gastroenterol. 2012. 46. 16-24. doi: 10.1097/MCG.0b013e31823711fd.
- Koliada A., Syzenko G., Moseiko V., et al. Association bet–ween body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population. BMC Microbiol. 2017 May 22. 17(1). 120. doi: 10.1186/s12866-017-1027-1.
- Jonsson A.L., Bäckhed F. Role of gut microbiota in atherosclerosis. Nat Rev Cardiol. 2017 Feb. 14(2). 79-87. doi: 10.1038/nrcardio.2016.183.
- Louis P., Flint H.J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine. FEMS Microbiol Lett. 2009. 294. 1-8. doi: 10.1111/j.1574-6968.2009.01514.x.
- Louis P., Flint H.J. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol. 2017. 19. 29-41. doi: 10.1111/1462-2920.13589.
- Parada Venegas D., De la Fuente M.K., Landskron G., et al. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases. Front Immunol. 2019. 10. 277. doi: 10.3389/fimmu.2019.00277.
- Zhen J., Zhou Z., He M., et al. The gut microbial metabolite trimethylamine N-oxide and cardiovascular diseases. Front Endocrinol (Lausanne). 2023 Feb 7. 14. 1085041. doi: 10.3389/fendo.2023.1085041.
- Tacconi E., Palma G., De Biase D., et al. Microbiota Effect on Trimethylamine N-Oxide Production: From Cancer to Fitness — A Practical Preventing Recommendation and Therapies. Nutrients. 2023 Jan 21. 15(3). 563. doi: 10.3390/nu15030563.
- Wilson A., McLean C., Kim R.B. Trimethylamine-N-oxide: a link between the gut microbiome, bile acid metabolism, and atherosclerosis. Curr Opin Lipidol. 2016 Apr. 27(2). 148-54. doi: 10.1097/MOL.0000000000000274.
- Calandrini C., Ribeiro A.C., Gonnelli A.C., et al. Microbial composition of atherosclerotic plaques. Oral Dis. 2014. 20. e128-e134. doi: 10.1111/odi.12205.
- Zhu W., Gregory J.C., Org E., et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk. Cell. 2016. 165. 111-24. doi: 10.1016/j.cell.2016.02.011.
- Qi J., You T., Li J., et al. Circulating trimethylamine N-oxide and the risk of cardiovascular diseases: A systematic review and meta-analysis of 11 prospective cohort studies. J Cell Mol Med. 2017. 22. 185-194. doi: 10.1111/jcmm.13307.
- Lau K., Srivatsav V., Rizwan A., et al. Bridging the Gap between Gut Microbial Dysbiosis and Cardiovascular Diseases. Nutrients. 2017. 9. 859. doi: 10.3390/nu9080859.
- Yang T., Santisteban M.M., Rodriguez V., et al. Gut Dysbiosis Is Linked to Hypertension. Hypertension. 2015. 65. 1331-1340. doi: 10.1161/HYPERTENSIONAHA.115.05315.
- Khalesi S., Sun J., Buys N., Jayasinghe R.. Effect of probiotics on blood pressure: A systematic review and meta-analysis of randomized, controlled trials. Hypertension. 2014. 64. 897-903. doi: 10.1161/HYPERTENSIONAHA. 114.03469.
- Yang T., Aquino V., Lobaton G.O., et al. Sustained Captopril-Induced Reduction in Blood Pressure Is Associated with Alterations in Gut-Brain Axis in the Spontaneously Hypertensive Rat. J Am Heart Assoc. 2019. 8. e010721. doi: 10.1161/JAHA.118.010721.
- Wu D., Tang X., Ding L., et al. Candesartan attenuates hypertension-associated pathophysiological alterations in the gut. Biomed. Pharmacother. 2019. 116. 109040. doi: 10.1016/j.biopha.2019.109040.
- Sandek A., Bauditz J., Swidsinski A., et al. Altered Intestinal Function in Patients with Chronic Heart Failure. J Am Coll Cardiol. 2007. 50. 1561-1569. doi: 10.1016/j.jacc.2007.07.016.
- Nagatomo Y., Tang W.H.W. Intersections Between Microbiome and Heart Failure: Revisiting the Gut Hypothesis. J Card Fail. 2015. 21. 973-980. doi: 10.1016/j.cardfail.2015.09.017.
- Kanitsoraphan C., Rattanawong P., Charoensri S., Senthong V. Trimethylamine N-Oxide and Risk of Cardiovascular Disea–se and Morta–lity. Curr. Nutr. Rep. 2018. 7. 207-213. doi: 10.1007/s13668-018-0252-z.
- Tang W.W., Wang Z., Fan Y., et al. Prognostic value of ele–vated levels of intestinal microbe-generated metabolite trimethyla–mine-N-oxide in patients with heart failure: Refining the Gut Hypothesis. J Am Coll Cardiol. 2014. 64. 1908-1914. doi: 10.1016/j.jacc.2014.02.617.
- Bartolomaeus H., Balogh A., Yakoub M., et al. Short-Chain Fatty Acid Propionate Protects from Hypertensive Cardiovascular Damage. Circulation. 2019. 139. 1407-1421. doi: 10.1161/CIRCULATIONAHA. 118.036652.
- Estruch R., Ros E., Salas-Salvadó J., et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med. 2018. 378. e34. doi: 10.1056/NEJMoa1800389.
- Papadaki A., Martínez-González M., Alonso-Gómez A., et al. Mediterranean diet and risk of heart failure: Results from the PREDIMED randomized controlled trial. Eur J Heart Fail. 2017. 19. 1179-1185. doi: 10.1002/ejhf.750.
- Parnell J., Reimer R. Weight loss during oligofructose supplementation is associated with decreased ghrelin and increased peptide YY in overweight and obese adults. Am J Clin Nutr. 2009. 89. 1751-1759. doi: 10.3945/ajcn.2009.27465.
- Jin M., Qian Z., Yin J., Xu W., Zhou X. The role of intestinal microbiota in cardiovascular disease. J Cell Mol Med. 2019 Apr. 23(4). 2343-2350. doi: 10.1111/jcmm.14195.
- Simon M.-C., Strassburger K., Nowotny B., et al. Intake of Lactobacillus reuteri Improves Incretin and Insulin Secretion in Glucose-Tolerant Humans: A Proof of Concept. Diabetes Care. 2015. 38. 1827-1834. doi: 10.2337/dc14-2690.
- Gan X.T., Ettinger G., Huang C.X., et al. Probiotic Admini–stration Attenuates Myocardial Hypertrophy and Heart Failure After Myocardial Infarction in the Rat. Circ. Heart Fail. 2014. 7. 491-499. doi: 10.1161/CIRCHEARTFAILURE.113.000978.
- Costanza A.C., Moscavitch S.D., Neto H.C.F., Mesquita E.T. Probiotic therapy with Saccharomyces boulardii for heart failure patients: A randomized, double-blind, placebo-controlled pilot trial. Int J Cardiol. 2015. 179. 348-350. doi: 10.1016/j.ijcard.2014.11.034.
- Kothari D., Patel S., Kim S.-K. Probiotic supplements might not be universally-effective and safe: A review. Biomed. Pharmacother. 2018. 111. 537-547. doi: 10.1016/j.biopha.2018.12.104.
- Zhang H., Duan Y., Cai F., et al. Next-Generation Probiotics: Microflora Intervention to Human Diseases. Biomed Res Int. 2022 Nov 16. 2022. 5633403. doi: 10.1155/2022/5633403.
- Scott E., De Paepe K., Van de Wiele T. Postbiotics and Their Health Modulatory Biomolecules. Biomolecules. 2022 Nov 4. 12(11). 1640. doi: 10.3390/biom12111640.