Журнал «Почки» Том 12, №3, 2023
Вернуться к номеру
Перспективи використання препаратів леспедези (Lespedeza sp.) для лікування патології нирок та інших діабетичних ускладнень
Авторы: Соколова Л.К., Пушкарьов В.М., Тронько М.Д.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Lespedeza sp. — це рослина, що належить до сімейства бобових. У традиційній народній медицині її використовують для лікування нефриту, азотемії, запалення, діабету і розладів діурезу. Містить багато дубильних речовин, флавоноїдів і споріднених поліфенольних сполук, таких як геністеїн, кверцетин, дайдзеїн, катехін, рутин, лютеолін, нарингін, які зумовлюють терапевтичні властивості рослини. Екстракти леспедези (ЕЛ) мають антиоксидантну, антитирозиназну, протизапальну, естрогенну, антимікробну, протигрибкову активність, поліпшують пам’ять при лікуванні когнітивної дисфункції. Крім того, ЕЛ використовуються як терапевтичний засіб для запобігання діабетичній нефропатії, зменшують спричинене гіперглікемією запалення, окиснювальний стрес, пошкодження і фіброз печінки, пригнічують ріст клітин карциноми легенів і раку простати. Ліки на травах все частіше використовуються для лікування хворих із хронічною хворобою нирок (ХХН). Застосовуються в першу чергу антагоністи ангіотензину, неспецифічні ренопротектори й імуномодулюючі/адаптогенні трави. Систематизація наукових даних щодо фітохімічного складу, фармакологічної активності й застосування в медицині рослин роду Lespedeza дозволяє використовувати ЕЛ для лікування захворювань нирок. Виявлені значні переваги настоянки леспедези як для пацієнтів з гострою хворобою нирок, так і для пацієнтів із ХХН. Флавоноїди леспедези поліпшують білковоенергетичний обмін, що дає сприятливий нефропротекторний ефект і уповільнює прогресування ХХН, зберігаючи нормальну екскреторну функцію. Також ЕЛ посилюють діурез, усувають набряки, зменшують рівень азотемії та альбумінурії, підвищують виділення натрію, сприяють поліпшенню ниркової фільтрації та виведенню азотистих продуктів із сечею. Перевагами ЕЛ у нормалізації капілярної проникності ниркових клубочків є м’яка сечогінна дія, що запобігає значній втраті електролітів на відміну від синтетичних діуретиків. Отже, клінічні й доклінічні випробування препаратів леспедези демонструють їх перспективність для лікування ХХН, діабетичної нефропатії, серцево-судинних захворювань і хвороб печінки. Перевагою цих препаратів є багатоплановість, системність дії, що зближує їх з гліфлозинами, а також відсутність побічних ефектів.
Lespedeza sp. it is a plant of the pea family. In traditional folk medicine, it is used to treat nephritis, azotemia, inflammation, diabetes, and diuresis. It contains many tannins, flavonoids and related polyphenolic compounds, such as genistein, quercetin, daidzein, catechin, rutin, luteolin, naringin, which determine the therapeutic properties of the plant. Lespedezа extracts (LE) have antioxidant, antityrosinase, anti-inflammatory, estrogenic, antimicrobial, antifungal activity, improve memory in the treatment of cognitive dysfunction. In addition, LE is used as a therapeutic agent to prevent diabetic nephropathy, reduces hyperglycemia-induced inflammation, oxidative stress, liver damage and fibrosis, inhibits the growth of lung carcinoma and prostate cancer cells. Herbal medicines are increasingly being used to treat patients with chronic kidney disease (CKD). Angiotensin antagonists, nonspecific renoprotectors, and immunomodulatory/adaptogenic herbs are primarily used. Systematization of scientific data on the phytochemical composition, pharmacological activity, and medicinal use of the Lespedeza genus plants allow the use of LE for the treatment of kidney diseases. The significant advantages of Lespedezа tincture for patients with acute kidney disease and those with CKD have been revealed. Lespedezа flavonoids improve protein-energy metabolism, which has a favorable nephroprotective effect and slows down the progression of CKD, preserving normal excretory function. LE also increases diuresis, eliminates edema, reduces the level of azotemia and albuminuria, increases sodium excretion, improves renal filtration and excretion of nitrogenous products with urine. The advantage of LE in normalizing the capillary permeability of the renal glomeruli is a mild diuretic effect, which prevents a significant loss of electrolytes, unlike synthetic diuretics. Thus, clinical and preclinical trials of lespedeza drugs demonstrate their prospects for the treatment of CKD, diabetic nephropathy, cardiovascular and liver diseases. The advantages of these drugs are versatility, systemic action, which brings them closer to gliflozins, as well as the absence of side effects.
препарати леспедези; захворювання нирок; діабетичні ускладнення
lespedezа drugs; kidney disease; diabetic complications
Загальна характеристика
Вплив на систему виділення
Антидіабетичний ефект
Вплив леспедезина серцево-судинні захворювання
Вплив леспедези на захворювання печінки
Механізми дії екстрактів леспедези
Препарати леспедези й інгібітори натрійзалежного котранспортера глюкози 2-го типу (iSGLT2, гліфлозини)
Висновки
- Yarnell E. Botanical medicines for the urinary tract. World J. Urol. 2002. Vol. 20. № 5. P. 285-93. doi: 10.1007/s00345-002-0293-0. PMID: 12522584.
- Yarnell E.L. Botanical medicines used for kidney disease in the United States. Iran. J. Kidney Dis. 2012. Vol. 6. № 6. P. 407-18. PMID: 23146977.
- Cornara L., Xiao J., Burlando B. Therapeutic Potential of Temperate Forage Legumes: A Review. Crit. Rev. Food Sci. Nutr. 2016. Vol. 56. Suppl. 1. P. S149-61. doi: 10.1080/10408398.2015.1038378. PMID: 26507574.
- Іванов Д.Д. Як потенціювати дію інгібіторів ренін-ангіо-тензин-альдостеронової системи? Нирки. 2022. Т. 10. № 3. С. 156-161. doi: 10.22141/2307-1257.10.3.2021.239593.
- Maximov O.B., Kulesh N.I., Stepanenko L.S., Dmitrenok P.S. New prenylated isoflavanones and other constituents of Lespedeza bicolor. Fitoterapia. 2004. Vol. 75. № 1. P. 96-8. doi: 10.1016/j.fitote.2003.07.012. PMID: 14693230.
- Do M.H., Lee J.H., Wahedi H.M. et al. Lespedeza bicolor ameliorates endothelial dysfunction induced by methylglyoxal glucotoxicity. Phytomedicine. 2017. Vol. 36. P. 26-36. doi: 10.1016/j.phymed.2017.09.005. PMID: 29157823.
- Dyshlovoy S.A., Tarbeeva D., Fedoreyev S. et al. Polyphenolic Compounds from Lespedeza Bicolor Root Bark Inhibit Progression of Human Prostate Cancer Cells via Induction of Apoptosis and Cell Cycle Arrest. Biomolecules. 2020. Vol. 10. № 3. P. 451. doi: 10.3390/biom10030451. PMID: 32183314; PMCID: PMC7175281.
- Kim Y.R., Nam S.H. Effects of a mouthwash containing Lespedeza cuneata extract on risk of dental caries: a randomized, placebo-controlled clinical trial. Sci. Rep. 2022 Dec 1. 12(1). 20761. doi: 10.1038/s41598-022-25162-w. PMID: 36456715; PMCID: PMC9715620.
- Ko Y.H., Shim K.Y., Kim S.K. et al. Lespedeza bicolor Extract Improves Amyloid Beta25 - 35-Induced Memory Impairments by Upregulating BDNF and Activating Akt, ERK, and CREB Signaling in Mice. Planta Med. 2019. Vol. 85. № 17. P. 1363-1373. doi: 10.1055/a-1018-5402. PMID: 31618776.
- Tarbeeva D.V., Pislyagin E.A., Menchinskaya E.S. et al. Polyphenolic Compounds from Lespedeza bicolor Protect Neuronal Cells from Oxidative Stress. Antioxidants (Basel). 2022. Vol. 11. № 4. P. 709. doi: 10.3390/antiox11040709. PMID: 35453394; PMCID: PMC9025851.
- Do M.H., Lee J.H., Cho K. et al. Therapeutic Potential of Lespedeza bicolor to Prevent Methylglyoxal-Induced Glucotoxicity in Familiar Diabetic Nephropathy. J. Clin. Med. 2019. Vol. 8. № 8. P. 1138. doi: 10.3390/jcm8081138. PMID: 31370192; PMCID: PMC6723630.
- Kim Y., Lee H., Kim S.Y., Lim Y. Effects of Lespedeza Bico–lor Extract on Regulation of AMPK Associated Hepatic Lipid Metabolism in Type 2 Diabetic Mice. Antioxidants (Basel). 2019. Vol. 8. № 12. P. 599. doi: 10.3390/antiox8120599. PMID: 31795363; –PMCID: PMC6943630.
- Tarbeeva D.V., Fedoreyev S.A., Veselova M.V. et al. Cytotoxic polyphenolic compounds from Lespedeza bicolor stem bark. Fitoterapia. 2019. Vol. 135. P. 64-72. doi: 10.1016/j.fitote.2019.04.003. PMID: 31004693.
- Thuy N.T.T., Lee J.E., Yoo H.M., Cho N. Antiproliferative Pterocarpans and Coumestans from Lespedeza bicolor. J. Nat. Prod. 2019. Vol. 82. № 11. P. 3025-3032. doi: 10.1021/acs.jnatprod.9b00567. PMID: 31675225.
- Iijima Y., Nakayama M., Miwa T. et al. Nephroprotective Effects of Dapagliflozin in Patients with Type 2 Diabetes. Intern. Med. 2023. Vol. 62. № 5. P. 681-688. doi: 10.2169/internalmedicine.6685-20. PMID: 36858619; PMCID: PMC10037009.
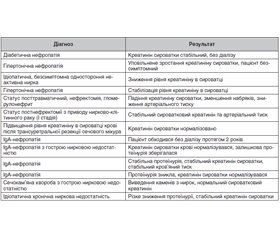
- Кушніренко С.В., Іванов Д.Д., Ротова С.О., Кушніренко О.В. Ренопротекторні можливості Lespedeza capitata у хворих на хронічну хворобу нирок із цукровим діабетом 2-го типу. Нирки. 2022. Т. 10. № 3. С. 162-168. doi: 10.22141/2307-1257.10.3.2021.239594.
- Di Cerbo A., Iannitti T., Guidetti G., Centenaro S., Canello S., Cocco R. A nutraceutical diet based on Lespedeza spp., Vaccinium macrocarpon and Taraxacum officinale improves spontaneous feline chronic kidney disease. Physiol. Rep. 2018. Vol. 6. № 12. P. e13737. doi: 10.14814/phy2.13737. PMID: 29906338; PMCID: PMC6003637.
- Webster A.C., Nagler E.V., Morton R.L., Masson P. Chronic Kidney Disease. Lancet. 2017. Vol. 389. № 10075. P. 1238-1252. doi: 10.1016/S0140-6736(16)32064-5. PMID: 27887750.
- Schnaper H.W. The Tubulointerstitial Pathophysiology of Progressive Kidney Disease. Adv. Chronic Kidney Dis. 2017. Vol. 24. № 2. P. 107-116. doi: 10.1053/j.ackd.2016.11.011. PMID: 28284376; PMCID: PMC5351778.
- Djudjaj S., Boor P. Cellular and molecular mechanisms of kidney fibrosis. Mol. Aspects Med. 2019. Vol. 65. P. 16-36. doi: 10.1016/j.mam.2018.06.002. PMID: 29909119.
- Duni A., Liakopoulos V., Roumeliotis S., Peschos D., Dounousi E. Oxidative Stress in the Pathogenesis and Evolution of Chronic Kidney Disease: Untangling Ariadne’s Thread. Int. J. Mol. Sci. 2019. Vol. 20. № 15. P. 3711. doi: 10.3390/ijms20153711. PMID: 31362427; PMCID: PMC6695865.
- Lovisa S., Zeisberg M., Kalluri R. Partial Epithelial-to-Mesenchymal Transition and Other New Mechanisms of Kidney Fibrosis. Trends Endocrinol. Metab. 2016. Vol. 27. № 10. P. 681-695. doi: 10.1016/j.tem.2016.06.004. PMID: 27372267.
- Khan M.A., Kassianos A.J., Hoy W.E., Alam A.K., Healy H.G., Gobe G.C. Promoting Plant-Based Therapies for Chronic Kidney Disease. J. Evid. Based Integr. Med. 2022. Vol. 27. P. 2515690X221079688. doi: 10.1177/2515690X221079688. PMID: 35243916; PMCID: PMC8902019.
- Chen L., Deng H., Cui H. et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 2017. Vol. 9. № 6. P. 7204-7218. doi: 10.18632/oncotarget.23208. PMID: 29467962; PMCID: PMC5805548.
- Liu J., Wei Q., Guo C. et al. Hypoxia, HIF, and Associated Signaling Networks in Chronic Kidney Disease. Int. J. Mol. Sci. 2017. Vol. 18. № 5. P. 950. doi: 10.3390/ijms18050950. PMID: 28468297; PMCID: PMC5454863.
- Guzzi F., Cirillo L., Roperto R.M., Romagnani P., Lazzeri E. Molecular Mechanisms of the Acute Kidney Injury to Chronic Kidney Disease Transition: An Updated View. Int. J. Mol. Sci. 2019. Vol. 20. № 19. P. 4941. doi: 10.3390/ijms20194941. PMID: 31590461; –PMCID: PMC6801733.
- Poluzzi C., Nastase M.V., Zeng-Brouwers J. et al. Biglycan evokes autophagy in macrophages via a novel CD44/Toll-like receptor 4 signaling axis in ischemia/reperfusion injury. Kidney Int. 2019. Vol. 95. № 3. P. 540-562. doi: 10.1016/j.kint.2018.10.037. PMID: 30712922.
- Kiliś-Pstrusińska K., Wiela-Hojeńska A. Nephrotoxicity of Herbal Products in Europe-A Review of an Underestimated Problem. Int. J. Mol. Sci. 2021. Vol. 22. № 8. P. 4132. doi: 10.3390/ijms22084132. PMID: 33923686; PMCID: PMC8074082.
- Лисюк Р.М., Дармограй Р.Є. Рослини роду Lespedeza як перспективні джерела сучасних лікарських засобів. Фітотерапія. 2015. № 2. С. 31-5.
- Штриголь С.Ю., Товчига О.В. Біологічно активні речовини та препарати рослинного походження з нефропротекторною активністю. Фармаком. 2010. № 1. С. 140-155.
- Товчига О.В., Ролік С.М., Штриголь С.Ю. Препарати з нефропротекторною дією: огляд фармацевтичного ринку України. Укр. біофармацевт. журн. 2011. Т. 13. № 2. С. 29-35.
- Fan X., Wei W., Huang J., Liu X., Ci X. Isoorientin Attenuates Cisplatin-Induced Nephrotoxicity Through the Inhibition of Oxidative Stress and Apoptosis via Activating the SIRT1/SIRT6/Nrf-2 Pathway. Front. Pharmacol. 2020. Vol. 11. P. 264. doi: 10.3389/fphar.2020.00264. PMID: 32256355; PMCID: PMC7093647.
- Попова Н.В., Дихтярев С.И., Маслова Н.Ф., Литвиненко В.И., Алмакаева Л.Г. Лечение заболеваний почек фитохимическими препаратами. Фiтотерапiя. 2011. № 4. С. 40-44.
- Lee H., Kim S.Y., Lim Y. Lespedeza bicolor extract supplementation reduced hyperglycemia-induced skeletal muscle damage by regulation of AMPK/SIRT/PGC1α-related energy metabolism in type 2 diabetic mice. Nutr. Res. 2023. Vol. 110. P. 1-13. doi: 10.1016/j.nutres.2022.12.007. PMID: 36638746.
- Jorge A.P., Horst H., de Sousa E., Pizzolatti M.G., Silva F.R. Insulinomimetic effects of kaempferitrin on glycaemia and on –14C-glucose uptake in rat soleus muscle. Chem. Biol. Interact. 2004. Vol. 149. № 2–3. P. 89-96. doi: 10.1016/j.cbi.2004.07.001. PMID: 15501431.
- Lee J.K., Kang D.G., Lee H.S. Vascular relaxation induced by aqueous extract of Lespedeza cuneata via the NO-cGMP pathway. J. Nat. Med. 2012. Vol. 66. № 1. P. 17-24. doi: 10.1007/s11418-011-0546-6. PMID: 21607822.
- Lee J.H., Parveen A., Do M.H., Lim Y., Shim S.H., Kim S.Y. Lespedeza cuneata protects the endothelial dysfunction via eNOS phosphorylation of PI3K/Akt signaling pathway in HUVECs. Phytomedicine. 2018 Sep 15. 48. 1-9. doi: 10.1016/j.phymed.2018.05.005. Epub 2018 May 9. PMID: 30195866.
- Burlando B., Verotta L., Cornara L., Bottini-Massa E. Her-bal Principles in Cosmetics: Properties and Mechanisms of Action. Boca Raton, FL: CRC Press, 2010. 460 p.
- Chen S., Jiang H., Wu X., Fang J. Therapeutic Effects of Quercetin on Inflammation, Obesity, and Type 2 Diabetes. Mediators Inflamm. 2016. Vol. 2016. P. 9340637. doi: 10.1155/2016/9340637. PMID: 28003714; PMCID: PMC5149671.
- Al-Dosari D.I., Ahmed M.M., Al-Rejaie S.S., Alhomida A.S., Ola M.S. Flavonoid Naringenin Attenuates Oxidative Stress, Apoptosis and Improves Neurotrophic Effects in the Diabetic Rat. Re–tina. Nutrients. 2017. Vol. 9. № 10. P. 1161. doi: 10.3390/nu9101161. PMID: 29064407; PMCID: PMC5691777.
- Do M.H., Hur J., Choi J., Kim Y., Park H.Y., Ha S.K. Spatholobus suberectus Ameliorates Diabetes-Induced Renal Damage by Suppressing Advanced Glycation End Products in db/db Mice. Int. J. Mol. Sci. 2018. Vol. 19. № 9. P. 2774. doi: 10.3390/ijms19092774. PMID: 30223524; PMCID: PMC6163801.
- He L., Zhou X., Huang N. et al. AMPK Regulation of Glucose, Lipid and Protein Metabolism: Mechanisms and Nutritional Significance. Curr. Protein Pept. Sci. 2017. Vol. 18. № 6. P. 562-570. doi: 10.2174/1389203717666160627071125. PMID: 27356941.
- Пушкарев В.М., Соколова Л.К., Пушкарев В.В., Тронько Н.Д. Роль AMPK и mTOR в развитии инсулинорезистентности и диабета 2 типа. Механизм действия метформина (обзор литературы). Проблеми ендокринної патології. 2016. № 3. С. 77-90.
- Тронько Н.Д., Пушкарев В.М., Соколова Л.К., Пушкарев В.В., Ковзун Е.И. Молекулярные механизмы патогенеза сахарного диабета и его осложнений. К.: Издательский дом «Медкнига», 2018. 264 с.
- Li Y., Xu S., Mihaylova M.M. et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and athe-rosclerosis in diet-induced insulin-resistant mice. Cell Metab. 2011. Vol. 13. № 4. P. 376-388. doi: 10.1016/j.cmet.2011.03.009. PMID: 21459323; PMCID: PMC3086578.
- Joven J., Espinel E., Rull A. et al. Plant-derived polyphenols regulate expression of miRNA paralogs miR-103/107 and –miR-122 and prevent diet-induced fatty liver disease in hyperlipidemic mice. Biochim. Biophys. Acta. 2012. Vol. 1820. № 7. P. 894-9. doi: 10.1016/j.bbagen.2012.03.020. PMID: 22503922.
- Miyase T., Sano M., Yoshino K., Nonaka K. Antioxidants from Lespedeza homoloba (II). Phytochemistry. 1999 Sep. 52(2). 311-9. doi: 10.1016/s0031-9422(99)00194-6. PMID: 10513404.
- Lee Y.S., Chang Z., Park S.C., Lim N.R., Kim N.W. Antio–xidant activity and irritation response of Lespedeza bicolor. J. Toxicol. 2005. Vol. 21. P. 115-119.
- Dong X.G., An Z.M., Guo Y., Zhou J.L., Qin T. Effect of triptolide on expression of oxidative carbonyl protein in renal cortex of rats with diabetic nephropathy. J. Huazhong Univ. Sci. Technolog. Med. Sci. 2017. Vol. 37. № 1. P. 25-29. doi: 10.1007/s11596-017-1689-9. PMID: 28224432.
- Pieper C.M., Roza A.M., Henderson J.D. Jr, Zhu Y.R., Lai C.S. Spatial distribution and temporal onset of NF-kB activation and inducible nitric oxide synthase within pancreatic islets in the pre-diabetic stage of genetic, diabetic-prone BB rats: attenuation by drug intervention decreases inflammatory cell infiltration and incidence of diabetes. Inflamm. Res. 2004. Vol. 53. № 1. P. 22-30. doi: 10.1007/s00011-003-1223-3. PMID: 15021977.
- Пушкарьов В.М., Ковзун О.І., Пушкарьов В.В., Гуда Б.Б., Тронько M.Д. Хронічне запалення і рак. Значення ядерного фактора NF-кB (огляд літератури та власних досліджень). Журнал Національної академії медичних наук України. 2015. T. 21. № 3–4. C. 287-298.
- Соколова Л.К., Пушкарьов В.М., Пушкарьов В.В., Тронько Н.Д. Механiзми патогенезу атеросклерозу у хворих на дiабет. Роль NF-кB (огляд лiтератури). Проблеми ендокринної патології. 2017. № 2. С. 64-76. doi: 10.21856/j-PEP. 2017.2.10.
- Lee S.J., Hossaine M.D., Park S.C. A potential anti-inflammation activity and depigmentation effect of Lespedeza bicolor extract and its fractions. Saudi J. Biol. Sci. 2016. Vol. 23. № 1. P. 9-14. doi: 10.1016/j.sjbs.2015.01.016. PMID: 26858533; –PMCID: PMC4705262.
- Alicic R.Z., Rooney M.T., Tuttle K.R. Diabetic Kidney Disease: Challenges, Progress, and Possibilities. Clin. J. Am. Soc. Nephrol. 2017. Vol. 12. № 12. P. 2032-2045. doi: 10.2215/CJN.11491116. PMID: 28522654; PMCID: PMC5718284.
- Ratliff B.B., Abdulmahdi W., Pawar R., Wolin M.S. Oxidant Mechanisms in Renal Injury and Disease. Antioxid. Redox. Signal. 2016. Vol. 25. № 3. P. 119-46. doi: 10.1089/ars.2016.6665. PMID: 26906267; PMCID: PMC4948213.
- Minutoli L., Puzzolo D., Rinaldi M. et al. ROS-Media-ted NLRP3 Inflammasome Activation in Brain, Heart, Kidney, and Testis Ischemia/Reperfusion Injury. Oxid. Med. Cell. Longev. 2016. Vol. 2016. P. 2183026. doi: 10.1155/2016/2183026. PMID: 27127546; PMCID: PMC4835650.
- Park J.E., Lee H., Kim S.Y., Lim Y. Lespedeza bicolor Extract Ameliorated Renal Inflammation by Regulation of NLRP3 Inflammasome-Associated Hyperinflammation in Type 2 Diabetic Mice. Antioxidants (Basel). 2020. Vol. 9. № 2. P. 148. doi: 10.3390/antiox9020148. PMID: 32050658; PMCID: PMC7071116.
- Song W., Wei L., Du Y., Wang Y., Jiang S. Protective effect of ginsenoside metabolite compound K against diabetic nephropathy by inhibiting NLRP3 inflammasome activation and NF-κB/p38 signaling pathway in high-fat diet/streptozotocin-induced diabetic mice. Int. Immunopharmacol. 2018. Vol. 63. P. 227-238. doi: 10.1016/j.intimp.2018.07.027. PMID: 30107367.
- Zheng Z., Zheng F. Immune Cells and Inflammation in Diabetic Nephropathy. J. Diabetes Res. 2016. Vol. 2016. P. 1841690. doi: 10.1155/2016/1841690. PMID: 26824038; PMCID: PMC4707326.
- Granata S., Dalla Gassa A., Bellin G., Lupo A., Zaza G. Transcriptomics: A Step behind the Comprehension of the Polygenic Influence on Oxidative Stress, Immune Deregulation, and Mitochondrial Dysfunction in Chronic Kidney Disease. Biomed. Res. Int. 2016. Vol. 2016. P. 9290857. doi: 10.1155/2016/9290857. PMID: 27419142; PMCID: PMC4932167.
- Solini A., Menini S., Rossi C. et al. The purinergic 2X7 receptor participates in renal inflammation and injury induced by high-fat diet: possible role of NLRP3 inflammasome activation. J. Pathol. 2013. Vol. 231. № 3. P. 342-53. doi: 10.1002/path.4237. PMID: 23843215.
- Kim S.M., Kim Y.G., Kim D.J. et al. Inflammasome-Independent Role of NLRP3 Mediates Mitochondrial Regulation in Renal Injury. Front. Immunol. 2018. Vol. 9. P. 2563. doi: 10.3389/fimmu.2018.02563. PMID: 30483252; PMCID: PMC6240646.
- Zhou L., Xu D. Y., Sha W.G. et al. High glucose induces renal tubular epithelial injury via Sirt1/NF-kappaB/microR-29/Keap1 signal pathway. J. Transl. Med. 2015. Vol. 13. P. 352. doi: 10.1186/s12967-015-0710-y. PMID: 26552447; PMCID: PMC4640239.
- Chou X., Ding F., Zhang X., Ding X., Gao H., Wu Q. Sirtuin-1 ameliorates cadmium-induced endoplasmic reticulum stress and pyroptosis through XBP-1s deacetylation in human renal tubular epithelial cells. Arch. Toxicol. 2019. Vol. 93. № 4. P. 965-986. doi: 10.1007/s00204-019-02415-8. PMID: 30796460.
- Cetrullo S., D’Adamo S., Tantini B., Borzi R.M., Flamigni F. mTOR, AMPK, and Sirt1: Key Players in Metabolic Stress Management. Crit. Rev. Eukaryot. Gene Expr. 2015. Vol. 25. № 1. P. 59-75. doi: 10.1615/critreveukaryotgeneexpr.2015012975. PMID: 25955819.
- Release Brochure for Kanoka roundhead lespedeza (Lespedeza capitata). USDA-Natural Resources Conservation Service, Manhattan PMC, Manhattan, KS 66502. Published: December 2011.
- Rask-Madsen C., King G.L. Vascular complications of diabetes: mechanisms of injury and protective factors. Cell Metab. 2013 Jan 8. 17(1). 20-33. doi: 10.1016/j.cmet.2012.11.012. PMID: 23312281; PMCID: PMC3546345.
- Zhou P., Tan Y., Hao Z., Xu W., Zhou X., Yu J. Effects of SGLT2 inhibitors on hepatic fibrosis and steatosis: A systematic review and meta-analysis. Front. Endocrinol. (Lausanne). 2023. Vol. 14. P. 1144838. doi: 10.3389/fendo.2023.1144838. PMID: 36936142; PMCID: PMC10014961.
- Левчук Н.І., Ковзун О.І., Пушкарьов В.М., Тронько М.Д. Вплив інгібіторів натрій-залежного котранспортера глюкози 2-го типу на метаболізм ліпідів у хворих на цукровий діабет (огляд літератури). Журнал Національної академії медичних наук України. 2023. Т. 29. № 1–2. С. 5-21. doi: 10.37621/JNAMSU-2023-1-2-1.
- Mone P., Varzideh F., Jankauskas S.S. et al. SGLT2 inhibition via empagliflozin improves endothelial function and reduces mitochondrial oxidative stress: insights from frail hypertensive and diabetic patients. Hypertension. 2022. Vol. 79. P. 1633-43.
- Nakatsu Y., Kokubo H., Bumdelger B. et al. The SGLT2 Inhibitor Luseogliflozin Rapidly Normalizes Aortic mRNA Levels of Inflammation-Related but Not Lipid-Metabolism-Related Genes and Suppresses Atherosclerosis in Diabetic ApoE KO Mice. Int. J. Mol. Sci. 2017. Vol. 18. № 8. P. 1704. doi: 10.3390/ijms18081704. PMID: 28777298; PMCID: PMC5578094.
- Nasiri-Ansari N., Nikolopoulou C., Papoutsi K. et al. Empagliflozin Attenuates Non-Alcoholic Fatty Liver Disease (NAFLD) in High Fat Diet Fed ApoE(-/-) Mice by Activating Autophagy and Reducing ER Stress and Apoptosis. Int. J. Mol. Sci. 2021. Vol. 22. № 2. P. 818. doi: 10.3390/ijms22020818. PMID: 33467546; –PMCID: PMC7829901.
- Rahadian A., Fukuda D., Salim H.M. et al. Canagliflozin Prevents Diabetes-Induced Vascular Dysfunction in ApoE-Deficient Mice. J. Atheroscler. Thromb. 2020. Vol. 27. № 11. P. 1141-1151. doi: 10.5551/jat.52100. PMID: 32101837; PMCID: PMC7803832.
- Podestа M.A., Sabiu G., Galassi A., Ciceri P., Cozzolino M. SGLT2 Inhibitors in Diabetic and Non-Diabetic Chronic Kidney Di-sease. Biomedicines. 2023. Vol. 11. № 2. P. 279. doi: 10.3390/biome-dicines11020279. PMID: 36830815; PMCID: PMC9953060.
- Nishiyama A., Kitada K. Possible renoprotective mechanisms of SGLT2 inhibitors. Front. Med. (Lausanne). 2023. Vol. 10. P. 1115413. doi: 10.3389/fmed.2023.1115413. PMID: 36968844; PMCID: PMC10033659.
- Mancini S.J., Boyd D., Katwan O.J. et al. Canagliflozin inhibits interleukin-1β-stimulated cytokine and chemokine secretion in vascular endothelial cells by AMP-activated protein kinase-dependent and -independent mechanisms. Sci. Rep. 2018. Vol. 8. № 1. P. 5276. doi: 10.1038/s41598-018-23420-4. PMID: 29588466; –PMCID: PMC5869674.
- Li C., Zhang J., Xue M. et al. SGLT2 inhibition with empagliflozin attenuates myocardial oxidative stress and fibrosis in dia-betic mice heart. Cardiovasc. Diabetol. 2019. Vol. 18. № 1. P. 15. doi: 10.1186/s12933-019-0816-2. PMID: 30710997; PMCID: PMC6359811.

/52.jpg)