Журнал "Гастроэнтерология" Том 57, №4, 2023
Вернуться к номеру
Амінокислотний спектр тромбоцитів та мікробіом кишечника, їх зв’язок у пацієнтів з ішемічною хворобою серця та фібриляцією передсердь
Авторы: I.O. Melnychuk, M.L. Sharayeva, V.N. Kramarova, V.H. Lyzogub
Bogomolets National Medical University, Kyiv, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
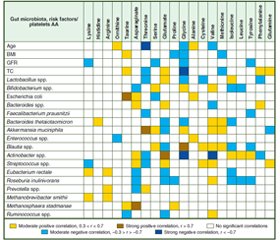
Актуальність. Мета роботи: виявити зв’язок між амінокислотним (АК) спектром тромбоцитів і складом мікробіоти кишечника в пацієнтів з ішемічною хворобою серця (ІХС) й фібриляцією передсердь (ФП) та оцінити його. Матеріали та методи. У дослідження було включено 300 пацієнтів. Їх розподілили на 3 групи: першу — 149 осіб з ІХС без аритмій, другу — 124 пацієнти з ІХС та пароксизмом ФП і контрольну групу — 27 пацієнтів без ІХС та аритмій. Рівень АК тромбоцитів визначали методом іонообмінної рідинної колонкової хроматографії. Склад кишкової мікробіоти оцінювали шляхом 16-S рРНК секвенування. Результати. У пацієнтів із ІХС та ФП було виявлено значне підвищення рівня ізолейцину (10,73 %), лейцину (12,63 %) і зниження рівня треоніну (23,05 %), серину (5,06 %), гліцину (32,21 %) і валіну (30,83 %) тромбоцитів (P < 0,05). Також зареєстровано збільшення кількості Bacteroides spp., Faecalibacterium prausnitzii, Actinobacter spp., Streptococcus spp., Ruminococcus spp. і зниження Lactobacillus spp., Bifidobacterium spp., Eubacterium rectale (Р < 0,05). Глутамінова кислота, валін, гліцин, аспарагінова кислота, треонін мали найвищу кількість значущих кореляцій зі складом кишкової мікробіоти (P < 0,05). Actinobacter spp., Blautia spp., Streptococcus spp., Akkermansia muciniphila та Roseburia inulinivorans мали найбільше значущих кореляцій з АК тромбоцитів (P < 0,05). Висновки. Амінокислотний спектр тромбоцитів і склад мікробіоти кишечника в пацієнтів з ішемічною хворобою серця та фібриляцією передсердь тісно пов’язані.
Background. The aim of our work was to identify the links between platelet amino acid (AA) spectrum and gut microbiota composition in patients with coronary artery disease (CAD) and atrial fibrillation (AF) and to evaluate them. Materials and methods. Three hundred patients were enrolled in the study. They were divided into 3 groups: I (CAD) — 149 patients with CAD but without arrhythmias, II (CAD + AF) — 124 people with CAD and AF paroxysm, and control group (CG) — 27 individuals without CAD and arrhythmias. Platelet AA level was assessed by method of ion-exchange liquid column chromatography. Gut microbiota composition was studied by 16-S rRNA sequencing. Results. A significant increase in isoleucine (10.73 %), leucine (12.63 %) and a decrease in threonine (23.05 %), serine (5.06 %), glycine (32.21 %) and valine (30.83 %) platelets levels was found in patients with CAD and AF (P < 0.05). In addition, they had a significant increase in Bacteroides spp., Faecalibacterium prausnitzii, Actinobacter spp., Streptococcus spp., Ruminococcus spp. and a decrease in Lactobacillus spp., Bifidobacterium spp., Eubacterium rectale (P < 0.05). Platelet glutamine acid, valine, glycine, asparagine acid, threonine had the highest number of significant correlations with gut microbiota species (P < 0.05). Actinobacter spp., Blautia spp., Streptococcus spp., Akkermansia muciniphila and Roseburia inulinivorans had the highest number of significant correlations with platelet amino acids (P < 0.05). Conclusions. Platelet amino acid spectrum and gut microbiota composition in patients with coronary artery disease and atrial fibrillation are closely linked.
ішемічна хвороба серця; фібриляція передсердь; амінокислоти; тромбоцити; склад мікробіоти кишечника
coronary artery disease; atrial fibrillation; amino acids; blood platelets; gut microbiota composition
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Hindricks G., Potpara T., Dagres N., et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021 Feb 1. 42(5). 373-498. doi: 10.1093/eurheartj/ehaa612.
- Knuuti J., Wijns W., Saraste A., et al. ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020 Jan 14. 41(3). 407-477. doi: 10.1093/eurheartj/ehz425.
- Michniewicz E., Mlodawska E., Lopatowska P., Tomaszuk-Kazberuk A., Malyszko J. Patients with atrial fibrillation and coronary artery disease — Double trouble. Advances in Medical Sciences [Internet]. 2018 Mar 1. 63(1). 30-5. Available from: https://www.ncbi.nlm.nih.gov/pubmed/28818746.
- Liu X., Yu S., Liang T., Chen L., Zhang H. Mean Platelet Volume to Platelet Count Ratio Predicts Left Atrial Stasis in Patients with Non-Valvular Atrial Fibrillation. Int J Gen Med. 2023 Mar 3. 16. 847-858. doi: 10.2147/IJGM.S395305.
- Li D., Li Y., Ding H., Wang Y., Xie Y., Zhang X. Cellular Senescence in Cardiovascular Diseases: From Pathogenesis to Thera–peutic Challenges. J Cardiovasc Dev Dis. 2023 Oct 23. 10(10). 439. doi: 10.3390/jcdd10100439.
- De Simone I., Baaten C.C.F.M.J., Gibbins J.M., et al. Repea–ted platelet activation and the potential of previously activated platelets to contribute to thrombus formation. J Thromb Haemost. 2023 May. 21(5). 1289-1306. doi: 10.1016/j.jtha.2023.01.006.
- Ishii M., Kaikita K., Yasuda S., et al. AFIRE Investigators. Risk prediction score for clinical outcome in atrial fibrillation and stable coronary artery disease. Open Heart. 2023 May. 10(1). e002292. doi: 10.1136/openhrt-2023-002292.
- Palmu J., Börschel C.S., Ortega-Alonso A., et al. Gut microbiome and atrial fibrillation — results from a large population-based study. EBioMedicine. 2023 May. 91. 104583. doi: 10.1016/j.ebiom.2023.104583.
- Al-Kaisey A.M., Figgett W., Hawson J., Mackay F., Joseph S.A., Kalman J.M. Gut Microbiota and Atrial Fibrillation: Pathogenesis, Mechanisms and Therapies. Arrhythm Electrophysiol Rev. 2023 Apr 19. 12. e14. doi: 10.15420/aer.2022.33.
- Rashid S., Noor T.A., Saeed H., et al. Association of gut microbiome dysbiosis with the progression of atrial fibrillation: A syste–matic review. Ann Noninvasive Electrocardiol. 2023 Jul. 28(4). e13059. doi: 10.1111/anec.13059. Epub 2023 Mar 20.
- Scopelliti F., Cattani C., Dimartino V., Mirisola C., Cavani A. Platelet Derivatives and the Immunomodulation of Wound Healing. Int J Mol Sci. 2022 Jul 28. 23(15). 8370. doi: 10.3390/ijms23158370.
- Duttaroy A.K. Role of Gut Microbiota and Their Metabolites on Atherosclerosis, Hypertension and Human Blood Platelet Function: A Review. Nutrients. 2021 Jan 3. 13(1). 144.
- Meeusen J.W., Kasozi R.N., Larson T.S., Lieske J.C. Clinical Impact of the Refit CKD-EPI 2021 Creatinine-Based eGFR Equation. Clin Chem. 2022 Mar 31. 68(4). 534-539. doi: 10.1093/clinchem/hvab282.
- Faizi Nafis, Yasir Alvi. Biostatistics Manual for Health Research. Elsevier: A Practical Guide to Data Analysis. Elsevier Science; 2023. 290 р.
- Chen D., Zhao X., Sui Z., et al. A multi-omics investigation of the molecular characteristics and classification of six metabolic syndrome relevant diseases. Theranostics. 2020 Jan 12. 10(5). 2029-2046. doi: 10.7150/thno.41106.
- Schütte J.P., Manke M.C., Hemmen K., et al. Platelet-Derived MicroRNAs Regulate Cardiac Remodeling After Myocardial Ischemia. Circ Res. 2023 Mar 31. 132(7). e96-e113. doi: 10.1161/CIRCRESAHA.122.322459.
- Xu Y., Jiang H., Li L., et al. Branched-Chain Amino Acid Catabolism Promotes Thrombosis Risk by Enhancing Tropomodulin-3 Propionylation in Platelets. Circulation. 2020 Jul 7. 142(1). 49-64. doi: 10.1161/CIRCULATIONAHA.119.043581.
- Ramos-Garcia V., Ten-Doménech I., Moreno-Giménez A., et al. GC-MS analysis of short chain fatty acids and branched chain amino acids in urine and faeces samples from newborns and lactating mothers. Clin Chim Acta. 2022 Jul 1. 532. 172-180. doi: 10.1016/j.cca.2022.05.005.
- Anderson G., Rodriguez M., Reiter R.J. Multiple Sclerosis: Melatonin, Orexin, and Ceramide Interact with Platelet Activation Coagulation Factors and Gut-Microbiome-Derived Butyrate in the Circadian Dysregulation of Mitochondria in Glia and Immune Cells. Int J Mol Sci. 2019 Nov 5. 20(21). 5500. doi: 10.3390/ijms20215500.
- Mesnage R., Grundler F., Schwiertz A., Le Maho Y., Wilhelmi de Toledo F. Changes in human gut microbiota composition are linked to the energy metabolic switch during 10 d of Buchinger fasting. J Nutr Sci. 2019 Nov 12. 8. e36. doi: 10.1017/jns.2019.33.
- Karolczak K., Guligowska A., Kostanek J., Soltysik B., Kostka T., Watala C. The amino acid content in the daily diet of seniors negatively correlates with the degree of platelet aggregation in a sex- and agonist-specific manner. Aging (Albany NY). 2022 Aug 19. 14(18). 7240-7262. doi: 10.18632/aging.204229.
- Rom O., Liu Y., Liu Z., et al. Glycine-based treatment ameliorates NAFLD by modulating fatty acid oxidation, glutathione synthesis, and the gut microbiome. Sci Transl Med. 2020 Dec 2. 12(572). eaaz2841. doi: 10.1126/scitranslmed.aaz2841.
- Nishikawa M., Shen L., Ogawa K. Taurine dioxygenase (tauD)-independent taurine assimilation in Escherichia coli. Microbiology (Reading). 2018 Nov. 164(11). 1446-1456. doi: 10.1099/mic.0.000723.
- Lubkowski J., Wlodawer A. Structural and biochemical pro–perties of L-asparaginase. FEBS J. 2021 Jul. 288(14). 4183-4209. doi: 10.1111/febs.16042.
- Miyata T., Mizushima T., Miyamoto N., et al. Skate-skin mucin, rich in sulfated sugars and threonine, promotes proliferation of Akkermansia muciniphila in feeding tests in rats and in vitro fermentation using human feces. Biosci Biotechnol Biochem. 2022 Feb 24. 86(3). 397-406. doi: 10.1093/bbb/zbac003.
- Kadyan S., Park G., Wang B., Nagpal R. Dietary fiber modulates gut microbiome and metabolome in a host sex-specific manner in a murine model of aging. Front Mol Biosci. 2023 Jun 15. 10. 1182643. doi: 10.3389/fmolb.2023.1182643.
- He H.Y., Ryan K.S. Glycine-derived nitronates bifurcate to O-methylation or denitrification in bacteria. Nat Chem. 2021 Jun. 13(6). 599-606. doi: 10.1038/s41557-021-00656-8.
- Khan I., Khan I., Jianye Z., et al. Exploring blood microbial communities and their influence on human cardiovascular disease. J Clin Lab Anal. 2022 Apr. 36(4). e24354. doi: 10.1002/jcla.24354.
- Ma Q., Mo X., Zhang Q., et al. Comparative metabolomic analysis reveals different evolutionary mechanisms for branched-chain amino acids production. Bioprocess Biosyst Eng. 2020 Jan. 43(1). 85-95. doi: 10.1007/s00449-019-02207-5.
- Jäger R., Mohr A.E., Carpenter K.C., et al. International Society of Sports Nutrition Position Stand: Probiotics. J Int Soc Sports Nutr. 2019 Dec 21. 16(1). 62. doi: 10.1186/s12970-019-0329-0.
- Zhai L., Wu J., Lam Y.Y., Kwan H.Y., Bian Z.X., Wong H.L.X. Gut-Microbial Metabolites, Probiotics and Their Roles in Type 2 Diabetes. Int J Mol Sci. 2021 Nov 27. 22(23). 12846. doi: 10.3390/ijms222312846.
- Ciszewski A., Jarosz Ł., Marek A., Michalak K., Grądzki Z., Kaczmarek B., Rysiak A. Effect of combined in ovo administration of zinc glycine chelate (Zn-Gly) and a multistrain probiotic on the modu–lation of cellular and humoral immune responses in broiler chickens. Poult Sci. 2023 Sep. 102(9). 102823. doi: 10.1016/j.psj.2023.102823.
- Hirayama S., Nakao R. Glycine significantly enhances bacterial membrane vesicle production: a powerful approach for isolation of LPS-reduced membrane vesicles of probiotic Escherichia coli. Microb Biotechnol. 2020 Jul. 13(4). 1162-1178. doi: 10.1111/1751-7915.13572.