Біль — це суб’єктивний досвід, на який впливають генетичні, гендерні, соціальні, культурні й особисті параметри. Найчастіше гострий біль виникає через травму, гострі захворювання або лікування. Між гострим болем і розладами настрою існує значущий двоспрямований зв’язок, так що обидва діють як фактори ризику один для одного. Депресія та тривога пов’язані з підвищеним сприйняттям тяжкості болю, тоді як тривалий гострий біль призводить до посилення дисрегуляції настрою. Саме біль може бути основною або єдиною скаргою пацієнтів з депресією, які звертаються до лікарень первинної медичної допомоги, однак клініцисти часто не помічають цього [1].
На відміну від гострого болю хронічний біль, який також називають тривалим або стійким, — це біль, що може зберігатися понад три місяці. Хронічний біль буває вторинним, тобто спричиненим основним захворюванням, і первинним, який не має чіткої патологічної основи, а біль (чи його вплив) може бути непропорційним наявній травмі чи захворюванню. Усі форми болю можуть спричинити страждання та інвалідність, але ці ознаки особливо виражені в проявах хронічного первинного болю. Ця настанова узгоджується з визначенням хронічного первинного болю за МКХ-11 [2].
Зв’язок між тривожними і депресивними розладами має не лише патофізіологічну кореляцію, але й клінічну. В одному з перших метааналізів, проведених для виявлення супутньої патології цих двох захворювань, було виявлено, що 58 % пацієнтів із депресією мали певний тип тривоги, супутній фактор, який виникав у 52,2 % випадків. І навпаки, наявність депресії в пацієнтів із тривогою становила 56 %.
Депресія і тривога часто супроводжуються безліччю хворобливих проявів, і навпаки, хворобливі прояви викликають або посилюють депресивну й тривожну симптоматику. Зв’язок між болем, порушеннями сну і когнітивними скаргами встановлює синдром, подібний до депресії, що ускладнює розпізнавання різних психопатологічних компонентів [3].
Приблизно кожен п’ятий дорослий відчуває сильний тривалий біль, і велика проблема полягає в тому, що уявлення про біль як синонім пошкодження тканин все ще домінують навіть серед медичних працівників. Тоді як біль є багатогранним явищем, і важливо, щоб медичні працівники не мали стереотипного підходу, а могли виконувати аналіз болю, який враховує багато його форм [4].
При веденні пацієнтів з больовим синдромом і тривожно-депресивними проявами важливо враховувати патогенетичні механізми формування і підтримки больового синдрому. Серед них безсумнівну і важливу роль відіграють порушена взаємодія ноцицептивної і антиноцицептивної систем і феномен дезінгібіції, який спостерігається при функціональній активності низхідних антиноцицептивних впливів. І чим довше існує і чим більше виражений цей патологічний процес, тим сильніший рецидивуючий біль може спостерігатися в пацієнта [10]. Основними медіаторами антиноцицептивної системи є біогенні аміни: ендорфіни, серотонін, норадреналін, тому лікарські засоби, які активізують і нормалізують їх обмін, підсилюють таким чином функціональну активність антиноцицептивної системи, що призводить до зниження інтенсивності й частоти виникнення болю, а також впливає на тривожну й депресивну симптоматику.
Результати численних мультицентрових плацебо-контрольованих досліджень свідчать про те, що базовими препаратами в лікуванні як депресії і тривоги, так і хронічних больових синдромів є антидепресанти [5, 6]. Виявлено, що зазначені препарати можуть бути ефективними при найрізноманітнішій локалізації хронічного болю (біль у спині, остеоартрити (ОА), фіброміалгії (ФМ)). Серед антидепресантів найефективнішими є препарати, які здатні модулювати низхідні серотонінергічні й норадренергічні антиноцицептивні шляхи. До них належить клас селективних інгібіторів зворотного захоплення серотоніну і норадреналіну, що обумовлює їх більш виражений ефект порівняно з іншими антидепресантами при лікуванні больового синдрому і симптомів тривоги та депресії [6, 7].
Дулоксетин є найбільш збалансованим потужним інгібітором зворотного захоплення серотоніну й норадреналіну. Відновлення за допомогою дулоксетину балансу між серотонінергічною і норадренергічною медіацією відіграє найважливішу роль у лікуванні депресії і болю з урахуванням ролі дисбалансу цих медіаторів у формуванні емоційних і больових розладів [7–9].
Це також демонструють клінічні дослідження, у яких показано, що дулоксетин впливає на біль так само ефективно, як і на соматичні симптоми депресії [7–9].
Доведена ефективність і безпека дулоксетину в лікуванні фіброміалгії
Фіброміалгія є хронічним больовим синдромом, який важко піддається лікуванню. Цей стан характеризується дифузним болем тривалістю понад 3 місяці в різних ділянках тіла і наявністю болю в 11 з 18 болючих точок. Крім того, при фіброміалгії спостерігаються ригідність, підвищена стомлюваність, сон, що не приносить почуття відпочинку, депресія, тривожність і когнітивні порушення [11, 12]. Поширеність ФМ у популяції варіює від 5 до 12 %, співвідношення жінок і чоловіків становить 3 : 1 [17].
Пацієнти з ФМ демонструють більш значну поширеність депресивних і тривожних розладів, про які повідомляється в 20–80 і 13–63,8 % випадків відповідно. Поширеність депресії в пацієнтів з ФМ протягом життя становить 74 %, а тривожного розладу — 60 %, при цьому на момент встановлення діагнозу приблизно в 30 % пацієнтів з ФМ спостерігається тяжка депресія [13]. Тому при лікуванні пацієнтів з ФМ дуже важливо оцінити наявність коморбідних розладів і ефективно їх лікувати [18].
Дулоксетин — це оптимальний вибір у пацієнтів з больовим синдромом, асоційованим з ФМ, як за наявності депресії, так і без неї, що було продемонстровано в багатьох клінічних рандомізованих дослідженнях. Не випадково він увійшов до стандартів лікування фіброміалгії Європейської ліги ревматологів (EULAR, 2017) [25].
Кохранівський огляд [14], який включав 6 досліджень і 2249 пацієнтів з фіброміалгією, продемонстрував вірогідний позитивний ефект при застосуванні дулоксетину в добовій дозі 60 мг протягом 12 тижнів (відносний ризик (ВР) для ≥ 50% зменшення болю — 1,57; 95% довірчий інтервал (ДІ) від 1,20 до 2,06) і понад 28 тижнів (ВР 1,58; 95% ДІ від 1,10 до 2,27), а також його значущий вплив на фізичні симптоми депресії (ВР 1,37; 95% ДІ від 1,19 до 1,59; NNTB 8, 95% ДІ від 5 до 14). При цьому більшість побічних ефектів були незначними, серйозні небажані явища не відзначалися [14].
У систематичному огляді була проведена оцінка аналгетичної ефективності дулоксетину при фіброміалгії, а також визначалося, яке дозування між 60 і 120 мг/день було більш придатним для клінічного застосування. У цей метааналіз включалося сім досліджень і 2642 пацієнти з ФМ [15]. Результати аналізу показали, що дулоксетин може викликати більше полегшення болю при ФМ, ніж плацебо (стандартизована різниця середніх значень (SMD) –0,26; 95% ДІ від –0,37 до –0,16). Коефіцієнт ризику (ВР) полегшення болю щонайменше на 30 % становив 1,31 (95% ДІ від 1,19 до 1,44); ВР полегшення болю щонайменше на 50% становив 1,46 (95% ДІ від 1,28 до 1,67).
Небажані явища частіше спостерігалися в пацієнтів, які приймали дулоксетин, ніж у хворих, які отримували плацебо (ВР 1,17; 95% ДІ від 1,12 до 1,23). Дулоксетин у дозі 120 мг/добу мав більш високу частоту відміни (ВР 0,96; 95% ДІ від 0,80 до 1,15), ніж дулоксетин у дозі 60 мг/добу (ВР 0,77; 95% ДІ від 0,63 до 0,93).
Автори дослідження дійшли висновку, що дулоксетин — це відмінний вибір для полегшення болю при ФМ. Дулоксетин у дозі 60 мг/добу викликав меншу частоту відміни препарату, ніж дулоксетин у дозі 120 мг/добу.
Порівняльна ефективність амітриптиліну, дулоксетину й прегабаліну для зниження інтенсивності болю на 30 % (R30%) і 50 % (R50%) при фіброміалгії в дорослих була досліджена в метааналізі F.F. Alberti et al. [16]. У ньому були проаналізовані 15 клінічних досліджень, у яких порівнювали амітриптилін (n = 273), дулоксетин (n = 2595) і прегабалин (n = 3506) з плацебо. Для результату R30% прегабалін у дозі 450 мг перевершував дулоксетин 30 мг і прегабалін 150 мг, а дулоксетин 20мг і 30 мг перевершував плацебо. За результатом R50% найкращим був амітриптилін у дозі 25 мг.
Отже, всі оцінені препарати показали переваги в зменшенні болю в пацієнтів з фіброміалгією. Прегабалін 450 мг був кращим варіантом для R30%, а амітриптилін 25 мг — для R50%.
Дулоксетин для лікування хронічного больового синдрому при остеоартриті
Остеоартрит є найчастішим захворюванням суглобів, його провідним проявом є хронічний біль, клінічний аналіз якого нерідко демонструє характерні сенсорні прояви невропатичного болю [20].
Плацебо-контрольовані рандомізовані дослідження довели ефективність дулоксетину при ОА, при якому центральна сенсибілізація є одним із ключових механізмів, що лежить в основі болю.
У дослідженні [22] була проведена оцінка ефективності 8-тижневого лікування дулоксетином порівняно зі звичайним лікуванням у пацієнтів з термінальною стадією ОА колінного і тазостегнового суглоба. Пацієнти були рандомізовані в групи дулоксетину або звичайного лікування. Первинною кінцевою точкою був біль у колінному або тазостегновому суглобі, виміряний за шкалою болю в ділянці коліна (KOOS) або шкалою інвалідності стегна (HOOS).
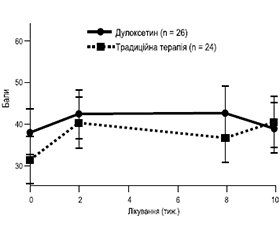
Було рандомізовано 111 пацієнтів. Після прийому дулоксетину майже 44 % почували себе набагато краще порівняно з 0 % у групі, яка отримувала звичайну терапію (р < 0,001). Група прийому дулоксетину набрала на 11,3 бала (95% ДІ від 5,8 до 16,8) кращі результати за шкалою KOOS/HOOS (p < 0,001) (рис. 1).
Стан пацієнтів з ОА колінного суглоба покращився значно більше, ніж пацієнтів з ОА тазостегнового суглоба, — на 18,7 бала [95% ДІ від 11,3 до 26,1] проти 6,0 [95% ДІ від –2,6 до 14,5] відповідно (рис. 2, 3).
У подвійному сліпому плацебо-контрольованому дослідженні H. Enomoto et al. [19] було показано, що застосування дулоксетину в пацієнтів із хронічним болем при ОА колінного суглоба призводить до більш значущого зменшення вираженості болю і поліпшення показників якості життя порівняно з плацебо незалежно від того, які саме нестероїдні протизапальні препарати (НПЗП) застосовувалися раніше.
На думку дослідників, дулоксетин може розглядатися як альтернатива застосуванню НПЗП при ОА колінного суглоба, якщо їх використання не показано у зв’язку з наявними кардіоваскулярними або іншими ризиками. Ефективність дулоксетину в зменшенні болю і поліпшенні функціонування при ОА також підтверджує системний огляд 4 рандомізованих досліджень [20]. У метааналізі 3 РКД [18] за участю 1011 пацієнтів було продемонстровано статистично значущий вплив дулоксетину на рівень і частоту виникнення болю при ОА, поліпшення функціональної активності, а також відсутність значущих небажаних або побічних явищ.
В іншому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні [28] пацієнтів з ОА колінних суглобів показано вірогідне зменшення болю, скутості, функціональної недостатності і поліпшення якості життя на тлі прийому дулоксетину протягом 14 тижнів. У рекомендаціях Міжнародного товариства з вивчення остеоартриту OARSI (Osteoarthritis Research Society International) 2019 р. дулоксетин розглядається як терапія ОА колінного суглоба в пацієнтів з поширеним хронічним больовим синдромом і депресивними порушеннями [26].
Застосування дулоксетину при хронічному больовому синдромі в нижній частині спини
Біль у нижній частині спини продовжує залишатися однією з найбільш актуальних проблем сучасної людини і частою причиною звернення до лікаря. Серед пацієнтів з хронічним болем у нижній частині спини (ХБНС) ознаки невропатичного болю спостерігаються в середньому в 37 % випадків [21], однак низький рівень діагностики невропатичного болю, що спостерігається в клінічній практиці, свідчить, що цей відсоток набагато більший.
Аналіз даних 4 багатоцентрових подвійних сліпих рандомізованих плацебо-контрольованих досліджень застосування дулоксетину для лікування ХБНС у 1295 пацієнтів у добовій дозі 60 мг протягом 12–14 тижнів показав найбільшу ефективність даного препарату, що виражалося в збільшенні кількості пацієнтів, у яких спостерігалося зниження рівня болю на 30 % і більше на момент завершення лікування відносно вихідного рівня (59,7 % порівняно з 47,8 % у групі плацебо, р<0,001), а також у більшому зниженні ступеня вираженості болю— на 50 % і більше (48,6 % порівняно з групою плацебо — 35,1 %; р < 0,001) [21]. Предикторами найбільшої ефективності дулоксетину, на думку дослідників, були рання відповідь на терапію — у перші 2 тижні від її початку (поліпшення не менше ніж на 15 % згідно з коротким опитувальником щодо тяжкості болю (BPI)), застосування в добовій дозі 60 мг і наявність болю в декількох ділянках.
У систематичному огляді T. Hirase et al. [23] визначались ефективність і безпека дулоксетину при хронічних болях у попереку (ХБП). Огляд включав усі рандомізовані контрольовані дослідження I і II рівнів, опубліковані англійською мовою, у яких досліджувалась ефективність дулоксетину при хронічних болях у попереку. Було проаналізовано п’ять досліджень (832 пацієнти, які приймали дулоксетин, 667 пацієнтів, які приймали плацебо, і 41 пацієнт, яких було переведено з плацебо на дулоксетин). Одне дослідження мало рівень доказовості I, а чотири дослідження — рівень доказовості II.
У всіх п’яти дослідженнях повідомлялося про статистично значуще поліпшення хоча б за одним показником клінічних результатів, пов’язаних з болями в спині, при прийомі дулоксетину порівняно з плацебо. Чотири дослідження показали, що дулоксетин у дозі 60 мг на добу призводить до одного або декількох статистично значущих поліпшень порівняно з плацебо за показниками короткої шкали тяжкості болю (BPI-S).
Усі п’ять досліджень не виявили суттєвих відмінностей у частоті серйозних побічних явищ (ПЯ) між групами дулоксетину і плацебо. Лише в одному дослідженні був виявлений більш високий рівень загальної кількості ПЯ в групі дулоксетину в дозі 120 мг порівняно з групою плацебо; однак у цьому ж дослідженні не було виявлено суттєвих відмінностей у загальній кількості ПЯ в групах дулоксетину в дозі 20 і 60 мг порівняно з плацебо.
Автори огляду дійшли висновку, що дулоксетин є безпечним та ефективним препаратом першої лінії для лікування ХБП. Сучасні дослідження показують, що прийом препарату в дозі 60 мг один раз на день має найвищу ефективність у зменшенні болю та інвалідності, мінімізуючи незначні побічні ефекти [23].
Згідно з практичними рекомендаціями Американської колегії лікарів (ACP) для пацієнтів із хронічним болем у попереку, які мають неадекватну реакцію на немедикаментозну терапію, лікарі повинні розглянути можливість фармакологічного лікування нестероїдними протизапальними препаратами як терапію першої лінії, як терапію другої лінії — трамадол або дулоксетин [24].
Дулоксин — ефективний і безпечний препарат дулоксетину в Україні
Один з препаратів дулоксетину, який наявний сьогодні на фармацевтичному ринку України, зареєстрований під торговою назвою Дулоксин® (АСINO, Україна). Він випускається в капсулах і наявний у двох дозуваннях — 30 і 60 мг, що дозволяє раціонально використовувати його при титруванні дози і виборі необхідної добової дози в процесі терапії і при її поступовому завершенні. Показання до його застосування: лікування великих депресивних розладів, діабетичного периферичного нейропатичного болю і генералізованих тривожних розладів [27].
Висновки
— Пацієнт з больовим синдромом завжди становить для лікарів непросте клінічне завдання, що пов’язано з наявністю різноманітної коморбідної патології, зокрема тривожних і депресивних порушень. Це пояснюється спільністю патогенезу даних захворювань, в основі яких лежить дефіцит серотоніну і норадреналіну.
— Механізм дії дулоксетину при лікуванні депресії полягає в пригніченні зворотного захоплення серотоніну і норадреналіну, у результаті чого підвищується серотонінергічна й норадренергічна нейротрансмісія в центральній нервовій системі. Завдяки підвищенню рівня серотоніну і норадреналіну в ЦНС також підвищується функціональна активність низхідної системи пригнічення болю і поріг больової чутливості, що забезпечує знеболювальну дію препарату.
— Дулоксетин увійшов до стандартів лікування хронічного болю в спині Американського коледжу лікарів (АСР, 2017), стандартів лікування фіброміалгії Європейської ліги ревматологів (EULAR, 2017) і стандартів лікування болю при остеоартриті колінного суглоба Міжнародного дослідницького товариства остеоартриту (OARSI, 2019).
— Результати численних рандомізованих конт-рольованих досліджень демонструють ефективність і безпеку дулоксетину для лікування фіброміалгії, остеоартриту колінного та тазостегнового суглоба, болю в нижній частині спини. Призначення дулоксетину дозволяє не тільки зменшити біль, але і значимо вплинути на супутні тривожні, депресивні розлади і порушення сну в цієї категорії пацієнтів.
Список литературы
1. Michaelides А., Zis Р. Depression, anxiety and acute pain: links and management challenges. Postgrad Med. 2019 Sep. 131(7). 438-444. doi: 10.1080/00325481.2019.1663705. https://pubmed.ncbi.nlm.nih.gov/31482756.
2. Chronic pain (primary and secondary) in over 16s: assessment of all chronic pain and management of chronic primary pain. NICE Guideline. 2021. https://www.nice.org.uk/guidance/ng193/chapter/recommendations#chronic-pain.
3. Arango-Dávila С.А., Rincón-Hoyos H.G.. Depressive Disorder, Anxiety Disorder and Chronic Pain: Multiple Manifestations of a Common Clinical and Pathophysiological Core. Rev. Colomb Psiquiatr (Engl Ed). 2018 Jan-Mar. 47(1). 46-55. https://pubmed.ncbi.nlm.nih.gov/29428122.
4. Bäckryd Е., Alföldi Р. Chronic pain and its relationship with anxiety and depression. Lakartidningen. 2023. 120. 23010. https://pubmed.ncbi.nlm.nih.gov/37291900.
5. Detke M.J., Lu Y., Goldstein D.J. et al. Duloxetine, 60 mg once daily, for major depressive disorder: A randomized double-blind placebo-controlled trial. J. Clin. Psychiatry. 2002. Vol. 63. Р. 8-15.
6. Zilliox L.A. Neuropathic pain. Continuum. 2017. 23(2). 512-532. DOI: 10.1212/CON.0000000000000462.
7. Fava М., Mallinckrodt С.Н., Detke M.J. et al. The effect of duloxetine on painful physical symptoms in depressed patients: Do improvements in these symptoms result in higher remission rates. J. Clin. Psychiatry. 2004. Vol. 65. № 4. Р. 521-530.
8. Barkin R.L. The role of venlafaxine and duloxetine in the treatment of depression with decremental changes in somatic symptoms of pain, chronic pain, and the pharmacokinetics and clinical considerations of duloxetine pharmacotherapy. Am. J. Ther. 2005. Vol. 12. № 5. Р. 431-438.
9. Briley M. Clinical experience with dual action antidepressants in different chronic pain syndromes. Hum. Psychopharmacol. 2004. Vol. 1. Р. 21-25.
10. Schwenkreis P., Scherens A., Rönnau A.K. et al. Cortical disinhibition occurs in chronic neuropathic, but not in chronic nociceptive pain. BMC Neuroscience. 2010. 11. 73. DOI: 10.1186/1471-2202-11-73.
11. Mease P. Fibromyalgia syndrome: review of clinical presentation, pathogenesis, outcome measures, and treatment. J. Rheumatol. 2005. 32 Suppl. 75. 6-21.
12. Goldenberg D.L., Burckhardt C., Crofford L. Management of fibromyalgia syndrome. JAMA. 2004. 292(19). 2388-95.
13. Buskila D., Cohen H. Comorbidity of fibromyalgia and psychiatric disorders. Current Pain and Headache Reports. 2007. 11(5). 333-338. https://doi.org/10.1007/s11916-007-0214-4.
14. Lunn M.P.T., Hughes R.A.C., Wiffen P.J. Duloxetine for treating painful neuropathy, chronic pain or fibramyalgia. Cochrane Database of Systematic Reviews. 2014. 1. CD007115.pub3. DOI: 10.1002/14651858.CD007115.pub3.
15. Lian Y.-N., Wang Y., Zhang Y., Yang C.-X. Duloxetine for pain in fibromyalgia in adults: a systematic review and a meta-analysis. Int. J. of Neuroscience. 2020. Vol. 130. Issue 1.
16. Alberti F.F., Becker M.W., Blatt C.R., Ziegelmann P.K., da Silva Dal Pizzol T., Pilge D. Comparative efficacy of amitriptyline, duloxetine and pregabalin for treating fibromyalgia in adults: an overview with network meta-analysis. Clin. Rheumatol. 2022. 41(7). 1965-1978. doi: 10.1007/s10067-022-06129-8.
17. Arnold L.M., Bennett R.M., Crofford L.J. et al. AAPT Diagnostic Criteria for Fibromyalgia. The Journal of Pain. 2019. 20(6). 611-628. https://doi.org/10.1016/j.jpain.2018.10.008.
18. Вradley L.A. Psychiatric comorbidity in fibromyalgia. Current Pain and Headache Reports. 2005. 9(2). 79-86. https://doi.org/10.1007/s11916-005-0042-3.
19. Enomoto H., Fujikoshi S., Tsuji T. et al. Efficacy of duloxetine by prior NSAID use in the treatment of chronic osteoarthritis knee pain: A post hoc subgroup analysis of a randomized, placebo-controlled, phase 3 study in Japan. J. of Orthopaedic Science. 2018. 23. 1019-1026. DOI: 10.1016/j.jos.2018.07.008.
20. Weng C., Xu J., Wang Q. et al. Efficacy and safety of duloxetine in osteoarthritis or chronic low back pain: a systematic review and meta-analysis. Osteoarthritis Cartilage. 2020. 28(6). 721-734. DOI: 10.1016/j.joca.2020.03.001.
21. Alev L., Fujikoshi S., Yoshikawa A. et al. Duloxetine 60 mg for chronic low back pain: post hoc responder analysis of double-blind, placebo-controlled trials. J. of Pain Research. 2017. 10. 1723-1731. DOI: 10.2147/JPR.S138297.
22. Blikman T., Rienstra W., van Raaij T.M., Ten Hagen A.J., Dijkstra B., Zijlstra W.P., Bulstra S.K., Stevens M., van den Akker-Scheek I. Duloxetine in OsteoArthritis (DOA) study: effects of duloxetine on pain and function in end-stage hip and knee OA — a pragma-tic enriched randomized controlled trial. BMC Musculoskelet. Disord. 2022. 23(1). 115. doi: 10.1186/s12891-022-05034-0.
23. Hirase T., Hirase J., Ling J., Kuo P.H., Hernandez G.A., Giwa K., Marco R. Duloxetine for the Treatment of Chronic Low Back Pain: A Systematic Review of Randomized Placebo-Controlled Trials. Cureus. 2021. 13(5). e15169. doi: 10.7759/cureus.15169.
24. Qaseem A., Wilt T.J., McLean R.M., Forciea M.A. et al. No-ninvasive Treatments for Acute, Subacute, and Chronic Low Back Pain: A Clinical Practice Guideline from the American College of Physicians. Ann. Intern. Med. 2017. 166(7). 514-530. doi: 10.7326/M16-2367.
25. Macfarlane G.J., Kronisch C., Dean L.E. еt al. EULAR revised recommendations for the management of fibromyalgia. BMJ Journals. 2017. Vol. 76. Р. 318-328.
26. Bruyère O., Honvo G., Veronese N. et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Seminars in Arthritis and Rheumatism. 2019. 49(3). 337-350. DOI: 10.1016/j.semarthrit.2019.04.008.
27. Дулоксин. Інструкція із застосування. https://compendium.com.ua/info/353914.
28. Uchio Y., Enomoto H., Alev L. et al. A randomized, double-blind, placebo controlled Phase III trial of duloxetine in Japanese patientswith knee pain due to osteoarthritis. J. of Pain Research. 2018. 11. 809-821. DOI: 10.2147/JPR.S164128.
UA-DULO-PUB-102023-018
/31_2.jpg)

/31.jpg)