Архив офтальмологии Украины Том 12, №1, 2024
Вернуться к номеру
Прогностична оцінка впливу хемокіну CD54 на перебіг діабетичної ретинопатії
Авторы: Рибачук О.В.
Інститут післядипломної освіти, Національний медичний університет імені О.О. Богомольця МОЗ України, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
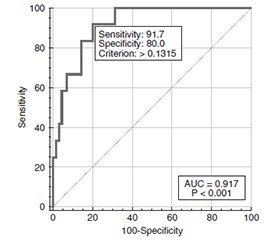
Актуальність. Клінічні дослідження свідчать про збільшення рівня прозапальних цитокінів, хемокінів, фактора росту ендотелію судин і молекул адгезії як у системному, так і в локальному середовищі в пацієнтів з діабетичними ушкодженнями сітківки. Повідомляється про експресію судинних клітинних молекул адгезії при діабетичній ретинопатії (ДР). На сьогодні прогностична оцінка різних адгезивних молекул, зокрема молекули міжклітинної адгезії (Cluster of Differentiation, CD54), у хворих із ДР обмежена недостатньою кількістю опублікованих даних. Мета роботи полягала в розробці математичної моделі оцінки ризику прогресування діабетичної ретинопатії у хворих на цукровий діабет 2-го типу за участі CD54. Матеріали та методи. Проведено відкрите одноцентрове одномоментне вибіркове спостережне дослідження із залученням дорослих хворих на ЦД 2-го типу і ДР. Дослідження проведено в 132 осіб, з них пацієнтів із ДР було 82 (148 очей) (чоловіків — 28, жінок — 54, середній вік — 64,41 ± 1,18 року (min — 25, max — 84), середній стаж діабету — 15,54 ± 0,83 року (min — 1, max — 35), середній рівень HbA1c — 9,17 ± 0,22 % (min — 5,4, max — 16,5)). Офтальмологічне обстеження включало візометрію, периметрію, рефрактометрію, тонометрію, біомікроскопію, гоніоскопію, офтальмоскопію, оптичну когерентну томографію. Концентрацію CD54 у сироватці крові визначали імуноферментним аналізом. Статистичний аналіз включав однофакторний і багатофакторний дисперсійний аналіз і регресійний аналіз. Використовували параметричний F-критерій Фішера або непараметричний критерій Крускала — Уолліса. Адекватність розрахованої моделі оцінювалася методом побудови кривої операційних характеристик (Receiver Operating Characteristic curve — ROC-кривої) за площею під кривою (Area Under the Curve — AUC), розраховували 95% довірчий інтервал (ДІ). Відмінності вважали статистично значущими при р < 0,05. Результати. Виявлено вірогідне збільшення концентрації CD54 у сироватці крові в групі хворих на ЦД 2-го типу і ДР порівняно з контролем (р < 0,001). Показано, що при стандартизації за концентрацією CD54 у сироватці крові, рівнем HbA1c, видом цукрознижувальної терапії виявлено вірогідне зниження (p = 0,006) ризику проліферативної стадії ДР при зростанні гостроти зору на кожні 0,1 од. (СШ = 0,45 (95% ДІ 0,25–0,79)). Висновки. Чутливість розрахованої математичної моделі оцінки ризику прогресування діабетичної ретинопатії у хворих на цукровий діабет 2-го типу становить 91,7 % (95% ДІ 61,5–99,9 %), специфічність — 80,0 % (95% ДІ 68,74–88,6 %).
Background. Clinical studies indicate increasing levels of pro-inflammatory cytokines, chemokines, vascular endothelial growth factor and adhesion molecules both in the systemic and local environment in patients with diabetic retinal damage. The expression of vascular cell adhesion molecules in diabetic retinopathy (DR) is reported. Currently, the prognostic assessment of various adhesion molecules, in particular the intercellular adhesion molecule (cluster of differentiation 54, CD54) in patients with DR is limited by few published data. The aim of thіs work was to develop a mathematical model for assessing the risk of DR progression in patients with type 2 diabetes (T2D) with the CD54 participation. Materials and methods. An open observational study was conducted among adult patients with T2D and DR. Limitations: the study was single-center and did not have a large sample size. Second, CD54 concentrations were tested only in serum, but not in aqueous humor or vitreous body. The inclusion of patients in groups with DR occurred in accordance with the 2019 ETDRS protocol. The main exclusion criteria were type 1 diabetes mellitus. Research methods: visometry, Humphrey perimetry, refractometry, tonometry, biomicroscopy, gonioscopy, ophthalmoscopy, optical coherence tomography, including in Angio mode, photography of the fundus with a fundus camera. The study was conducted in 132 people, 82 of them (148 eyes) had DR (28 men and 54 women, with an average age of 64.41 ± 1.18 years (min 25, max 84), average duration of diabetes 15.54 ± 0.83 years (min 1, max 35), average HbA1c level of 9.17 ± 0.22 % (min 5.4, max 16.5). The concentration of CD54 in blood serum was determined by enzyme immunoassay. Statistical analysis included ANOVA and multivariate analysis of variance, regression analysis. Fisher’s parametric F-test or the Kruskal-Wallis non-parametric test were used. The adequacy of the calculated model was assessed by constructing the receiver operating characteristic (ROC) curve based on the area under the ROC curve; the 95% confidence interval (CI) was calculated. Differences were considered statistically significant at p < 0.05. Results. A statistically significant increase in the serum CD54 was revealed in the patients with T2D and DR compared to the controls (p < 0.001). It was shown that when standardized by the concentration of CD54 in the blood serum, the level of HbA1c, and the type of hypoglycemic therapy, a statistically significant decrease (p = 0.006) was found in the risk of the proliferative stage of DR for each 0.1 unit of increasing visual acuity (OR = 0.45; 95% CI 0.25–0.79). The obtained multifactorial model was represented by the appropriate mathematical formula. Conclusions. Serum concentration of CD54 in patients with type 2 diabetes and diabetic retinopathy is statistically significantly higher compared to the controls (p < 0.001). The sensitivity of the calculated mathematical model for assessing the risk of progression of diabetic retinopathy in patients with type 2 diabetes is 91.7 % (95% CI 61.5–99.9 %), the specificity is 80.0 % (95% CI 68.74–88.6 %) (p = 0.006).
діабетична ретинопатія; цукровий діабет 2-го типу; CD54; математична модель
diabetic retinopathy; type 2 diabetes; CD54; mathematical model
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- IDF Diabetes Atlas. www.diabetesatlas.org (accessed on 2 March 2023).
- Solomon SD, Chew E, Duh EJ et al. Diabetic Retinopathy: A Position Statement by the American Diabetes Association. Dia–betes Care. 2017 Mar;40(3):412-418. https://doi.org/10.2337/dc16-2641.
- The American Diabetes Association (ADA). Standards of Care in Diabetes. 12. Retinopathy, Neuropathy, and Foot Care: Standards of Care in Diabetes — 2024. Diabetes Care. 2024;47 (Suppl. 1):S231-S243. https://doi.org/10.2337/dc24-S012.
- Kang Q, Yang C. Oxidative stress and diabetic retinopathy: molecular mechanisms, pathogenetic role and therapeutic implications. Redox Biol. 2020;37:101799. DOI: 10.1016/j.redox.2020.101799.
- Nippert AR, Newman EA. Regulation of blood flow in diabetic retinopathy. Vis Neurosci. 2020;37:E004. DOI: 10.1017/S0952523820000036.
- Ghonaim MM, El-Edel RH. Circulating cell adhesion molecules (sICAM-1 and sVCAM-1) and microangiopathy in diabetes mellitus. Ibnosina J Med BioMed Sci. 2015;7(6):211-8. doi: 10.4103/1947-489X.210287.
- Jain A, Saxena S, Khanna VK, Shukla RK, Meyer CH. Status of serum VEGF and ICAM-1 and its association with external limiting membrane and inner segment-outer segment junction disruption in type 2 diabetes mellitus. Mol Vis. 2013 Aug 4;19:1760-8. PMID: 23922493; PMCID: PMC3733909.
- Meleth AD, Agrón E, Chan CC, Reed GF, Arora K, Byrnes G et al. Serum inflammatory markers in diabetic retinopathy. Invest Ophthalmol Vis Sci. 2005;46:4295-301. DOI: 10.1167/iovs.04-1057.
- Kyryliuk M, Іshchenko V. Pathogenesis of diabetic retino–pathy: a literature review. International Journal of Endocrinology (Ukraine). 2019;15(7):567-575. https://doi.org/10.22141/2224-0721.15.7.2019.186061/
- Netrebin L, Pankiv V, Kyryliuk M. Mathematical model for assessing the prognostic significance of 25(OH)D deficiency in the progression of diabetic retinopathy in type 2 diabetes patients. International Journal of Endocrinology (Ukraine). 2023;19(4):269-273. https://doi.org/10.22141/2224-0721.19.4.2023.1284.
- Kyryliuk ML, Mogilevskyy SYu, Serdiuk VM. Evaluation of the Prognostic Significance of Adipose Tissue Hormones in the Develop–ment of Diabetic Retinopathy in Patients With Type 2 Diabetes Mellitus. Journal of the Endocrine Society. 2021;5(Suppl. 1):A412-A413. https://doi.org/10.1210/jendso/bvab048.841.
- Solomon SD, Goldberg MF. ETDRS Grading of Diabetic Re–tinopathy: Still the Gold Standard? Ophthalmic Res. 2019;62(4):190-195. https://doi.org/10.1159/000501372.
- Гур’янов В.Г., Лях Ю.Є., Парій В.Д., Короткий О.В., Чалий О.В., Чалий К.О., Цехмістер Я.В. Посібник з біостатистики. Аналіз результатів медичних досліджень у пакеті EZR (R-statistics). К.: Вістка, 2018. 208 с.
- Ruopp MD, Perkins NJ, Whitcomb BW, Schisterman EF. Youden Index and Optimal Cut-Point Estimated from Observations Affected by a Lower Limit of Detection. Biom J. 2008 Jun;50(3):419-430. doi: 10.1002/bimj.200710415.
- Nowak M, Wielkoszyński T, Marek B, Kos-Kudła B, Świętochowska E, Siemińska L et al. Blood serum levels of vascular cell adhesion molecule (sVCAM-1), intercellular adhesion molecule (sICAM-1) and endothelial leucocyte adhesion molecule-1 (ELAM-1) in diabetic retinopathy. Clin Exp Med. 2008;8:159-64. DOI: 10.1007/s10238-008-0173-z.
- Khalfaoui T, Lizard G, Ouertani-Meddeb A. Adhesion molecules (ICAM-1 and VCAM-1) and diabetic retinopathy in type 2 diabetes. J Mol Histol. 2008;39:243-9. doi: 10.1007/s10735-007-9159-5.
- El-Asrar A.M.A., Nawaz M.I., Kangave D. et al. High-mobility group box-1 and biomarkers of inflammation in the vitreous from patients with proliferative diabetic retinopathy. Molecular Vision. 2011;17:829-1838. PMID: 21850157.
- van Hecke MV, Dekker JM, Nijpels et al. Inflammation and endothelial dysfunction are associated with retinopathy: the Hoorn study. Diabetologia. 2005;48:1300-6. doi.org/10.1007/s00125-005-1799-y.
- Siddiqui K, George TP, Mujammami M, Isnani A, Alfadda AA. The association of cell adhesion molecules and selectins (VCAM-1, ICAM-1, E-selectin, L-selectin, and P-selectin) with microvascular complications in patients with type 2 diabetes: A follow-up study. Front Endocrinol. 2023;14:1072288. doi: 10.3389/fendo.2023.1072288.
- Zheng H, Sun W, Zhang Q, Zhang Y, Ji L, Liu X et al. Proinflammatory cytokines predict the incidence of diabetic peripheral neuropathy over 5 years in Chinese type 2 diabetes patients: A prospective cohort study. E Clinical Med. 2020;31:100649. doi: 10.1016/j.eclinm.2020.100649.