Журнал «Травма» Том 25, №3, 2024
Вернуться к номеру
Напруженість стресорних реакцій у пацієнтів з остеоартрозом та супутньою кардіальною патологією при операції ендопротезування кульшового суглоба
Авторы: Бур’янов О.А. (1), Вако Д.І. (1, 2)
(1) - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) - ДУ «Інститут серця МОЗ України», м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
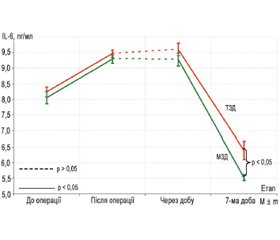
Актуальність. Тотальне ендопротезування кульшового суглоба (ТЕКС) є однією з найбезпечніших і найефективніших ортопедичних операцій, але за ризиком ускладнень посідає одне з провідних місць в ортопедії. Тому вибір оптимального виду хірургічного доступу має велике значення для хворих із поєднаною кардіальною патологією. Мета дослідження — порівняння особливостей напруженості стресорних реакцій у періопераційному періоді на фоні оцінки функціонування кульшового суглоба в пацієнтів з остеоартрозом та супутньою кардіальною патологією при операції тотального ендопротезування кульшового суглоба залежно від виду хірургічного доступу. Матеріали та методи. Проаналізовано результати лікування 90 пацієнтів з остеоартрозом кульшового суглоба та супутньою кардіальною патологією після операції тотального цементного ендопротезування кульшового суглоба. Усіх пацієнтів було поділено на 2 групи відповідно до методу хірургічного доступу: задній традиційний (група 1 — 35 пацієнтів) і задній модифікований (група 2 — 55 пацієнтів). Визначали рівні інсуліну, кортизолу, глюкози, IL-6 та TNF-α у сироватці крові перед оперативним втручанням, безпосередньо після оперативного втручання, через 24 години і через тиждень після нього. На кожному з цих етапів розраховували індекс HOMA (Homeostasis model assessment) та проводили оцінку больового статусу за ВАШ. Для оцінки функціонування кульшового суглоба використовували шкалу реабілітації (шкалу Харріса) до операції, через тиждень і через місяць після оперативного втручання. Результати. Застосування модифікованого заднього доступу (МЗД) значно й вірогідно знижувало післяопераційний біль, найбільшою мірою це спостерігалося після операції (2-й етап дослідження). До кінця дослідження інтенсивність болю залишалася вірогідно меншою у хворих, яким виконувався МЗД. При аналізі індексу HOMA виявилося, що на початку дослідження в обох групах він був однаковий. На 1-шу добу після операції індекс HOMA при використанні МЗД був вірогідно нижчим, на 7-му добу різниця була майже вірогідною (p = 0,08), при цьому у групі 2 індекс був нижчим. Подібна динаміка спостерігалася й щодо кортизолемії. Концентрація IL-6 та TNF-α упродовж перших трьох етапів дослідження відмінностей між групами не мала, на 7-му добу після операції цей показник у хворих, яким виконали МЗД, став вірогідно меншим. Функція кульшового суглоба впродовж семи діб після операції була однаковою після виконання обох доступів в обох групах, але через місяць у хворих, яким виконували МЗД, функція суглоба стала вірогідно кращою. Висновки. Застосування МЗД має серйозні переваги перед використанням традиційного підходу при операції тотального ендопротезування кульшового суглоба у пацієнтів з остеоартрозом та супутньою кардіальною патологією.
Background. Total hip arthroplasty (THA) is one of the safest and most effective orthopaedic surgeries, but it carries a significant risk of complications, particularly in patients with concomitant cardiac pathology. Therefore, choosing the optimal type of surgical approach is crucial for these patients. The study purposed to compare the intensity of stress reactions in the perioperative period and assess hip joint functioning in patients with osteoarthritis and concomitant cardiac pathology undergoing THA, depending on the type of surgical approach. Materials and methods. This study analyzed the treatment outcomes in 90 patients with hip osteoarthritis and cardiac pathology who underwent total cement hip arthroplasty. All patients were divided into two groups based on the surgical approach: traditional posterior (35 patients, group 1) and modified posterior (MPA) (55 patients, group 2). Serum levels of insulin, cortisol, glucose, IL-6, and TNF-α were measured before surgery, immediately after it, 24 hours later, and one week after surgery. At each stage, the homeostasis model assessment (HOMA) index was calculated, and pain status was assessed using the visual analogue scale. Hip joint functioning was evaluated with the Harris scale before surgery, one week, and one month after it. Results. The MPA significantly reduced postoperative pain, most notably immediately after surgery (stage 2). Throughout the study, pain intensity remained significantly lower in the MPA group. The HOMA index was initially similar in both groups, but it was significantly lower in the MPA group immediately after surgery and on the first postoperative day. By the seventh postoperative day, the HOMA index difference approached significance (p = 0.08), remaining lower in group 2. Cortisol levels showed similar dynamics. IL-6 and TNF-α concentrations did not differ between groups during the first three stages but were significantly lower in the MPA group on the seventh postoperative day. Hip function was comparable in both groups one week post-surgery but was significantly better in the MPA group after one month. Conclusions. The modified posterior approach offers significant advantages over the traditional approach in THA for patients with osteoarthritis and concomitant cardiac pathology.
стресорні реакції; остеоартроз; кардіальна патологія; тотальне ендопротезування кульшового суглоба; хірургічний доступ
stress reactions; osteoarthritis; cardiac pathology; total hip arthroplasty; surgical approach