Цереброваскулярна патологія (ЦВП) на сьогодні розглядається як одна з провідних медико-соціальних проблем сучасного суспільства. При цьому важливо підкреслити, що переважну більшість (до 90 %) випадків судинних захворювань центральної нервової системи (ЦНС) становлять хронічні порушення мозкового кровообігу, або хронічна ішемія головного мозку (ХІГМ) [10, 18].
Одним з провідних чинників розвитку ЦВП, зокрема ХІГМ, є ситуації хронічного стресу. Ця проблема на сьогодні актуальна для всієї світової медицини, а в Україні в умовах повномасштабної війни набуває особливого значення [12]. Саме хронічний стрес є основою розвитку великої групи нозологічних форм, так званих хвороб цивілізації, куди входять цереброваскулярна й психосоматична патологія, а також неврози [3, 23], тобто основних форм захворювань у практиці як невролога, так і сімейного лікаря.
Провідною причиною розвитку всіх форм ЦВП, за сучасними уявленнями, є артеріальна гіпертензія (АГ) [14, 20]. Хронічно підвищений артеріальний тиск (АТ) провокує структурні зміни в судинній стінці й органах-мішенях, які сприяють розвитку і прогресуванню атеросклерозу, а отже, і серцево-судинних захворювань, зокрема ЦВП [14]. Особливе місце в даному процесі посідають порушення мікроциркуляції, пов’язані з ураженням дрібних судин — артеріол і капілярів, що призводять до порушень транспорту кисню в нейрони і, відповідно, дисфункції біоенергетичних процесів. У результаті відбувається запуск патофізіологічних реакцій, типових для ішемічного каскаду, який хоч і формується значно повільніше, ніж при гострому інсульті, і в більш усіченому вигляді, але все ж таки в результаті призводить до розвитку необоротних деструктивних змін у нейронах — дисфункції нейрональних мембран, апоптозу і загибелі нейронів. Цьому особливо сприяють наявність неконтрольованої артеріальної гіпертензії, гіпертонічні кризи, високий пульсовий тиск тощо. Клінічні прояви, що виникають у результаті згаданих патофізіологічних процесів, характеризуються психоорганічним синдромом, вогнищевими неврологічними змінами, когнітивними і поведінковими розладами [8, 18]. Виникнення неврологічних, нейропсихологічних і психічних порушень при ХІГМ може бути спричинене як хронічною недостатністю мозкового кровообігу, так і/або повторними епізодами дисциркуляції, які перебігають з явною клінічною симптоматикою (у вигляді інсульту або транзиторної ішемічної атаки) або субклінічно. Останнім часом все більше значення надається також артеріальній гіпотензії, у тому числі обумовленій неадекватно активним використанням гіпотензивних препаратів [8, 20].
Також необхідно пам’ятати, що патогенез уражень судин ЦНС і дистрофічно-деструктивних змін у ней-ронах накладається на вікові порушення кровопостачання і метаболізму мозку, у зв’язку з чим ХІГМ може розглядатися як характерна вік-залежна патологія. З віком відзначаються прояви деформації артеріальних петель у дрібних судинах поверхні мозку, відбувається їхнє розмикання, розвиток атрофії дрібних сполучних артерій, що призводить до обмеження можливостей авторегуляції мозкового кровотоку [11]. При приєднанні уражень судинної стінки атеросклеротичного і/або гіпертонічного генезу зазначені зміни різко прогресують, маніфестуючи у вигляді відповідної клінічної картини.
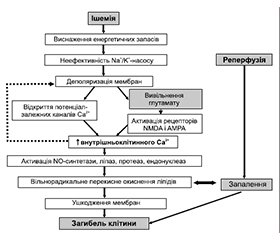
Для розробки обґрунтованої стратегії спрямованої фармакотерапії ХІГМ важливо розуміти основні патофізіологічні реакції, що запускаються розвитком гіпоксії нейрональних структур і лежать в основі вищеописаної клінічної симптоматики (рис. 1).
/74.jpg)
Механізми пошкодження тканини мозку при ішемії та гіпоксії характеризуються певною тимчасовою послідовністю. У численних експериментальних дослідженнях, проведених з використанням різних моделей як in vitro, так і in vivo, встановлено, що процес церебральної ішемії супроводжується швидким виснаженням макроергічних фосфатів, порушенням енергозалежного іонного транспорту з розвитком внутрішньоклітинного лактацидозу і деполяризації нейронів і глії, надлишковим накопиченням збуджуючих амінокислот, що мають нейротоксичну дію, лавиноподібним надходженням іонів кальцію всередину клітини, утворенням вторинних месенджерів інозитолфосфатного ряду, накопиченням активних форм кисню, що індукують розпад нуклеїнових кислот, білків і фосфоліпідів. Пусковим механізмом ушкодження нейронів при ішемії є порушення енергетичного обміну, що призводять до зменшення вмісту АТФ і креатинфосфату, накопичення органічного фосфату. Обмеження надходження в тканину мозку кисню і глюкози поряд з дефіцитом макроергічних фосфатів, що виникає внаслідок цього, викликає роз’єднання окисного фосфорилювання, активацію анаеробного гліколізу і розвиток лактацидозу. Перехід на анаеробний гліколіз і наростання лактацидозу може індукувати ланцюг каскадних патобіохімічних реакцій, що лежать в основі необоротного пошкодження тканини мозку. Так, унаслідок порушень енергетичного метаболізму відбувається пошкодження Na+-K+-АТФазної ферментативної системи й іонних каналів. Порушення функціонування іонних каналів зумовлює пасивний відтік К+ з клітин, приплив Na+, Cl– і Н2О в клітину за допомогою Na+/H+- і Cl–/HCO3–-транспортних механізмів, викликаючи деполяризацію нейрональних мембран. Унаслідок зміни трансмембранного потенціалу послідовно включаються й інші ушкоджуючі механізми, у тому числі вивільнення збуджуючих нейротрансмітерів (глутамату, аспартату, серотоніну, дофаміну тощо) із закінчень ішемізованих нейронів у міжклітинний простір, тобто формуються реакції ексайтотоксичності [2, 13]. Некерована активація глутаматного каскаду є однією з головних причин загибелі нейронів. Істотну роль у розвитку необоротного пошкодження мозку при ішемії відіграють також порушення гомеостазу внутрішньонейронального Са2+. Накопичення Са2+ у цитоплазмі внаслідок його надлишкового надходження ззовні та вивільнення з внутрішньоклітинного депо призводить до активації ферменту фосфоліпази А з подальшою деструкцією мембранних фосфоліпідів. Уся сукупність описаних процесів створює умови для експресії генів білків, що індукують апоптоз — програму цілеспрямованої програмованої загибелі клітин [13].
Отже, з огляду на складний, багатогранний характер розвитку патофізіологічних реакцій у ЦНС унаслідок дії гіпоксії є важливим виділення окремих найбільш значущих у плані біоенергетики ланок ішемічного каскаду як об’єкта спрямованого фармакологічного впливу. До таких повною мірою можна віднести:
1. Вплив на мембранний транспорт жирних кислот.
2. Вплив на реакції аеробного гліколізу.
3. Захист нейронів від шкідливої дії вільних радикалів.
Коротко значення впливу на дані механізми можна пояснити таким чином:
1. При ішемії та гіпоксії одним з провідних компонентів ушкоджуючого впливу на клітину, особливо кардіоміоцити, вважається підвищення транспорту жирних кислот через клітинну мембрану, збільшення вмісту вільного карнітину й активація карнітинзалежного окиснення жирних кислот [7, 9, 25]. Результатом цього є активація вільнорадикального окиснення, що призводить до ушкодження мембран (насамперед мітохондріальних), їх деструкції та нейродегенерації [2]. Важливо також зазначити, що при активації біосинтезу карнітину прискорюється транспорт саме довголанцюгових жирних кислот через мембрани мітохондрій. Саме згадані жирні кислоти за умови ішемії чинять токсичну дію на мітохондрії — основну ланку регуляції енергетичного метаболізму [13]. Тому важливою метою фармакологічного впливу в описаних умовах слід визнати обмеження процесів окиснення жирних кислот і переведення енергозабезпечення клітин на окиснення глюкози, оскільки цей процес вимагає меншої кількості кисню і може розглядатися як максимально фізіологічний у стані гіпоксії. Це є особливо актуальним саме в умовах кардіоневрологічної патології, оскільки дисфункція міокарда тією чи іншою мірою спостерігається при більшості клінічних форм ХІГМ на тлі артеріальної гіпертензії та церебрального атеросклерозу.
2. В умовах ішемії, особливо в ЦНС, різко знижується активність провідних ферментів циклу Кребса — гексокінази і піруватдегідрогенази. Піруватдегідрогеназа безпосередньо стимулює гліколіз, а гексокіназа дозволяє забезпечити залучення поряд з глюкозою інших гексоз у цикл Кребса як важливого джерела енергетичного забезпечення клітин в умовах ішемії. Оскільки саме гексокіназа значною мірою визначає швидкість процесу гліколізу, то активація та експресія даного ферменту забезпечують інтенсифікацію утилізації глюкози для синтезу АТФ [4]. Тому спрямована активація зазначених ферментів не тільки сприяє збереженню на належному рівні реакцій аеробного гліколізу, але й перешкоджає накопиченню в тканині головного мозку лактату і розвитку реакцій лактацидозу — однієї з провідних ланок ішемічного каскаду і фактора ушкодження нейронів.
3. Захист нейрональних структур від вільних радикалів значною мірою здійснюється через реалізацію двох вищеописаних механізмів. Однак оптимально доповнює ці шляхи впливу можливість безпосередньої дії на біосинтез оксиду азоту (NO) — потужного антиоксиданта (зв’язування вільних радикалів) та вазодилататора (послаблення проявів судинного спазму, у тому числі в судинах головного мозку, і зменшення ішемії, периваскулярного набряку тощо) [9], тобто потужного коректора ендотеліальної дисфункції, що не має аналогів серед інших біологічно активних речовин. Активація біосинтезу NO є ацетилхолін-опосередкованим процесом. При цьому класичні холінергічні нейротропні засоби, що діють переважно на синаптичному рівні (зворотне захоплення ацетилхоліну і/або його рецепторне зв’язування), не мають будь-яких специфічних ефектів щодо NO, що вимагає в даному випадку застосування препаратів принципово іншого типу дії.
У результаті вибір лікарського засобу для впливу на процеси ішемії та гіпоксії в ЦНС, що дає поєднаний, комплексний ефект на розглянуті найважливіші ланки ішемічного каскаду, які залишаються поза сферою фармакологічної активності більшості препаратів-ней-ропротекторів, є досить складним завданням.
У зв’язку з цим у сучасній фармакології сформувався новий напрямок — біоенергетична фармакологія [1], в основі якої лежать розробка, апробація та впровадження в практику лікарських засобів, що спрямовано впливають на процеси енергетичного обміну, насамперед у мітохондріях — основних енергогенераторах клітин. Такі препарати отримали назву регулятори енергетичного обміну (РЕО) [1, 15]. З огляду на розглянуту роль ішемії в розвитку найважливіших нозологічних форм у неврологічній практиці цілком природним є особливий інтерес до можливостей застосування препаратів РЕО в ангіоневрології, які потенційно здатні не лише підвищувати енергозабезпечення нейронів, але й надавати комплексну нейропротекторну дію.
Власне кажучи, сьогодні в клінічній нейрофармакології відомий лише один препарат, який поєднує в спектрі своїх механізмів дії спрямований, виражений і збалансований вплив на всі згадані патобіохімічні реакції при ХІГМ. Ідеться про препарат мельдоній.
Мельдоній, структурний аналог гамма-бутиробетаїну, є засобом з унікальним комплексним механізмом дії на нейрометаболічні процеси в нейронах і регуляцію судинного тонусу, що принципово відрізняється від інших засобів нейропротекторного, ноотропного і вазотропного типу дії.
Метаболічні ефекти мельдонію перш за все визначаються його впливом на окиснення жирних кислот і біосинтез карнітину.
Як відомо, гамма-бутиробетаїн являє собою фізіологічно активну речовину — попередник карнітину в ланцюзі метаболізму жирних кислот [5]. Тому, відповідно до своєї хімічної структури, мельдоній є оборотним блокатором гамма-бутиробетаїнгідроксилази — основного ферменту в ланцюзі біосинтезу карнітину. Під впливом даного препарату знижується як біосинтез карнітину, так і здійснюваний за допомогою останнього транспорт уже згадуваних шкідливих довголанцюгових жирних кислот, передусім у міокарді [21]. При цьому мельдоній не впливає на транспорт коротколанцюгових жирних кислот, необхідних для підтримки фізіологічного рівня тканинного дихання [7]. У результаті реалізації описаних ефектів відбувається перемикання енергетичного метаболізму клітин на гліколітичний шлях, набагато економніший та ефективніший в умовах гіпоксії, що сприяє суттєвому підвищенню адаптаційно-компенсаторного потенціалу клітинних структур в умовах артеріальної гіпертензії та атеросклерозу і, відповідно, руйнує фундамент подальшого формування ЦВП на клітинному і судинному рівнях.
Отже, уже при аналізі першого з основних механізмів дії мельдонію стає очевидною адаптаційна спрямованість його фармакологічних ефектів, тобто активація найбільш оптимальних біоенергетичних реакцій за умов гіпоксії.
Другий фундаментальний механізм дії мельдонію, що відіграє особливу роль саме в ЦНС, пов’язаний з активацією базових ферментів циклу Кребса, що забезпечують повноцінне тканинне дихання в нейронах, — уже згадуваних піруватдегідрогенази й гексокінази. Дуже важливо відзначити, що найповніше гексокіназний механізм дії мельдонію проявляється в умовах зниженого вмісту карнітину в клітинах, тобто обидва описані компоненти його дії тісно взаємопов’язані й взаємодоповнюють один одного [7]. Результатом згаданої дії є зменшення концентрації лактату в тканинах і співвідношення ацетил-КоА/КоА, а також підвищення концентрації АТФ, тобто комплексна енергостимулююча дія.
Важливо відзначити, що, на відміну від переважної більшості нейропротекторів, дія мельдонію в умовах ішемії характеризується максимальною селективністю, наявністю регуляторного впливу на функцію мітохондрій, забезпеченням профілактики розвитку мітохондріальної дисфункції та, нарешті, максимальною фізіологічною дією на нейрони і ЦНС. Тому в цій ситуації мельдоній можна розглядати не тільки як препарат зі спрямованою нейрометаболічною дією, але і як нейрорегулятор і ней-роадаптоген у широкому розумінні цих термінів.
Ще однією виключно цінною властивістю мельдонію є його антиоксидантні ефекти.
В умовах порушень енергоутворювальних реакцій при ішемії та гіпоксії та при неповному відновленні кисню відбувається утворення високореактивних, а отже, токсичних вільних радикалів або продуктів, які їх генерують. Патологічний вплив вільних радикалів передусім пов’язаний з їх впливом на структурно-функціональні характеристики біологічних мембран, що призводить до порушень їх природної транспортно-захисної функції, підвищення мікров’язкості, зміни проникності для різних іонів і в результаті — до змін у життєдіяльності нейронів, а надалі — до їх деструкції та загибелі [17].
Підвищена продукція вільних радикалів є однією із суттєвих причин тривалого спазму церебральних судин, прогресування постішемічного набряку і дегенерації нейронів за рахунок порушення цілісності мембран при різних формах порушень мозкового кровообігу, у тому числі при дисциркуляторній енцефалопатії. Саме тому антиоксидантна фармакотерапія є одним з важливих напрямків розвитку стратегії нейропротекції, а розробка препаратів зі спрямованою антиоксидантною дією входить до числа провідних напрямків експериментальної та клінічної нейрофармакології.
Мельдоній має здатність як активувати ферменти природного антиоксидантного захисту організму (супероксиддисмутаза, каталаза), так і запобігати в умовах ішемії вільнорадикальному окисненню ліпідів за рахунок зниження карнітин-залежного окиснення жирних кислот [7, 13].
Нарешті, на особливу увагу заслуговує вплив мельдонію на біосинтез оксиду азоту (NO). Під впливом даного препарату підвищується концентрація гамма-бутиробетаїну в головному мозку, що має здатність індукувати біосинтез NO за рахунок його структурної подібності до ацетилхоліну [19, 22], причому ця індукція проявляється виключно селективно — тільки в межах ішемізованої зони, не торкаючись неушкоджених ділянок, тобто при застосуванні мельдонію відсутній ризик розвитку феномену обкрадання [7]. У результаті завдяки зазначеному засобу з’являється можливість практичної реалізації однієї з провідних концепцій сучасної клінічної фармакології — теорії множинної селективності.
Сьогодні в нейрофармакології досить поширена думка про те, що широта механізмів дії в поєднанні з потужністю стимулюючого чи інгібуючого впливу на ту чи іншу рецепторну систему і/або метаболічну реакцію безпосередньо визначає клінічну ефективність препарату, тоді як селективність його впливу щодо окремих типів рецепторів і/або конкретних ланок метаболічних процесів пов’язана з підвищенням безпеки терапії, що проводиться [24, 26]. У результаті виникає парадоксальна на перший погляд ситуація — вибір між препаратом з максимальною широтою і потужністю дії (і тому більш ефективним) і препаратом з максимальною селективністю (і тому безпечнішим). Однак у цій ситуації є цілком очевидна (проте не завжди проста в клінічному плані) відповідь — вибір препарату, що має множинні, але при цьому максимально селективні специфічні ефекти щодо окремих — провідних — ланок патогенезу тієї чи іншої форми патології. Саме концепція множинної селективності дозволяє обґрунтовано й аргументовано підійти до оптимізації вибору лікарського препарату в конкретного хворого з урахуванням індивідуального анамнезу, супутньої патології, раніше призначеної терапії тощо. І саме мельдоній серед усього переліку препаратів нейрометаболічного типу дії є оптимальним препаратом вибору відповідно до даної теорії, причому, що важливо підкреслити, згадана селективність стосується не просто тих чи інших нейрометаболічних реакцій, порушених ішемічним каскадом, але і ключових ланок життєдіяльності ней-
рона в умовах ішемії та гіпоксії, на які мало чи взагалі не діють інші інструменти нейрометаболічної фармакотерапії.
Описані фармакологічні ефекти мельдонію визначили позитивний досвід його застосування в ангіоневрології, зокрема при різних формах ХІГМ.
У клінічній практиці в результаті проведених масштабних випробувань було виявлено комплексний полікомпонентний ефект мельдонію щодо патологічних симптомів у рамках різних форм ХІГМ (дисциркуляторна енцефалопатія, початкові стадії судинної деменції), а саме: ослаблення проявів когнітивних порушень (поліпшення оперативної пам’яті, уваги, концентрації), цефалгічного й астенічного синдромів, нормалізація психоемоційного балансу, реологічних властивостей крові й гемодинамічних параметрів [5, 9, 11, 16]. Не менш цінним і досить рідкісним для препаратів нейрометаболічного типу дії клінічним ефектом є зменшення проявів рухових розладів при ХІГМ — поліпшення показників стійкості та ходи за рахунок нормалізації взаємодії кортико-субкортикально-стовбурових механізмів [6].
В основі описаних клінічних ефектів мельдонію при ХІГМ лежать не тільки розглянуті нейрометаболічні й судинні механізми, але й здатність даного препарату активувати холін- і катехоламінергічні нейромедіаторні системи мозку, нормалізувати виникаючий нейромедіаторний дисбаланс, що відіграє важливу роль у розвитку когнітивних, психоемоційних і рухових порушень [6, 7]. Отже, на відміну від усталених уявлень про мельдоній як про препарат виключно метаболічного типу дії, він має клінічно значущі нейромедіаторні ефекти, що відіграють важливу роль у забезпеченні впливу на когнітивну і психоемоційну сферу в рамках фармакотерапії різних форм ХІГМ.
Також важливо наголосити, що ефекти мельдонію не лише проявляються на рівні клінічної симптоматики, але й візуалізуються шляхом комп’ютерної/магнітно-резонансної томографії, зокрема посилення перфузії як у корі, так і в білій речовині мозку обох півкуль. Необхідно також відзначити, що зазначені клінічні ефекти чітко корелюють зі ступенем вираженості антиоксидантної дії препарату, що виявляється за серією показників (зниження інтенсивності перекисного окиснення ліпідів, підвищення активності супероксиддисмутази тощо) [4].
У цілому терапія мельдонієм безпосередньо сприяє підвищенню якості життя пацієнтів, їх соціальної активності, що сьогодні розглядається як один з найважливіших критеріїв оцінки ефективності фармакотерапії.
Відсутність необхідності титрування дози, особливого дозового режиму для осіб похилого і старечого віку також сприяє максимальному досягненню комплаєнсу в процесі терапії мельдонієм.
Мельдоній має дуже добрі характеристики безпеки і добру переносимість. З побічних ефектів зрідка відзначаються алергічні реакції (шкірні висипання, еритема, набряклість), збудження, тахікардія, диспептичні реакції. Серйозні побічні ефекти не описані.
У результаті основними клінічними перевагами мельдонію в ангіоневрології при лікуванні ХІГМ є:
1) комплексний вплив на когнітивну, психоемоційну й рухову симптоматику;
2) наявність позитивної дії щодо цефалгічних та –астенічних проявів;
3) високий рівень комплаєнсу;
4) безпека;
5) можливість широкого застосування в геріатричній популяції пацієнтів;
6) економічна доступність.
Серед препаратів мельдонію на фармацевтичному ринку України на особливу увагу заслуговує вітчизняний препарат Метонат, що виробляється цілком відповідно до критеріїв GMP і оптимально збалансований за показником ціна/якість. Найбільш цінною є різноманітність лікарських і дозових форм Метонату. Метонат випускається як у парентеральній формі (розчин для ін’єкцій, в 1 ампулі міститься 5 мл, що еквівалентно 500 мг мельдонію) для внутрішньовенного застосування (інфузійним або краплинним шляхом), так і в пероральній формі (капсули по 250 мг мельдонію). У поєднанні з максимальною економічною доступністю Метонату цілком можливо розглядати його як препарат вибору мельдонію для застосування в ангіоневрологічній практиці, що істотно підвищує комплаєнс у процесі лікування.
Схема застосування Метонату при ХІГМ не є складною:
а) у стадії декомпенсації призначають 500 мг (5 мл) в/в 1 раз/добу або розподіляють дозу на 2 прийоми протягом 10–14 днів, потім переходять на пероральну форму (капсули) протягом наступних 2–4 тижнів;
б) при профілактичному лікуванні призначають перорально в дозі 500–1000 мг/добу протягом 4–6 тижнів з можливим повторенням 2–3 рази на рік. Пацієнтам літнього віку без тяжкої патології печінки корекція дозового режиму не потрібна.
Завершуючи аналіз фармакологічних і клінічних ефектів мельдонію (Метонат), необхідно згадати про те, що РЕО є одними з найперспективніших у стратегії нейропротекції у зв’язку: 1) з можливістю безпосереднього впливу на базовий механізм порушень функцій мозку при ішемії — енергетичний дефіцит; і 2) наявністю переконливих доказів доцільності даних препаратів в ангіоневрології при різних формах ішемічних уражень мозку, зокрема при ХІГМ. І щодо цього мельдоній (Метонат) має досить великий потенціал; незважаючи на те, що він давно відомий і популярний, цей препарат ще не розкрив усі свої секрети і тому заслуговує на подальше клінічне вивчення і застосування.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 01.07.2024
Рецензовано/Revised 06.08.2024
Прийнято до друку/Accepted 12.08.2024
Список литературы
1. Арабська Л.П., Антипкін Ю.Г., Смірнова О.А. та ін. Регулятори енергетичного обміну (янтарна кислота та її солі) і можливості їх використання в оптимізації лікувально-реабілітаційних програм у клінічній педіатрії. К., 2006. 47 с.
2. Бурчинский С.Г. Ишемия головного мозга: возможности комплексной фармакологической коррекции. Укр. вісн. психоневрол. 2006. Т. 14. Вип.1. С. 15-18.
3. Бурчинский С.Г., Райченко Е.В., Шулькевич А.А.и др. Хронический стресс и «болезни цивилизации»: новые возможности фармакотерапии. Практикуючий лікар. 2020. № 1. С. 58-64.
4. Виничук С.М., Мохнач В.А., Крылова В.Ю. и др. Клинико-гемодинамические эффекты и антиоксидантная активность препарата милдронат в остром периоде ишемического инсульта. Мед. перспективи. 2006. Т. ХI. № 2. С. 85-91.
5. Дамброва М., Дайя Д., Лиепиньш Э. и др. Биохимические механизмы действия милдроната в условиях ишемического стресса. Врач. дело. 2004. № 2. С. 34-38.
6. Дамулин И.В., Антоненко Л.М., Коберская Н.Н. Влияние милдроната на двигательные расстройства при дисциркуляторной энцефалопатии. НейроNews. 2012. № 2/1. С. 50-54.
7. Калвиньш И.Я. Милдронат и триметазидин: сходство и различие. Terra Medica. 2002. № 3. С. 1-3.
8. Лисенко Г.І., Ященко О.Б., Хіміон Л.В. та ін. Хронічна цереброваскулярна патологія в загальнолікарській практиці. Сімейна мед. 2008. № 1. С. 102-105.
9. Логина И.П., Калвиньш И.Я. Милдронат в неврологии. Рига, 2012. 56 с.
10. Мищенко Т.С., Здесенко И.В., Липская А.В. и др. Новые мишени терапевтического воздействия у пациентов с хронической ишемией головного мозга. Міжнар. неврол. журн. 2011. № 2. С. 7-17.
11. Недогода С.В., Стаценко М.Е. Возможности терапевта в коррекции когнитивных нарушений при артериальной гипертензии. Фарматека. 2010. № 10. С. 21-27.
12. Стрес і серцево-судинні захворювання в умовах воєнного стану. За ред. В.М. Коваленка. К., 2022. 463 с.
13. Суслина З.А., Максимова М.Ю., Федорова Т.Н. Хронические цереброваскулярные заболевания: клиническая и антиоксидантная эффективность милдроната. Врач. 2007. № 4. С. 44-48.
14. Трещинская М.А. Артериальная гипертензия и цереброваскулярная патология. Нов. мед. фарм. 2009. № 299. С. 30-35.
15. Хазанов В.А. Фармакологическая регуляция энергетического обмена. Эксп. клин. фармакол. 2009. Т. 72. № 4. С. 61-64.
16. Шапошник И.И., Салашенко А.О. Эффективность лечения милдронатом больных с сочетанием ишемической болезни сердца и дисциркуляторной энцефалопатии. Мед. перспективи. 2007. Т. XII. № 3. С. 1-4.
17. Barja G. Free radicals and aging. Trends Neurosci. 2004;27:595-600.
18. Bowler JV. Vascular cognitive impairments. Stroke. 2004;35:386-388.
19. Dzintare M, Baumane L, Meirena D et al. Involvement of nitric oxide production in the mildronate mechanism of action. Pharmacol Res Commun. 2002;12:163-170.
20. International Society of Hypertension Writing Group. International Society of Hypertension (ISH): Statement on blood pressure lowering and stroke prevention. J Hypertens. 2003;21:651-663.
21. Jaudzems K, Kuka J, Gutsaits A et al. Inhibition of carnitine acetyltransferase by mildronate, a regulator of energy metabolism. J Enzyme Inhib Med Chem. 2009;24:1269-1275.
22. Liepinsh E, Konrade I, Scapare E et al. Mildronate treatment alters γ-butyrobetaine and L-carnitine concentrations in healthy volunteers. J Pharm Pharmacol. 2011;63:1195-1201.
23. Lindmark A.P. Anxiety Disorders. Psychopathological Syndromes in General Practice. N.Y.: Owen Press, 2014. Р. 64-92.
24. Schatzberg PH, Nemeroff P. Essential Psychopharmacology. 2nd ed. N.Y.: Acad Press, 2015. 787 p.
25. Spaniol M., Brooks H., Auer L. et al. Development and cha-racterization of an animal model of carnitine deficiency. Eur J Biochem. 2001;268:1876-1887.
26. Tunner J, Luini T, Prescott FA et al. Selectivity of drug action in clinical pharmacology. Ann Rev Clin Pharmacol Toxicol. 2011;4:148-165.

/74.jpg)