Резюме
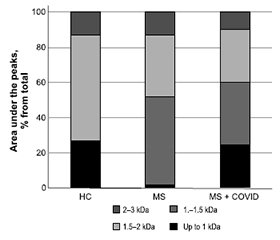
Актуальність. Це дослідження мало на меті: 1) визначити плазмові рівні п’яти матриксних металопротеїназ (ММП), а саме ММП-1, -2, -3, -8, -10, і тканинного інгібітора металопротеїназ-1 (ТІМП-1); 2) проаналізувати активність протеаз у плазмі за допомогою зимографії; 3) провести попередній аналіз складу пептидного пулу в плазмі пацієнтів із розсіяним склерозом (РС) і COVID-19 в анамнезі та без нього. Матеріали та методи. Обстежено 97 хворих на РС: у 41 пацієнта COVID-19 був діагностований протягом останніх 4–6 місяців (група «РС + COVID»), а 56 раніше не хворіли на нього (група РС). Як контроль використовували плазму крові здорових донорів (n = 30). Концентрації MMП і TIMП-1 оцінювали методом імуноферментного аналізу. Активність MMП у плазмі перевіряли за допомогою зимографії з використанням желатину як субстрату. Загальну фракцію пептидів ізолювали з плазми хворих на РС та здорових донорів. Потім використовували ексклюзійну хроматографію з метою ідентифікації окремих фракцій, присутніх у загальному пулі. Результати. Установлено, що концентрація MMП-2 була значно підвищеною в плазмі пацієнтів групи РС порівняно з контрольною групою, тоді як у групі «РС + COVID» були збільшені рівні двох інших MMП, а саме MMП-1 та -10. Результати зимографії показали наявність 4 основних зон гідролізу желатину на рівні 92, 84, 72 і 62 кДа в зразках плазми пацієнтів із розсіяним склерозом, тоді як у здорових осіб було виявлено лише сліди MMП. У більшості зразків плазми осіб із розсіяним склерозом показано активність MMП-2, а MMП-9 містили лише деякі. Ми також встановили концентрацію циркулюючих пептидів. Показано, що рівні пептидів у плазмі крові були вищими в групах РС і «РС + COVID» порівняно з контрольною групою. Згідно з нашими результатами, розвиток РС супроводжувався змінами кількості та якості пептидного пулу порівняно зі здоровими особами. Висновки. Таким чином, поглиблене розуміння ролі MMП у патогенезі РС після вірусної інфекції є важливим щодо оптимізації терапії, полегшення симптомів і клінічних проявів після COVID-19.
Background. The present research was conducted with the following objectives: 1) to determine the plasma levels of five matrix metalloproteinases (MMPs), namely MMP-1, -2, -3, -8, -10, and tissue inhibitor of metalloproteinase-1 (TIMP-1); 2) to analyze protease activity profiles in plasma using a zymographic method; and 3) to perform preliminary analysis on plasma peptide pool composition in patients with multiple sclerosis (MS) with and without COVID-19 history. Materials and methods. We examined 97 patients with MS: 41 had been diagnosed with COVID-19 in the past 4–6 months (MS + COVID group), and 56 did not suffer from SARS-CoV-2 infection previously (MS group). The plasma of healthy volunteers (n = 30) with no evidence of disease was used as control. The enzyme-linked immunosorbent assay was used to measure MMP and TIMP-1 concentrations. Plasma MMP activity was verified by gelatin-substrate zymography. Peptide pools were extracted from the plasma of MS patients and healthy subjects. Then size exclusion chromatography was used to identify separate fractions present in peptide pools. Results. We found that plasma concentration of MMP-2 was remarkably increased in the MS group compared with healthy controls, while in the MS + COVID patients, the levels of two other MMPs, MMP-1 and -10, were elevated. Zymography showed four dominant gelatinolytic bands of 92, 84, 72, and 62 kDa in MS plasma samples, whereas only traces of MMP were detected in healthy subjects. Most of MS plasma samples showed MMP-2 lytic activity, but only a few contained MMP-9. Finally, we determined the concentration of circulating peptides. The levels of plasma peptides were higher in patients from both the MS and MS + COVID group compared to control subjects. According to our results, the development of MS was accompanied by changes in both quantity and quality of peptide pool composition compared to healthy controls. Conclusions. Thus, an advanced understanding of the role of MMPs in MS pathogenesis following infection is important in developing optimized interventions to improve health and clinical outcomes during COVID-19.
Список литературы
1. Lassmann H. Multiple sclerosis pathology. Cold Spring Harb Perspect Med. 2018;8(3):a028936. doi: 10.1101/cshperspect.a028936.
2. Balasa R, Barcutean L, Mosora O, Manu D. Reviewing the significance of blood-brain barrier disruption in multiple sclerosis pathology and treatment. Int J Mol Sci. 2021;22(16):8370. doi: 10.3390/ijms22168370.
3. Angelini G, Bani A, Constantin G, Rossi B. The interplay bet-ween T helper cells and brain barriers in the pathogenesis of multiple sclerosis. Front Cell Neurosci. 2023 Feb 15;17:1101379. doi: 10.3389/fncel.2023.1101379.
4. Spencer JI, Bell JS, DeLuca GC. Vascular pathology in multiple sclerosis: Reframing pathogenesis around the blood-brain barrier. J Neurol Neurosurg Psychiatry. 2018;89:42-52. doi: 10.1136/jnnp-2017-316011.
5. Mirshafiey A, Asghari B, Ghalamfarsa G, Jadidi-Niaragh F, Azizi G. The significance of matrix metalloproteinases in the immunopathogenesis and treatment of multiple sclerosis. Sultan Qaboos Univ Med J. 2014;14(1):e13-25. doi: 10.12816/0003332.
6. Laronha H, Caldeira J. Structure and function of human matrix metalloproteinases. Cells. 2020;9(5):1076. doi: 10.3390/cells9051076.
7. Boziki M, Grigoriadis N. An Update on the role of matrix metalloproteinases in the pathogenesis of multiple sclerosis. Med Chem. 2018;14(2):155-169. doi: 10.2174/1573406413666170906122803.
8. Lindberg RLP, De Groot CJA, Montagne L, Freitag P, van der Valk P, et al. The expression profile of matrix metalloproteinases (MMPs) and their inhibitors (TIMPs) in lesions and normal appearing white matter of multiple sclerosis. Brain. 2001;124(9):1743-1753. doi: 10.1093/brain/124.9.1743.
9. Shiryaev SA, Remacle AG, Savinov AY, Chernov AV, Cieplak P, et al. Inflammatory proprotein convertase-matrix metalloproteinase proteolytic pathway in antigen-presenting cells as a step to autoimmune multiple sclerosis. J Biol Chem. 2009;284(44):30615-26. doi: 10.1074/jbc.M109.041244.
10. Shiryaev SA, Savinov AY, Cieplak P, Ratnikov BI, Motamedchaboki K, et al. Matrix metalloproteinase proteolysis of the myelin basic protein isoforms is a source of immunogenic peptides in autoimmune multiple sclerosis. PLoS One. 2009;4(3):e4952. doi: 10.1371/journal.pone.0004952.
11. Cabral-Pacheco GA, Garza-Veloz I, Castruita-De la Rosa C, Ramirez-Acuña JM, Perez-Romero BA, et al. The roles of matrix metalloproteinases and their inhibitors in human diseases. Int J Mol Sci. 2020;21(24):9739.
12. Bar-Or A, Nuttall RK, Duddy M, Alter A, Kim HJ, et al. Analyses of all matrix metalloproteinase members in leukocytes emphasize monocytes as major inflammatory mediators in multiple sclerosis. Brain. 2003;126(Pt 12):2738-2749. doi: 10.1093/brain/awg285.
13. Salomão R, Assis V, de Sousa Neto IV, Petriz B, Babault N, et al. Involvement of Matrix Metalloproteinases in COVID-19: Molecular Targets, Mechanisms, and Insights for Therapeutic Interventions. Biology (Basel). 2023 Jun 10;12(6):843. doi: 10.3390/bio–logy12060843.
14. Gelzo M, Cacciapuoti S, Pinchera B, De Rosa A, Cernera G, et al. Matrix metalloproteinases (MMP) 3 and 9 as biomarkers of severity in COVID-19 patients. Sci Rep. 2022;12(1):1212. doi: 10.1038/s41598-021-04677-8.
15. Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coet-zee T, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol. 2018;17(2):162-173. doi: 10.1016/S1474-4422(17)30470-2.2.
16. Halenova TI, Raksha NG, Vovk TB, Karbovskyy VL, Sholomon SM, et al. Characteristics of fibrin/fibrinogen degradation pro-ducts in multiple sclerosis following SARS-CoV-2 infection. International Neurological Journal (Ukraine). 2024;20(2):104-109. doi: 10.22141/2224-0713.20.2.2024.1060.
17. Tuharov Y, Krenytska D, Halenova T, Kot L, Raksha N, et al. Plasma levels of MMPs and TIMP-1 in patients with osteoarthritis after recovery from COVID-19. Reviews on Recent Clinical Trials. 2023;18(2):123-128. doi: 10.2174/1574887118666230131141608.
18. Ostapchenko L, Savchuk O, Burlova-Vasilieva N. Enzyme electrophoresis method in analysis of active components of haemostasis system. Adv Biosci Biotechnol. 2011;2:20-26.
19. Kozyk M, Strubchevska K, Marynenko T, Zlatska A, Halenova T, et al. Effect of peptides from plasma of patients with coronary artery disease on the vascular endothelial cells. Medicina (Kaunas). 2023;59(2):238. doi: 10.3390/medicina59020238.
20. Ren Z, Chen J, Khalil RA. Zymography as a research tool in the study of matrix metalloproteinase inhibitors. Methods Mol Biol. 2017;1626:79-102. doi: 10.1007/978-1-4939-7111-4_8.
21. Sharma R, Agarwal M, Gupta M, Somendra S, Saxena SK. Clinical Characteristics and Differential Clinical Diagnosis of Novel Coronavirus Disease 2019 (COVID-19). Coronavirus Disease 2019 (COVID-19). 2020;30:55-70. doi: 10.1007/978-981-15-4814-7_6.
22. Dziedzic A, Saluk-Bijak J, Miller E, Niemcewicz M, Bijak M. The Impact of SARS-CoV-2 Infection on the Development of Neurodegeneration in Multiple Sclerosis. International Journal of Molecular Sciences. 2021;22(4):1804. doi: 10.3390/ijms22041804.
23. MacDougall M, El-Hajj Sleiman J, Beauchemin P, Rangachari M. SARS-CoV-2 and Multiple Sclerosis: Potential for Di-sease Exacerbation. Front Immunol. 2022;13:871276. doi: 10.3389/fimmu.2022.871276.
24. Avolio C, Ruggieri M, Giuliani F, Liuzzi GM, Leante R, et al. Serum MMP-2 and MMP-9 are elevated in different multiple sclerosis subtypes. J Neuroimmunol. 2003 Mar;136(1–2):46-53. doi: 10.1016/s0165-5728(03)00006-7.
25. Safont B, Tarraso J, Rodriguez-Borja E, Fernández-Fabrellas E, Sancho-Chust JN, et al. Lung Function, Radiological Findings and Biomarkers of Fibrogenesis in a Cohort of COVID-19 Patients Six Months After Hospital Discharge. Arch Bronconeumol. 2022;58:142. doi: 10.1016/j.arbres.2021.08.014.
26. Syed F, Li W, Relich RF, Russell PM, Zhang S, et al. Excessive Matrix Metalloproteinase-1 and Hyperactivation of Endothelial Cells Occurred in COVID-19 Patients and Were Associated with the Severity of COVID-19. J Infect Dis. 2021;224:60-69. doi: 10.1093/infdis/jiab167.
27. Remsik J, Wilcox JA, Babady NE, McMillen T, Vachha BA, et al. Inflammatory Leptomeningeal Cytokines Mediate Delayed COVID-19 Encephalopathy. medRxiv. 2020. doi: 10.1101/2020.09.15.20195511.
28. Frankowski H, Gu YH, Heo JH, Milner R, Del Zoppo GJ. Use of gel zymography to examine matrix metalloproteinase (gelatinase) expression in brain tissue or in primary glial cultures. Methods Mol Biol. 2012;814:221-233. doi: 10.1007/978-1-61779-452-0_15.
29. Bjornland K, Winberg JO, Odegaard OT, Hovig E, Loenne-chen T, et al. S100A4 involvement in metastasis: deregulation of matrix metalloproteinases and tissue inhibitors of matrix metalloproteinases in osteosarcoma cells transfected with an anti-S100A4 ribozyme. Cancer Res. 1999;59(18):4702-4708.