Журнал «Боль. Суставы. Позвоночник» Том 14, №4, 2024
Вернуться к номеру
Антиалодинічний ефект пропоксазепаму при монойодацетат-індукованому остеоартриті в щурів
Авторы: M.Ya. Golovenko (1), I.P. Valivodz (1), A.S. Reder (2), V.B. Larionov (1)
(1) - A.V. Bogatsky Physico-Chemical Institute of the National Academy of Sciences of Ukraine, Odesa, Ukraine
(2) - SLC “Interchem”, Odesa, Ukraine
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
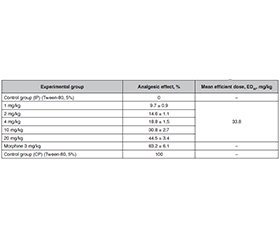
Актуальність. Остеоартрит (ОА) є хронічним дегенеративним захворюванням суглобів, яке вражає близько 654 мільйонів осіб віком ≥ 40 років у світі, найбільш часто ушкоджує колінні, кульшові суглоби, суглоби кистей та стоп і є одним із найбільш затратних для лікування хронічних захворювань. Мета дослідження: оцінити антиалодинічні ефекти пропоксазепаму в щурів при моделюванні ОА колінного суглоба, індукованого монойодацетатом. Матеріали та методи. Односторонній ОА колінного суглоба був викликаний ін’єкцією монойодацетату (2 мг/50 мкл) у гомілково-стегнову суглобову порожнину правої задньої лапи щура на початку експеримента (D0) під газовою анестезією (3,5% ізофлуран/3 л/хв). Тактильну алодинію оцінювали за допомогою електронного тесту фон Фрея через 2 години після введення пропоксазепаму. Відмінності отриманих показників аналізували за допомогою параметричного тесту Стьюдента для споріднених вибірок і вважали значущими за умови p ≤ 0,05. Результати. Отримані результати показали, що пропоксазепам у дозах 10 і 20 мг/кг викликав значне підвищення порогу відсмикування лапи порівняно з групою, яка отримувала розчинник (+32 і +46 %), підкреслюючи антиалодинічну ефективність. Середня ефективна доза (ЕД50) пропоксазепаму в цих умовах, визначена за допомогою пробіт-методу, становить для щурів 33,8 мг/кг. Висновки. Пропоксазепам демонструє статистично вірогідні антиалодинічні ефекти (p ≤ 0,05 для доз 2 та 4 мг/кг, p ≤ 0,01 для доз 10 і 20 мг/кг) при моделюванні ОА в щурів, що свідчить про його потенціал як терапевтичного засобу для лікування болю, пов’язаного з цим станом. Проте необхідні подальші дослідження для вивчення довгострокового профілю ефективності й безпеки пропоксазепаму в лікуванні хронічного болю, пов’язаного з ОА.
Background. Osteoarthritis (OA) is a chronic degenerative joint disease that affects around 654 million persons aged ≥ 40 years worldwide; it most commonly affects joints of knees, hips, hands, and feet in people and is considered to be one of the most expensive chronic conditions to treat. The purpose of this study was to assess the antiallodynic effects of orally administered propoxazepam in the monoiodoacetate-induced knee osteoarthritis (MIA) model in rats. Materials and methods. Unilateral OA was induced by an intra-articular injection of MIA (2 mg/50 μl) into the tibio-femoral joint cavity of the right hindpaw of the rat at the beginning of the experiment (on D0) under gas anesthesia (3.5% isoflurane/3 L/min). Tactile allodynia was assessed using the electronic Von Frey test 2 hours after propoxazepam administration. To determine the statistical effect of the test substance and the reference substance, data were analyzed by a parametrical t-Student test for dependent sets. The significance was estimated at levels p ≤ 0.05 and p ≤ 0.01. Results. Our findings demonstrated that at 10 and 20 mg/kg, propoxazepam induced a significant increase in the paw withdrawal threshold as compared to the vehicle-treated group (+32 and +46 %), highlighting an antiallodynic efficacy. The mean effective dose (ED50) of propoxazepam in this model using the probit-method conditions was estimated as 33.8 mg/kg on rats. Conclusions. Propoxazepam demonstrates significant antiallodynic effects in a rat model of OA (p ≤ 0.05 for doses 2 and 4 mg/kg, p ≤ 0.01 for doses 10 and 20 mg/kg), suggesting its potential as a therapeutic option for managing pain associated with this condition. However, further studies are required to explore the long-term efficacy and safety profile of propoxazepam in chronic pain management related to OA.
пропоксазепам; монойодацетат; біль; остеоартрит; доклінічні дослідження
propoxazepam; monoiodoacetate; pain; osteoarthritis; pre-clinical study
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Safiri S, Kolahi AA, Smith E, et al. Global, regional and national burden of osteoarthritis 1990–2017: a syste–matic analysis of the Global Burden of Disease Study 2017. Ann Rheum Dis. 2020 Jun;79(6):819-828. doi: 10.1136/–annrheumdis-2019-216515.
- Richard MJ, Driban JB, McAlindon TE. Pharmaceutical treatment of osteoarthritis. Osteoarthritis Cartilage. 2023 Apr;31(4):458-466. doi: 10.1016/j.joca.2022.11.005.
- Allaeys C, Arnout N, Van Onsem S, Govaers K, Victor J. Conservative treatment of knee osteoarthritis. Acta Orthop Belg. 2020 Sep;86(3):412-421.
- Головенко МЯ. Пропоксазепам — новаторський анальгетичний засіб, що гальмує гострий та хронічний біль і має полімодальний механізм дії. Visnik Nacionalnoi Academii Nauk Ukraini. 2021;(4):76-90. doi: 10.15407/visn2021.04.076.
- Desai A, Kherallah Y, Szabo C, Marawar R. Gabapentin or pregabalin induced myoclonus: A case series and literature review. J Clin Neurosci. 2019 Mar;61:225-234. doi: 10.1016/j.jocn.2018.09.019.
- Golovenko NYa, Larionov VB, Reder AS, Valivodz IP. An effector analysis of the interaction of propoxa–zepam with antagonists of GABA and glycine receptors. Neurochemical Journal. 2017;4:302-308. doi: 10.1134/s1819712417040043.
- Golovenko NYa, Voloshchuk NI, Andronati SA, Taran IV, Reder AS, Pashynska OS, Larionov VB. Antinociception induced by a novel benzodiazepine receptor agonist and bradykinin receptor antagonist in rodent acute and chronic pain models. European Journal of Biomedical and Pharmaceutical Sciences. 2018;5(12):79-88.
- Louati K, Vidal C, Berenbaum F, Sellam J. Association between diabetes mellitus and osteoarthritis: systematic literature review and meta-analysis. RMD Open. 2015 Jun 2;1(1). doi: 10.1136/rmdopen-2015-000077.
- Golovenko M, Reder A, Zupanets I, Bezugla N, Larionov V, Valivodz I. A phase I study evaluating the pharmacokinetic profile of a novel oral analgesic propoxazepam. J Pre Clin Clin Res. 2023;17(3):138-144. doi: 10.26444/jpccr/169426.
- Reder AS, Andronati SA, Golovenko MYa, Pavlovski VI, Kabanova TA, et al. Use of 7-bromo-5-(0-chlorophenyl)-3-propoxy-1,2-dihydro-3H-1,4-benzodiazepin-2-one for inhibition of neuropathic pain and seizures of different etiology. Patent No. US 11,304,956 B2. Date of Patent: Apr 19, 2022.
- Andronati S, Semenishyna E, Pavlovsky V, et al. Synthesis, structure and affinity of novel 3-alkoxy-1,2-dihydro-3H-1,4-benzodiazepin-2-ones for CNS central and peripheral benzodiazepine receptors. Eur J Med Chem. 2010 Apr;45(4):1346-51. doi: 10.1016/j.ejmech.2009.12.027.
- Bove SE, Calcaterra SL, Brooker RM, et al. Weight bearing as a measure of disease progression and efficacy of anti-inflammatory compounds in a model of monosodium iodoacetate-induced osteoarthritis. Osteoarthritis Cartilage. 2003 Nov;11(11):821-30. doi: 10.1016/s1063-4584(03)00163-8.
- Liu P, Okun A, Ren J, et al. Ongoing pain in the MIA model of osteoarthritis. Neurosci Lett. 2011 Apr 15;493(3):72-5. doi: 10.1016/j.neulet.2011.01.027.
- Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 1994 Jul;53(1):55-63. doi: 10.1016/0165-0270(94)90144-9.
- Neogi T. The epidemiology and impact of pain in osteoarthritis. Osteoarthritis Cartilage. 2013 Sep;21(9):1145-53. doi: 10.1016/j.joca.2013.03.018.
- Dray A, Read SJ. Arthritis and pain. Future targets to control osteoarthritis pain. Arthritis Res Ther. 2007;9(3):212. doi: 10.1186/ar2178.
- Nielsen S, Lintzeris N, Bruno R, et al. Benzodia–zepine use among chronic pain patients prescribed opioids: associations with pain, physical and mental health, and health service utilization. Pain Med. 2015 Feb;16(2):356-66. doi: 10.1111/pme.12594.
- Munro G, Erichsen HK, Rae MG, Mirza NR. A question of balance-positive versus negative allosteric mo–dulation of GABA(A) receptor subtypes as a driver of analgesic efficacy in rat models of inflammatory and neuropathic pain. Neuropharmacology. 2011 Jul-Aug;61(1–2):121-32. doi: 10.1016/j.neuropharm.2011.03.017.
- Asgharpour-Masouleh N, Rezayof A, Alijanpour S, Delphi L. Pharmacological activation of mediodorsal thalamic GABA-A receptors modulates morphine/cetirizine-induced changes in the prefrontal cortical GFAP expression in a rat model of neuropathic pain. Behav Brain Res. 2023 Feb 13;438:114213. doi: 10.1016/j.bbr.2022.114213.
- Hernstadt H, Wang S, Lim G, Mao J. Spinal translocator protein (TSPO) modulates pain beha–vior in rats with CFA-induced monoarthritis. Brain Res. 2009 Aug 25;1286:42-52. doi: 10.1016/j.brainres.2009.06.043.
- Guilarte TR, Rodichkin AN, McGlothan JL, Acanda De La Rocha AM, Azzam DJ. Imaging neuroinflammation with TSPO: A new perspective on the cellular sources and subcellular localization. Pharmacol Ther. 2022 Jun;234:108048. doi: 10.1016/j.pharmthera.2021.108048.
- Watkins LR, Maier SF. Beyond neurons: evidence that immune and glial cells contribute to pathological pain states. Physiol Rev. 2002 Oct;82(4):981-1011. doi: 10.1152/physrev.00011.2002.
- Chen SL, Zang Y, Zheng WH, Wei XH, Liu XG. Inhibition of neuropathic pain by a single intraperitoneal injection of diazepam in the rat: possible role of neurosteroids. Chin J Physiol. 2016 Feb 29;59(1):9-20. doi: 10.4077/CJP.2016.BAD332.
- Golovenko M, Reder A, Andronati S, Larionov V. Evidence for the involvement of the GABAergic pathway in the anticonvulsant and antinociceptive activity of propoxa–zepam in mice and rats. J Pre Clin Clin Res. 2019;13(3):99-105. doi: 10.26444/jpccr/110430.
- Reder A, Larionov V, Golovenko M. Subunit-dependent interaction of propoxazepam and its metabolite with the γ-aminobutyric acid type A receptor. EUREKA: Health Sci. 2022;5:10-18. doi: 10.21303/2504-5679.2022.002649.
- Golovenko NYa, Kabanova TA, Andronati SA, Halimova OI, Larionov VB, Reder AS. Anti-inflammatory effects of propoxazepam on different models of inflammation. Int J Med Med Res. 2019;5(2):105-112. doi: 10.11603/ijmmr.2413-6077.2019.2.10900.