Журнал «Медицина неотложных состояний» Том 21, №6, 2025
Вернуться к номеру
Можливості використання штучного інтелекту для оптимізації лікування пацієнтів з метаплазією стравоходу та грижами стравохідного отвору діафрагми
Авторы: Тивончук О.С. (1), Бабій І.В. (1), Саргсян А. (2), Гуленко О.О. (1)
(1) - ДУ «Національний науковий центр хірургії та трансплантології імені О.О. Шалімова НАМН України»,
м. Київ, Україна
(2) - Національний університет оборони України, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
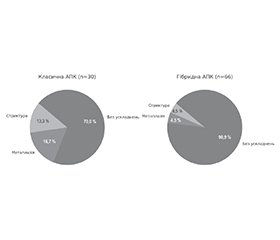
Актуальність. Стравохід Барретта — єдиний відомий гістологічний попередник аденокарциноми стравоходу. Поєднання сучасних ендоскопічних методів лікування з можливостями штучного інтелекту може значно поліпшити результати лікування, підвищити точність діагностики та забезпечити індивідуалізований підхід до терапії стравоходу Барретта. Мета цього дослідження: удосконалення методів діагностики, моніторингу та лікування стравоходу Барретта за допомогою використання штучного інтелекту. Матеріали та методи. Проведено проспективне дослідження 96 випадків лікування пацієнтів зі стравоходом Барретта в поєднанні з грижею стравохідного отвору діафрагми. Особливу увагу приділено клінічному прогнозуванню щодо виявлення дисплазії, ефективності ендоскопічної аргоноплазмової коагуляції (АПК) при різних варіантах стравоходу Барретта за допомогою штучного інтелекту. Результати. У нашому спостереженні було 96 пацієнтів зі стравоходом Барретта та гастроезофагеальною діафрагмальною грижею. Середній вік пацієнтів 54,4 ± 12,3 року; чоловіків — 52; жінок — 44. У 71,1 % виявлено рефлюкс-езофагіт, найчастіше ступеня LA-A (30,9 %). Грижу стравохідного отвору діафрагми І типу діагностовано у 45,8 % пацієнтів, тип III — у 50 %, тип IV — у 4,2 %. При морфологічному аналізі кишкова метаплазія з легкою дисплазією виявлена у 45,26 % випадків, тяжка дисплазія — у 4,21 %, HGD у поєднанні з пухлиною Абрикосова — у 1,05 %. Ендоскопічне лікування включало класичну аргоноплазмову коагуляцію у 30 пацієнтів і гібридну АПК — у 65. Класичну аргоноплазмову коагуляцію в один етап проведено у 36,7 %, у два етапи — у 63,3 %. Гібридна аргоноплазмова коагуляція одноетапна — у 78,8 %, а двохетапна — у 21,2 %. Післяопераційні ускладнення траплялися рідше після гібридної АПК. Висновки. Гібридна аргоноплазмова коагуляція порівняно з традиційними методами лікування є методом вибору при ендоскопічному лікуванні стравоходу Барретта у зв’язку з високими показниками безпеки та ефективної ерадикації метапластичного епітелію. Використання штучного інтелекту дає можливість обрати індивідуальний сценарій лікування пацієнтів, що поліпшує клінічну ефективність, зменшує кількість ускладнень та оптимізує економічну складову.
Background. Barrett’s esophagus is the only known histological precursor of esophageal adenocarcinoma. Combining modern endoscopic treatment methods with the capabilities of artificial intelligence can significantly improve treatment outcomes, increase diagnostic accuracy, and enable a personalized approach to the management of Barrett’s esophagus. Objective: to improve methods for the diagnosis, monitoring, and treatment of Barrett’s esophagus through the application of artificial intelligence. Materials and methods. A prospective study was conducted involving 96 patients with Barrett’s esophagus combined with hiatal hernia, 52 males and 44 females. Their mean age was 54.4 ± 12.3 years. Particular attention was paid to clinical prediction in detecting dysplasia, as well as to the efficacy of endoscopic argon plasma coagulation (APC) for different types of Barrett’s esophagus, utilizing artificial intelligence. Results. Reflux esophagitis was diagnosed in 71.1 % of cases, most commonly LA grade A (30.9 %). Type I hiatal hernia was found in 45.8 % of patients, type III in 50 %, and type IV in 4.2 %. Morphological analysis revealed intestinal metaplasia with low-grade dysplasia in 45.26 % of cases, high-grade dysplasia in 4.21 %, and high-grade dysplasia combined with Abrikosov tumor in 1.05 %. Endoscopic treatment included conventional APC in 30 patients and hybrid APC in 65. Single-stage conventional APC was performed in 36.7 % of cases, while two-stage treatment was used in 63.3 %. Hybrid APC was applied in a single stage in 78.8 % of patients and in two stages in 21.2 %. Postoperative complications occurred less frequently after hybrid APC. Conclusions. Hybrid argon plasma coagulation, compared to conventional treatment methods, is the preferred option for endoscopic management of Barrett’s esophagus due to its high safety profile and effective eradication of metaplastic epithelium. The use of artificial intelligence enables the selection of individualized treatment strategies, which enhances clinical effectiveness, reduces complication rates, and optimizes the economic aspect of care.
стравохід; грижа стравохідного отвору діафрагми; аргоноплазмова коагуляція; штучний інтелект
esophagus; hiatal hernia; argon plasma coagulation; artificial intelligence
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Cook MB, Thrift AP. Epidemiology of Barrett’s Esophagus and Esophageal Adenocarcinoma: Implications for Screening and Surveillance. Gastrointestinal Endoscopy Clinics of North America. 2021;1052-5157:32-45. doi: https://doi.org/10.1016/j.giec.2020.08.001.
- Fitzgerald RC, di Pietro M, Ragunath K, et al.; British Society of Gastroenterology. British Society of Gastroenterology guidelines on the diagnosis and management of Barrett’s oesophagus. Gut. 2014 Jan;63(1):7-42. doi: 10.1136/gutjnl-2013-305372.
- Thrift AP. Barrett’s esophagus and esophageal adenocarcinoma: How common are they really? Digestive Diseases and Sciences. 2018;63:1988-1996. doi: 10.1007/s10620-018-5068-6.
- Smyth EC, Lagergren J, Fitzgerald RC, et al. Oesophageal cancer. Nature Reviews Disease Primers. 2017 Jul 27;3:17048. doi: 10.1038/nrdp.2017.48.
- Qumseya B, Sultan S, Bain P, et al.; ASGE Standards оf Practice Committee. ASGE Standards of Practice Committee Chair. ASGE guideline on screening and surveillance of Barrett’s esophagus. Gastrointest Endosc. 2019 Sep;90(3):335-359.e2. doi: 10.1016/j.gie.2019.05.012.
- Shaheen NJ, Falk GW, Iyer PG, et al. Diagnosis and Ma–nagement of Barrett’s Esophagus: An Updated ACG Guideline. The American Journal of Gastroenterology. 2022;117(4):559-587. doi: 10.14309/ajg.0000000000001680.
- Visaggi P, de Bortoli N, Barberio B, et al. Artificial Intelligence in the Diagnosis of Upper Gastrointestinal Diseases. Journal of Clinical Gastroenterology. 2022 Jan;56(1):23-35. doi: 10.1097/MCG.0000000000001629.
- van der Sommen F, de Groof J, Struyvenberg M, et al. Machine learning in GI endoscopy: practical guidance in how to interpret a novel field. Gut. 2020 Nov;69(11):2035-2045. doi: 10.1136/gutjnl-2019-320466.
- Kahrilas PJ, Kim HC, Pandolfino JE. Approaches to the diagnosis and grading of hiatal hernia. Best Pract Res Clin Gastroenterol. 2008;22(4):601-616. doi: 10.1016/j.bpg.2007.12.007.
- Ma S, Tong Z, He Y, Zhang Y, Guo X, Qi X. Association between hiatal hernia and Barrett’s esophagus: an updated meta-ana–lysis with trial sequential analysis. Therap Adv Gastroenterol. 2024 Jan 6;17:17562848231219234. doi: 10.1177/17562848231219234.
- Manner H, May A, Kouti I, Pech O, Vieth M, Ell C. Efficacy and safety of Hybrid-APC for the ablation of Barrett’s esophagus. Surg Endosc. 2016 Apr;30(4):1364-1370. doi: 10.1007/s00464-015-4336-1.
- Knabe M, Wetzka J, Welsch L, et al. Radiofrequency ablation versus hybrid argon plasma coagulation in Barrett’s esophagus: a prospective randomised trial. Surg Endosc. 2023;37:7803-7811. doi: 10.1007/s00464-023-10313-5.
- Massimi D, Maselli R, Pecere S, et al. Efficacy and safety of H-APC in Barrett’s esophagus: Italian prospective multicenter study. Endosc Int Open. 2025 Feb 26;13:a25318227. doi: 10.1055/a-2531-8227.
- Shah SN, Chehade NEH, Tavangar A, Choi A, Monachese M, Chang KJ, Samarasena JB. Hybrid argon plasma coagulation in Barrett’s esophagus: a systematic review and meta-analysis. Clin Endosc. 2023 Jan;56(1):38-49. doi: 10.5946/ce.2022.179.
- Kolb JM, Wani S. Endoscopic eradication therapy for Barrett’s oesophagus: state of the art. Current Opinion in Gastroenterology. 2020 July;36(4):351-358. doi: 10.1097/MOG.0000000000000650.
- Hashimoto R, Requa J, Dao T, et al. Artificial intelligence using convolutional neural networks for real-time detection of early esophageal neoplasia in Barrett’s esophagus (with video). Gastrointest Endosc. 2020 Jun;91(6):1264-1271.e1. doi: 10.1016/j.gie.2019.12.049.