Международный эндокринологический журнал 4 (36) 2011
Вернуться к номеру
Гіпотиреоз: ушкодження органів та систем
Авторы: Приступюк О.М., Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Эндокринология
Версия для печати
Гіпотиреоз — це захворювання, що виникає внаслідок часткової або повної втрати функції щитоподібної залози (ЩЗ) та дії тиреоїдних гормонів на організм.
Синдром гіпотиреозу є найбільш поширеною ендокринною патологією після цукрового діабету (ЦД) типу 2. Загальна поширеність його сягає до 2 %. У літніх людей поширеність гіпотиреозу становить 10–12 %. А саме ця категорія пацієнтів є найбільш складною для вчасної діагностики через особливості психосоматичного стану пацієнтів, наявних уражень багатьох органів та систем, масованої медикаментозної терапії. Клінічні та соціальні наслідки гіпотиреозу такі:
— повільний розвиток захворювання та пізня діагностика його;
— нерозпізнаний гіпотиреоз може вважатись іншим захворюванням;
— гіпотиреоз вже у субклінічному стані порушує фізіологічне функціонування органів та систем людини.
Класифікація гіпотиреозу
1. Первинний гіпотиреоз
1.1. Набутий: автоімунний тиреоїдит, йодна недостатність, ятрогенний (післяопераційний, післярадіойодний, у тому числі опромінення шиї), використання ліків, що блокують біосинтез тиреоїдних гормонів (йод, аміодарон, літій, антитиреоїдні засоби, цитокіни, інтерферон), інфільтрація ЩЗ (амілоїдоз, саркоїдоз, гемохроматоз, зоб Ріделя), субклінічний.
1.2. Природжений: дефект транспорту та утилізації йоду, порушення органіфікації йодидів (дефіцит або дисфункція тиреопероксидази), порушення синтезу чи депонування тиреоглобуліну, дефекти рецептора тиреотропіну, аплазія або гіпоплазія ЩЗ, ідіопатична нечутливість рецептора до тиреотропіну.
2. Центральний гіпотиреоз:
2.1. Набутий: гіпофізарний (вторинний), гіпоталамічний (третинний).
2.2. Природжений: нестача тиреотропіну, порушення його структури, дефект рецепторів, резистентність до тиреоїдних гормонів.
3. Транзиторний гіпотиреоз: після підгострого або післяпологового тиреоїдиту, дефект конвертації тироксину в трийодтиронін, деструкція ЩЗ медикаментами.
Первинні гіпотиреози можуть бути природженими і набутими, вони становлять 95 % всіх випадків гіпотиреозу. Природжений гіпотиреоз виникає внаслідок відсутності залози, порушень біосинтезу тиреоїдних гормонів, внаслідок йодної недостатності, вживання менше 25 мкг йоду на добу впродовж тривалого періоду. Набуті форми первинного гіпотиреозу зумовлені деструкцією тканини ЩЗ чи видаленням органа (тиреоїдектомія). Деструкція залози під впливом високих енергій може відбутися після рент-генівського опромінення, лікування радіоактивним йодом чи поглинання ізотопів йоду внаслідок аварій на об’єктах атомної промисловості (атомні електростанції, заводи з переробляння радіоактивних речовин). Найчастіше причиною первинного гіпотиреозу є автоімунний тиреоїдит (АІТ). Поширення гіпотиреозу в цьому випадку досягає 20 %, при атрофічній формі тиреоїдиту — 90–100 % (ідіопатичний гіпотиреоз). Гнійні та автоімунні тиреоїдити, метастази пухлин спричинюють необоротні процеси у тканині ЩЗ і зниження її функціональної активності. Можлива блокада функції залози, зумовлена впливом значних доз тиреостатичних препаратів: тіонамідів, йодидів.
Центральні гіпотиреози виникають унаслідок парціальної нестачі тиреотропіну чи тотальної гіпофункції гіпофіза після його хірургічного видалення, руйнування потоками високих енергій чи некрозу органа на тлі масивних кровотеч (гіпопітуїтаризм).
За достатнього йодного забезпечення можливий розвиток гіпотиреозу в разі наявності природжених дефектів етапів біосинтезу гормонів: захвату йоду, порушення його органіфікації, йодування йодтирозинів та синтезу тиреоглобуліну.
Субклінічний гіпотиреоз характеризується нормальним рівнем тироксину та збільшенням умісту тиреотропіну. Він може виникати після вживання йодовмісних медикаментів, досліджень із застосуванням радіоактивного йоду чи контрастних препаратів із йодом, на тлі АІТ. Прогресування субклінічного гіпотиреозу спостерігається у 3–8 % жінок із рівнем ТТГ понад 10 мкОд/мл і наявністю антитіл до ЩЗ.
Транзиторний гіпотиреоз виникає внаслідок безсимптомних тиреоїдитів (підгострого, безсимптомного, післяпологового), лікування препаратами інтерферону. Серед чинників ризику гіпотиреозу виділяють генетичну схильність до автоімунних захворювань, асоційовану з алелями HLA-DR3, HLA-DR5.
Патогенетичною основою клінічних проявів гіпотиреозу є порушення енергетичного обміну внаслідок нестачі тиреоїдних гормонів, що призводить до зменшення основного обміну. Особливо це проявляється в органах і тканинах, що інтенсивно оновлюються. Тиреоїдні гормони справляють багатогранну дію на організм, впливаючи на всі органи та тканини й обмін речовин усіх видів. Зокрема, стимулюють термогенез, посилюють окисні процеси та поглинання кисню тканинами, підтримують нормальне функціонування центру дихання, посилюють скоротливість серця та моторику органів травлення, збільшують утворення еритропоетину та посилюють еритропоез. Нормальний рівень тиреоїдних гормонів потрібен для синтезу всіх структурних білків організму. Тиреоїдні гормони є гормонами з внутрішньо- клітинним типом циторецепції. Фізіологічну дію гормонів пов’язують із трийодтироніном (Т3), що активніший, ніж тироксин (Т4), у 4–5 разів. 20 % Т3 утворюється у ЩЗ, а 80 % — формується з Т4 внаслідок дейодування останнього. Через це Т4 розглядають як прогормон Т3. За добу в ЩЗ секретується 100 мкмоль Т4 і приблизно 5 мкмоль Т3. Перетворення тироксину в Т3 відбувається під впливом ферментів дейодаз. Розрізняють три типи дейодаз: тип 1 — міститься переважно в тканинах та органах (печінка, нирки, скелетні м’язи, міокард, ЩЗ); тип 2 — накопичується в центральній нервовій системі та гіпофізі й підтримує постійну внутрішньоклітинну концентрацію трийодтироніну в нервовій системі та ендокринних органах; тип 3 — виявляють у плаценті та гліальних клітинах нервової системи.
Розрізняють a- та b-рецептори. Вони обидва експресуються у тканинах, але співвідношення їх у різних органах не однакове; a-рецептори переважають у мозку, нирках, гонадах, м’язах та в серці; b-рецептори — у гіпофізі та печінці. Самі b-рецептори також існують у різних ізоформах. b2-ізоформа експресується переважно в гіпоталамусі та гіпофізі, де бере участь у процесах зворотного зв’язку тиреоїдної осі.
Після поєднання гормону з рецептором останній трансформується у фактор транскрипції, що зв’язується з певним доменом на ДНК. Може відбуватись стимулювання транскрипції генів із посиленням синтетичних процесів, наприклад, синтез білків. Або ж відбувається пригнічення транскрипції, наприклад b-ланки тиреотропіну.
Встановлено 3 внутрішньоклітинні мішені для дії тиреоїдних гормонів: а) плазматична мембрана; б) мітохондрії; в) ядро. На плазматичній мембрані чутливих до тиреоїдних гормонів клітин виявлені високоафінні ділянки зв’язування трийодтироніну. Результатом взаємодії з ними є стимулювання транспорту амінокислот. Відповідь виникає дуже швидко і не потребує синтезу відповідних інформаційної РНК та білка. У мітохондріях Т3 зв’язується з ферментом внутрішньої мембрани — транслоказою аденінових нуклеотидів — і активує його. Наслідком цього є посилення переходу АДФ із цитоплазми в мітохондрії. У результаті концентрація АДФ у мітохондріях зростає, що викликає збільшення інтенсивності біологічного окислення (принцип акцепторного контролю). Ядро є основною внутрішньоклітинною мішенню для Т3, що визначає довгострокові ефекти тиреоїдних гормонів. При зв’язуванні Т3 (меншою мірою Т4) з ядерними рецепторами відбувається індукція транскрипції і синтезу цілого ряду функціонально важливих білків. Серед них: Na-K-АТФаза плазматичних мембран; ферменти ліпогенезу (зокрема, НАДФ-малатдегідрогеназа); ферменти мітохондрій (a-гліцерофосфатдегідрогеназа); білкові компоненти b-адренорецепторів.
Усі біологічні ефекти, обумовлені дією тиреоїдних гормонів на клітини, можна розділити на 3 групи:
1. Анаболічна дія — вплив на ріст і диференціювання тканин.
2. Метаболічні ефекти — збільшення інтенсивності катаболічних процесів: окислювання, ліполізу.
3. Сенсибілізуючі ефекти — збільшення чутливості клітин до дії інших гормонів, зокрема естрогенів і катехоламінів. Щодо останніх сенсибілізуючий вплив тиреоїдних гормонів пов’язаний зі збільшенням кількості b2-адренорецепторів на поверхні клітин.
Тиреоїдні гормони впливають на ріст і диференціювання органів. У разі затримки синтезу тиреоїдних гормонів у людини затримується фізичний і психічний розвиток, порушується диференціювання скелета та нервової системи. У фізіологічних дозах тиреоїдні гормони стимулюють синтез внутрішньоклітинних білків, а в надмірних — посилюють дисиміляцію, спричиняють негативний азотистий баланс, посилюють азотурію та креатинурію. У разі нестачі тиреоїдних гормонів уповільнюються процеси еритропоезу, виникає анемія. Внаслідок сповільнення розпаду ліпідів в організмі накопичуються вільні жирні кислоти, холестерин, тригліцериди, зростає вміст холестерину в атерогенних фракціях ліпопротеїнів низької та дуже низької щільності.
Особливу роль відіграють процеси накопичення продуктів білкового обміну — глікозаміногліканів, похідних протеїнів, глюкуронової та хондроїтинсірчаної кислот. Вони накопичуються в інтерстиції, зумовлюючи слизоподібний (муцинозний) набряк. Внаслідок високої гідрофільності глікозаміногліканів накопичується вода та натрій у позасудинному просторі: у шкірі, серці, м’язах, порожнинах організму. Можливий розвиток гідротораксу, гідроперикарду, асциту. Тяжка форма гіпотиреозу зі значним муцинозним набряком називається мікседемою.
Дефіцит тиреоїдних гормонів у дітей спричинює сповільнення розумового та фізичного розвитку, аж до виникнення гіпотиреоїдної низькорослості та кретинізму.
При первинному гіпотиреозі внаслідок відсутності гальмівного впливу тиреоїдних гормонів на гіпофіз і гіпоталамус збільшується виділення тиреотропіну, тиреоліберину. Через імунологічну та структурну подібність тиреоліберину до пролактоліберину посилюється виділення пролактину з розвитком галактореї.
Гіпоталамо-гіпофізарна регуляція функції ЩЗ здійснюється шляхом впливу тиреотропін-рилізинг-гормону гіпоталамуса, що впливає на синтез тиреотропіну тиреотрофами гіпофіза. Тиреотропін — це глікопротеїн, що має у своєму складі дві поліпептидні ланки — a та b. Подібна a-ланка є в лютропіну, фолітропіну й хоріогоніну. Специфічну дію справляє b-ланка гормону, яка здатна взаємодіяти зі специфічним рецептором. Проте біологічно активним може бути лише тиреотропін, що складається з обох ланок. Тиреотропін сприяє синтезу оксиду азоту та зростанню кровотоку у ЩЗ, збільшує надходження йодиду у фолікул, посилює активність пентозофосфатного циклу, сприяє зростанню активності тиреопероксидази, синтезу тиреоїдних гормонів та тиреоглобуліну. Завдяки тиреотропіну тиреоглобулін надходить у плазму та інактивується у ній. Тиреотропін здатен посилювати мітоз разом з інсуліноподібним чинником росту 1 та чинником росту фолікулів.
Типовими скаргами хворих на гіпотиреоз є кволість, сонливість, сповільнення в рухах, ослаблення пам’яті, мерзлякуватість, стійкі запори, інколи хворих турбує значна сухість шкіри, набряки. У жінок спостерігають галакторею, мено- та метрорагії. Частота перерахованої симптоматики є такою: кволість, сонливість, сухість, огрубіння шкіри, сповільнення вимови, одутлість обличчя, випадіння волосся (до 90 %); мерзлякуватість (до 64 %), брадикардія (58–70 %); зниження пам’яті, зростання маси тіла, захрипання голосу (50–70 %), парестезії (до 52 %), запори (до 48 %), зниження слуху (до 22 %).
В останній час увагу дослідників та клініцистів захопила проблема, що отримала назву «позатиреоїдної патології». Річ у тому, що ті чи інші прояви тиреоїдної патології зустрічаються майже у третини людства. Периферична недостатність тиреоїдних гормонів може викликати різноманітні клінічні ознаки занадто віддалені від класичної маніфестації гіпотиреозу. Поліпшення діагностики захворювань ЩЗ, зокрема досконалі гормональні дослідження, дозволили виділити субклінічну форму гіпотиреозу, через що нетипові прояви гіпотиреозу стали зрозумілими як наслідок тривалої гормональної недостатності. Субклінічний гіпотиреоз, як і вся тиреоїдна патологія, частіше буває в жінок — втричі більше, ніж у чоловіків. За даними Фремінгемського дослідження, субклінічний гіпотиреоз трапляється у 5,9 % населення, у 7,7 % жінок та у 3,3 % чоловіків. Упродовж року в 5–15 % осіб із субклінічним гіпотиреозом він набирає рис маніфестного перебігу захворювання. Частота субклінічного гіпотиреозу зростає з віком, починаючи від 40 років. Та в цій проблемі є малопоінформованими лікарі-ендокринологи та лікарі первинної ланки надання медичної допомоги. Субклінічний перебіг гіпотиреозу маскується під інші соматичні чи навіть психічні захворювання. Хвороби серцево-судинної системи, органів травлення, органів репродукції, невротичні розлади, розлади психіки, імунні порушення навіть деякі онкологічні ураження розглядаються окремими захворюваннями, а не обумовленими гіпофункцією ЩЗ. Через велику залежність енергетичного обміну в головному мозку від достатнього рівня тиреоїдних гормонів вже незначне зменшення вмісту останніх відбивається на емоційному стані та інтелекті пацієнтів. Спостерігається пригнічення настрою, депресивні стани, погіршується пам’ять, зменшується активність до пізнання, що в цілому призводить до погіршення інтелекту. Спрямована діагностика патології ЩЗ, адекватна терапія синтетичними тиреоїдними гормонами попереджує прогресування вказаних процесів. Поширеність субклінічних проявів тиреоїдної патології обумовлюється впливом таких чинників: дефіцит йоду в довкіллі та забруднення його хімічними речовинами зі струмогенним впливом, радіонуклідами, куріння тютюну, медикаментозні навантаження на організм, зростання числа автоімунних захворювань у популяції.
Серцево-судинні прояви гіпотиреозу посідають перше місце у його клінічній маніфестації та можуть виступати «личиною» нетиреоїдних проявів гіпотиреозу. До останніх належать: артеріальна гіпертензія, аритмії, дисліпідемії, ішемічна хвороба серця, серцева недостатність.
Підвищення артеріального тиску (АТ) спостерігається в майже 50 % хворих на гіпотиреоз, досить часто воно є одним із перших його клінічних проявів. Особливістю гіпертензії за гіпотиреозу є значне зростання діастолічного АТ. Діастолічний тиск зростає через муцинозний набряк стінок судин, звуження судин заради збереження тепла за умов зменшення його продукції, зменшення вазодилатації через дефіцит тиреоїдних гормонів.
Типовим проявом порушення ритму серця при гіпотиреозі є синусова брадикардія та відсутність зростання частоти скорочень серця під час фізичних навантажень. Брадикардія виникає внаслідок зменшення чутливості адренорецепторів серця за умов нестачі тиреоїдних гормонів. На ЕКГ, крім синусової брадикардії, подовження інтервалу РQ, зниження вольтажу, може спостерігатись інверсія та двофазність зубця Т, депресія інтервалу SТ, як це буває у хворих на ІХС.
Зміни ліпідного обміну є найбільш вивченими метаболічними порушеннями, що властиві гіпотиреозу. Зростає вміст холестерину, тригліцеридів у плазмі крові. Спостерігається зміщення вмісту холестерину до атерогенних ліпопротеїнів низької та дуже низької щільності. Атерогенність посилюється активуванням перекисного окислення ліпідів через зменшення антипероксидного впливу тиреоїдних гормонів.
Гіпотиреоз зумовлює також зміни в міокарді внаслідок набряку міоцитів та інтерстицію, що в кінцевому результаті реалізується у фіброз. Порушується атріовентрикулярна провідність та провідність у міокарді. Діагностуються порушення ритму та провідності, які часто резистентні до стандартного протиаритмічного лікування. Розміри серця збільшуються, межі його зміщуються. Вказані зміни є наслідком як змін у міокарді, так і наслідком муцинозного випоту до перикарда з формуванням гідроперикарда. Наявність периферичних набряків розцінюється як прояв серцевої недостатності. Хоча набряки можуть бути наслідком рестриктивних змін у міокарді та периферичних муцинозних набряків.
Зміни органів травлення поряд із серцево-судинними розладами є частими проявами гіпотиреоїдної недостатності. Це, зокрема, запори, проноси, дисбіоз, виразки шлунка та дванадцятипалої кишки, гастрити, панкреатити, дискінези жовчних шляхів. Зазвичай більша частина цих проявів обумовлена нестачею тиреоїдних гормонів. Та без обстеження тиреоїдного статусу пацієнти тривало, безпідставно та безуспішно отримують різноманітну симптоматичну, а не замісну терапію.
Зміни органів виділення та репродукції проявляються більшою частотою уролітіазу, еректильною дисфункцією в чоловіків та дисменореєю — у жінок. Властиві ановуляторні цикли, аменорея або ж метрорагії, галакторея. Вказані зміни є причиною безплідності, патології вагітності та пологів, низької життєздатності немовлят. Не діагностований та не лікований у час вагітності гіпотиреоз у матері стає причиною зменшення інтелекту її дитини. Коефіцієнт інтелектуальності цих дітей зменшується, вони погано навчаються в школі. Коли відсутній активний скринінг гіпотиреозу в немовлят, діагноз захворювання встановлюється пізно. Якщо діагноз встановлено за клінічними проявами, то порушення вищої нервової здатності відновити неможливо. Це і є основною причиною кретинізму.
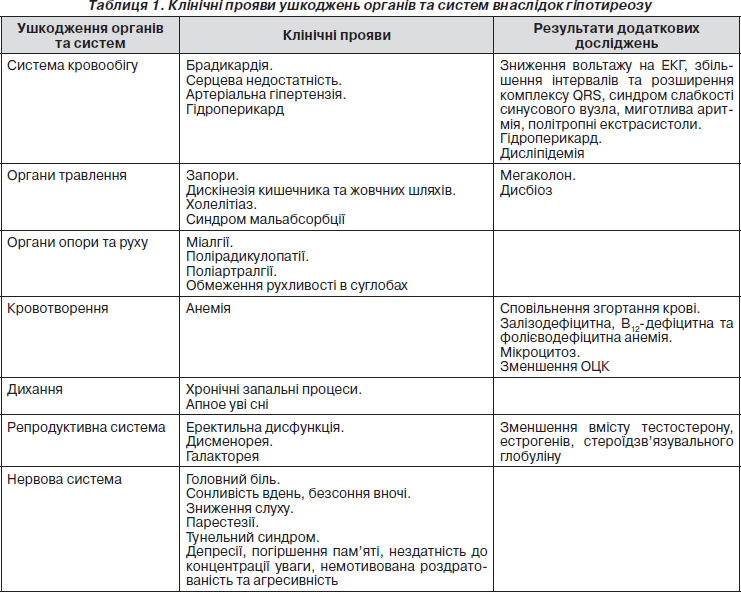
Зменшення насичення тканин тиреоїдними гормонами зменшує їх опірність до інфекційних чинників. Частими є хвороби респіраторної системи, хронічні запальні процеси верхніх дихальних шляхів, хронічні тонзиліти, синусити (табл. 1).
У хворих на маніфестний гіпотиреоз під час огляду шкіра суха, укрита лусочками, жовтувата, холодна на дотик, важко збирається у складку, за значної мікседеми на набряклій шкірі не залишається ямки після натискування пальцем. Виражений гіперкератоз, особливо на ліктях, колінах і стопах. Лице одутле, блідо-жовте, інколи з рум’янцем на щоках, виражений набряк навколо очей. Волосся на голові тьмяне, ламке, у випадках АІТ може бути локальна алопеція. Випадає волосся на зовнішніх краях брів, рідке або взагалі відсутнє волосся під пахвами та на лобку.
Гіпотиреоз у ряді випадків може бути складовою автоімунних полігландулярних синдромів, коли водночас ушкоджуються декілька ендокринних залоз, як правило з їхньою гіпофункцією. Найбільш поширеним є синдром автоімунної поліендокринопатії типу 2. Йому властивий первинний гіпокортицизм, гіпотиреоз (можливий тиреотоксикоз), ЦД типу 1, гіпогонадизм, міастенія, стеаторея. Із цими ендокринними ураженнями часто поєднуються вітиліго, алопеція, перніціозна анемія. Все ж найчастішим проявом вказаного синдрому є поєднання гіпокортицизму та гіпотиреозу (синдром Шмідта). У клініці синдрому поєднуються прояви хронічної недостатності надниркових залоз та тиреоїдної недостатності. Часто цей синдром супроводжується атрофією зорових нервів, тромбоцитопенічною пурпурою, склеродермією, нецукровим діабетом, пухлинами гіпофіза. Захворювання виникає у переважної більшості після 30 років, розпочинається з клінічних проявів хронічної надниркової недостатності, потім, приблизно з інтервалом у 7 років, приєднуються прояви ушкоджень інших ендокринних залоз. Хоча це не є обов’язковим, ознаки поєднаних патологій можуть виникати у термін до 20 років. На сьогодні визнається, що автоімунні ендокринопатії є комплексними захворюваннями, формування яких обумовлене взаємодією трьох основних чинників: генетичної спадковості, стану імунної системи і навколишнього середовища. Вагомим чинником автоімунної патології є спадковість. Початок автоімунного процесу в генетично схильних осіб ініціюють вірусні, бактеріальні інфекції, лікарські речовини, продукти харчування, іонізуюче випромінювання, гормони, стрес, вагітність, старіння.
Частим є розгортання гіпотиреозу на тлі ЦД типу 1. Якщо поширеність гіпотиреозу у популяції досягає в середньому 6 %, то у хворих на ЦД типу 1 цей показник зростає до 13 % з переважанням числа хворих жінок. Не є дивним поєднання тиреоїдної патології та ЦД типу 1, оскільки обом хворобам у патогенезі їх розвитку властиві автоімунні порушення. Через те до 30 % хворих на ЦД типу 1 жінок потерпають від різноманітної тиреоїдної патології. Разом з цим у хворих на ЦД типу 2 також поширеність гіпотиреозу є більшою, ніж у популяції в цілому. Обстеження пацієнтів зрілого віку хворих на ЦД типу 2 виявило гіпотиреоз у 5,7 %, у той же час в аналогічній віковій групі без ЦД типу 2 — лише в 1,8 %. Дослідженнями, виконаними у нашій клініці, встановлено, що найбільш критичним періодом маніфестації гіпотиреозу у хворих на ЦД типу 1 є термін захворювання у 15 років, для хворих на ЦД типу 2 — у 5 років.
Діагностика. Діагностика гіпотиреозу не є складною. Потрібно визначати вміст тиреотропіну (ТТГ) та Т4 у плазмі крові. Між умістом Т4 та ТТГ існує логарифмічна залежність, ТТГ чутливо реагує на зміни вмісту Т4. Незначне зменшення Т4 буде відображатись на зростанні ТТГ. Т4 синтезується у ЩЗ. Через це обидва показники надають достатньо інформації для встановлення діагнозу. Коли зменшений вміст Т4 та зростає вміст ТТГ — це є свідченням маніфестного гіпотиреозу. У разі зростання лише ТТГ мова йтиме про субклінічний гіпотиреоз. Постає питання яким категоріям хворих потрібно досліджувати ТТГ заради скринінгу субклінічного, а в ряді випадків і клінічного гіпотиреозу. Критичним віковим періодом є вік понад 40 років, особливо для жінок. Щорічний контроль ТТГ дозволить рано діагностувати субклінічний гіпотиреоз. Найбільш вразливою категорією є пацієнти із виявленими ушкодженнями ЩЗ під час ультразвукових досліджень: дифузні та вузлові ураження, гіпоплазія, аплазія залози, наявність сонографічних ознак, властивих АІТ. Оскільки переважна більшість ендокринних захворювань мають автоімунний патогенез та поєднуються у клінічному перебігу, всім ендокринним хворим потрібно досліджувати ТТГ щорічно. Стосовно хворих на ЦД, то через 5 років тривалості ЦД типу 2 та 15 років ЦД типу 1. Щорічні дослідження ТТГ дозволяють діагностувати гіпотиреоз своєчасно. Дослідження ТТГ повинно стати рутинною процедурою в обстеженні хронічно хворих, особливо з анеміями, дисліпідеміями, порушеннями серцевого ритму, моторики кишечника, поліартралгіями, дисменореєю, еректильною дисфункцією, інтелектуальними розладами, у дітей у випадку затримки психічного та соматостатевого розвитку.
Лікування. Лікування гіпотиреозу здійснюється синтетичними похідними L-тироксину. Розрахункова доза препарату становить 1,6–1,8 мкг на 1 кг маси тіла на добу, дітям — до 4 мкг. Пацієнтам похилого віку та з наявними серцево-судинними порушеннями доза препарату може бути вдвічі меншою з поступовим нарощуванням її, починаючи з 12,5 мкг на добу. Збільшення дози (подвоєння її) для цієї категорії пацієнтів здійснюється з інтервалом 4–6 тижнів, інколи він збільшується до 8 тижнів залежно від клінічного стану пацієнта. Контроль лікування здійснюється ви- значенням ТТГ кожні 3 місяці до досягнення еутиреозу (показники ТТГ 0,5–1,5 МО/л) та кожні 6 місяців — у стані еутиреозу. Чи потрібно призначати препарати L-тироксину хворим на гіпотиреоз зі стенокардією, порушеннями серцевого ритму? Необхідно! Щоб не виникало загострень у перебігу стенокардії чи аритмії, потрібен доволі повільний темп нарощування дози та призначення медикаментів кардіологічної групи.
Існують полярні думки щодо необхідності лікування субклінічного гіпотиреозу. Одна з них — це «лабораторний» гіпотиреоз, що медикаментозного лікування не потребує. Інша частина дослідників, ґрунтуючись на результатах досліджень вмісту ТТГ, вважає необхідним призначати замісне лікування пацієнтам із субклінічним гіпотиреозом препаратами L-тироксину. Як ми з’ясували попередньо, позаорганні порушення внаслідок гіпотиреозу розпочинаються зі стану субклінічного перебігу його, через це сумнівів у необхідності призначення L-тироксину не повинно бути.
Якщо хвора на субклінічний гіпотиреоз завагітніла, призначається L-тироксин у дозі, що підтримує показник ТТГ крові в межах 1–2 МО/л. Щотриместру вагітності дозу препарату переглядають відповідно до показника ТТГ.
Висновки
Гіпотиреоз — поширене ендокринне захворювання, особливо у жінок зрілого та похилого віку.
Клінічному перебігу гіпотиреозу властиві поліорганні порушення та поліморбідна симптоматика.
У стані субклінічного перебігу гіпотиреозу спостерігаються позатиреоїдні прояви ушкоджень органів та систем людини.
У всіх випадках підвищення вмісту тиреотропіну понад референтні значення необхідна замісна терапія препаратами L-тироксину.
Усім пацієнтам із чинниками ризику гіпотиреозу: хвороби щитоподібної залози, ендокринні захворювання, репродуктивні порушення, імунодефіцитні стани, анемії, дисліпідемії, порушення органів травної, серцево-судинної системи, поліневропатії, поліартралгії, вік понад 40 років — необхідні щорічні обстеження вмісту тиреотропіну заради своєчасної діагностики гіпотиреозу.
1. Ендокринологія / За ред. проф. П.М. Боднара. — Вінниця: Нова книга, 2010. — 464 с.
2. Паньків В.І. Практична тиреоїдологія. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
3. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Функциональная и клиническая тиреоидология. — М.: ОАО «Издательство «Медицина», 2007. — 816 с.