Международный эндокринологический журнал 2 (58) 2014
Вернуться к номеру
Використання автоантитіл для диференційної діагностики різних типів цукрового діабету (огляд літератури)
Авторы: Глоба Є.В., Зелінська Н.Б. - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Методы исследования, Эндокринология
Разделы: Справочник специалиста
Версия для печати
Стаття присвячена визначенню специфічних автоантитіл для диференційної діагностики цукрового діабету. Надана характеристика видів цих автоантитіл та методів діагностики для їх визначення.
Статья посвящена определению специфических аутоантител для дифференцированной диагностики сахарного диабета. Представлена характеристика видов этих аутоантител и методов диагностики для их определения.
The article deals with the definition of specific autoantibodies for differential diagnosis of diabetes mellitus. The characteristic of the types of these autoantibodies and diagnostic methods for their determination are provided.
автоантитіла, цукровий діабет, діагностика.
аутоантитела, сахарный диабет, диагностика.
autoantibodies, diabetes mellitus, diagnostics.
Статья опубликована на с. 121-125
До останнього часу практично всі випадки маніфестації цукрового діабету (ЦД) у дітей зі специфічними симптомами за наявності гіперглікемії, зниженого рівня С-пептиду зараховували до 1-го типу з подальшим призначенням інсулінотерапії. Але наразі відомо, що далеко не всі випадки ЦД можна віднести до автоімунного ЦД. З розвитком молекулярної генетики з’явилася реальна можливість вивчення генетичних мутацій у хворих на ЦД, що дозволяє в деяких випадках відмовитись від інсулінотерапії і призначати пероральні цукрознижуючі препарати зі значним покращенням перебігу захворювання. Йдеться, зокрема, про моногенний ЦД, а саме неонатальний ЦД та MODY (діабет дорослого типу в молодих).
За даними різних авторів, частота моногенного ЦД становить 1–10 % [1, 2], а отже, можна прогнозувати, що в Україні кількість дітей із моногенним ЦД може становити 100–800 осіб, яким наразі може бути встановлено неправильний діагноз і які можуть необґрунтовано отримувати лікування інсуліном.
Генетичне тестування моногенного діабету коштує занадто дорого, щоб його рекомендувати для проведення всім хворим на ЦД 1-го або 2-го типу [3], але оскільки в пацієнтів із неонатальним діабетом унаслідок мутацій у К-АТФ-залежних каналах бета-клітин, а також у хворих на MODY з мутаціями HNF1A або HNF4A існує надзвичайно висока чутливість до лікування препаратами сульфонілсечовини, таке тестування цілком обґрунтоване. У разі підтвердження генетичної природи цих варіантів ЦД рекомендовано зупинити інсулінотерапію і призначити препарати сульфонілсечовини, застосування яких значно поліпшує глікемічний контроль у пацієнтів [4–6]. Таким чином, дуже важливо встановити когорти пацієнтів, яким має проводитися генетичний скринінг, на підставі клінічних і лабораторних критеріїв.
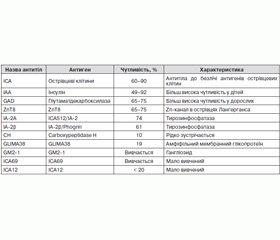
Визначення пацієнтів, які підлягають генетичному скринінгу, має ґрунтуватися на вивченні анамнезу (особливо сімейного у хворих із MODY), проведенні клінічного огляду й лабораторних досліджень (у т.ч. визначення автоантитіл (острівцево-клітинних цитоплазматичних автоантитіл (ICA), автоантитіл до тирозинфосфатази (IA-2), до глутаматдекарбоксилази (GAD), інсуліну (IAA) тощо), визначення рівня С-пептиду і глікованого гемоглобіну). Вищевказані специфічні антитіла є основним диференційним критерієм між автоімунним ЦД і моногенним (у т.ч. MODY). Саме тому для формування когорти пацієнтів, які підлягають генетичному скринінгу, слід рекомендувати визначення антитіл всім пацієнтам з уперше виявленим ЦД, включаючи дітей з маніфестацією ЦД віком до 9 місяців, особливо у віці від 6 до 9 міс.
Наявність специфічних автоантитіл є основною диференційно-діагностичною ознакою ЦД 1-го типу. Їх також використовують для прогнозування ЦД 1-го типу в осіб, які мають високий ризик захворювання, з метою раннього виявлення його доклінічного періоду. Наразі багато досліджень присвячено вивченню ролі автоантитіл у формуванні автоімунного процесу при ЦД 1-го типу. Йдеться, зокрема, про такі багатоцентрові дослідження, як DAISY, BABYDIAB, DIPP, TEDDY та ін. [7–11]. Вважають, що ці антитіла з’являються за 7 та більше років до маніфестації захворювання та їх виявляють у дебюті ЦД 1-го типу з частотою від 50 до 90 % на відміну від 1 % серед осіб загальної популяції [12]. Після руйнування бета-клітин та елімінації автоантигенів з організму зникають також специфічні антитіла.
За результатами дослідження BABYDIAB, діти з маніфестацією ЦД до 10 років мали перші ознаки автоімунного процесу вже у віці близько двох років. У разі виявлення антитіл у цьому віці ризик розвитку ЦД 1-го типу до пубертату становить 50 % [11]. Загалом у дітей після двох років IAA трапляються рідше, ніж GAD, поєднання кількох видів антитіл зустрічається нечасто, а розвиток ЦД 1-го типу не відбувається стрімко [13]. Прогресування ЦД 1-го типу з позитивними антитілами є значно швидшим у дітей віком до одного року порівняно з пацієнтами 2–5 років.
У разі виявлення антитіл у дітей найменшого віку слід пам’ятати, що у них можливий трансфер материнських антитіл через плаценту, а отже, до 18 місяців особливо важливим стає питання щодо їх походження: чи це de novo утворені антитіла в організмі дитини, чи антитіла є материнськими [14].
ЦД 1-го типу асоціюють із генами головного комплексу гістосумісності HLA, у ділянці DR3-DQ2 і DR4-DQ8 [15–16]. GAD найчастіше зустрічаються в пацієнтів із HLA DR3-DQ2, у той час як IAA та IA-2A — у пацієнтів із HLA DR4-DQ8. Пацієнти без вищезазначених гаплотипів часто мають негативні антитіла.
Прогнозування ризику розвитку ЦД 1-го типу тісно пов’язане з кількістю і поєднанням різних видів автоантитіл. Про ймовірність вищої частоти виникнення і більш швидкого прогресування захворювання свідчить наявність двох або більше видів автоантитіл, ніж лише одного виду (рис. 1), а також виявлення антитіл у високих титрах.
/122/122.jpg)
У 90 % родичів хворих на ЦД 1-го типу першого ступеня спорідненості, які мали антитіла до IA2, GAD або інсуліну, діабет розвивався протягом декількох років після виявлення антитіл [18]. У дітей із генетичною схильністю до ЦД 1-го типу, які мають 2 види антитіл та більше, у понад 50 % випадків ЦД 1-го типу розвивається протягом 10 років [13, 19–20].
За даними літератури, частота виявлення автоантитіл у хворих із класичним ЦД 1-го типу становить: ICA — 60–90 %, IAA — 16–69 %, GAD — 22–81 %, IA2 — 60–70 % [21, 22].
Автоантитіла до острівцевих клітин
Вперше цей вид антитіл було описано в 1974 р. [24]. Саме їх відкриття пов’язують із датою встановлення автоімунного генезу ЦД 1-го типу.
Найбільш специфічним вважають визначення антитіл до острівцевих клітин (ICA). Їх виявляють у 5–8 % родичів першого ступеня спорідненості [25]. Ці особи становлять групу підвищеного ризику розвитку ЦД 1-го типу. Появу ICA реєструють більше ніж за 10 років до маніфестації захворювання. Це дозволяє використовувати визначення цих антитіл для прогнозування ЦД 1-го типу, і чим вищий їх титр, тим більша вірогідність його розвитку. У ряді досліджень було показано, що в ICA-позитивних близьких родичів хворих на діабет згодом розвивається ЦД 1-го типу [25].
Одноразовий скринінг може спрогнозувати розвиток ЦД 1-го типу менше ніж у 20 % сімейних випадків хвороби, що пов’язано з персистуючим характером автоімунного процесу на доклінічній стадії захворювання. Для більшої інформативності потрібен тривалий моніторинг осіб, яких зараховують до групи високого ризику.
Дослідження показали, що ICA визначають у 60–90 % хворих з уперше виявленим ЦД 1-го типу порівняно з загальною популяцією осіб без діабету, у яких ICA виявляють лише в 0,1–0,5 % випадків [25].
У перші місяці маніфестації захворювання ICA виявляють у 70–90 % осіб, через 1–2 роки — тільки у 20 %, а через 15–20 років їх можна виявити лише у 5 % хворих.
Спрогнозувати ризик виникнення ЦД 1-го типу і підтвердити його діагноз дозволяють також інші антитіла, зокрема IA2, IAA та GAD.
Антитіла до глутаматдекарбоксилази
Антитіла до глутаматдекарбоксилази (GAD65 і GAD67) — ферменту, що міститься в бета-клітинах, GADергічних нейронах і деяких інших тканинах людини, виявляють у 80–90 % хворих з уперше виявленим ЦД 1-го типу. GAD бере участь у регуляції стимульованої глюкозою секреції інсуліну, з іншого боку, цей фермент каталізує синтез y-аміномасляної кислоти.
Антитіла до GAD65 є інформативним маркером для ідентифікації предіабету, а також для виявлення осіб з високим ризиком розвитку ЦД 1-го типу. Існує думка, що антитіла до GAD можуть виявлятися в крові людини за 7 років до початку клінічних проявів хвороби. За різними даними, GAD виявляють в 1–2 % здорових осіб, а чинниками, що пов’язані з підвищеними антитілами до GAD, є більш низька маса тіла при народженні та нещодавно перенесена екзема [26].
У цілому вважають, що ICA — більш чутливий маркер, ніж антитіла до GAD, особливо в дітей молодшого віку і в осіб чоловічої статі. З іншого боку, останні дослідження свідчать, що найбільш інформативними в діагностиці пізнього автоімунного діабету дорослих (LADA) є саме автоантитіла до GAD [27].
Антитіла до тирозинфосфатази (IA2)
Антитіла до тирозинфосфатази (IA2) також мають високу прогностичну цінність для ЦД 1-го типу, що не поступається ICA.
Тирозинфосфатаза — автоантиген острівцевих клітин, локалізований в щільних гранулах панкреатичних бета-клітин. IA-2А (також відомий як ICA 512 — антиген острівців підшлункової залози) та IA-2b (фогрін, гомолог фосфатази в гранулах інсуліноми або інсулінома-асоційований протеїн-2) на даний час є основними маркерними антигенами для ЦД 1-го типу, оскільки антитіла до них обох з’являються до клінічної маніфестації захворювання [28]. IA2 та ICA 512 експресуються в нейроендокринних клітинах, включаючи бета-, aльфа- і гамма-клітини острівців підшлункової залози, клітинах гіпофіза і мозкової речовини надниркових залоз.
За деякими даними, IA-2 разом з IAA зустрічаються частіше у дітей, ніж у дорослих пацієнтів, та вказують на агресивну деструкцію бета-клітин [18]. Появу IA-2 пов’язують з більшим ризиком розвитку ЦД 1-го типу, ніж наявність антитіл до GAD чи інсуліну [29]. Також ризик розвитку ЦД 1-го типу вищий у пацієнтів з антитілами IA-2А та IA-2, ніж у IA-2b негативних осіб [30].
Антитіла до інсуліну
Антитіла до інсуліну (IAA) виявляють у сироватці крові хворих ЦД 1-го типу за декілька місяців чи навіть років до появи клінічних симптомів ЦД 1-го типу, тобто вони з’являються на ранніх стадіях захворювання. Нерідко IАА визначають навіть у пацієнтів зі значною тривалістю захворювання і тривалою інсулінотерапією, що обумовлено імунологічною інсулінорезистентністю внаслідок утворення антитіл до екзогенного інсуліну. У хворих із вперше виявленим діабетом антитіла можуть вироблятися і до власного інсуліну [31]. Однією з суттєвих проблем, пов’язаних з визначенням IAA, є велика різноманітність лабораторних методів діагностики, і у світі є лише декілька клінічних лабораторій, що використовують необхідні високочутливі і специфічні методики для їх діагностики [32]. Для прогнозування ризику ЦД 1-го типу наявність лише IAA має низьку прогностичну цінність. До того ж IAA частіше зустрічають в осіб з рудим волоссям [26] та у 80–90 % дітей до 5-річного віку [33], а через 12 років після маніфестації ЦД 1-го типу вони майже не зустрічаються [34].
Антитіла до транспортера цинку 8
Нещодавно було виявлено нові автоантитіла до транспортера цинку 8 (ZnT8), який вважають також одним з антигенів бета-клітин. Вважають, що ці антитіла можуть виявляти у 26 % хворих ЦД 1-го типу, у яких інші 3 види антитіл негативні [35], тобто визначення цього виду антитіл може збільшити до 98 % доказовість автоімунного процесу при ЦД 1-го типу.
ZnT8 є білком секреторних гранул бета-клітин [36]. Вважають, що інсулін зберігається у везикулах з розташованими по їх краях іонами цинку, які під впливом підвищення глікемії вивільняються разом з інсуліном. Згідно з останніми даними, антитіла до ZnT8 виявляють у 63 % хворих із ЦД 1-го типу, у 81 % дітей з ЦД 1-го типу (що було продемонстровано в дослідженні BABYDIAB [37]), у 2 % здорового населення і у 3 % пацієнтів з ЦД 2-го типу [36].
Виявлення цих антитіл також пов’язують із високим ризиком розвитку ЦД 1-го типу. На відміну від інших автоантитіл ZnT8 не пов’язані з генами головного комплексу гістосумісності HLA II класу, у ділянці DR3-DQ2 і DR4-DQ8, а отже, вони можуть мати особливе значення в пацієнтів із низьким генетичним ризиком ЦД 1-го типу та в осіб старшого віку (у яких IAA менш поширені) та IA-2 негативних пацієнтів [38].
У пацієнтів наявність усіх трьох антитіл (GAD, IA-2 і ZnT8) дозволяє визначити фенотип із більш раннім дебютом ЦД та більшою інсуліновою недостатністю (вищою гіперглікемією натще, високим показником глікованого гемоглобіну) [25].
Слід зазначити, що для визначення різних видів антитіл застосовують різні методи діагностики (найчастіше — імуноферментний (ІФА) (ELISA) чи радіоімунний (РІА) із специфічними маркерами), неналежне використання яких може призвести до хибних чи некоректних результатів. Вважають, що визначення автоантитіл досі є процесом трудомістким, технічно складним і погано стандартизованим [39–41].
Зокрема, ІФА має певні переваги порівняно з РІА: цей метод є більш простим і безпечним, потребує менше часу для дослідження, має високу чутливість, реагенти залишаються стабільними впродовж тривалого зберігання, має відносно низьку вартість тощо. Однак в ІФА є і недоліки. Насамперед ІФА часто дає хибнопозитивні і хибнонегативні результати. Хибнопозитивні можуть виникати у разі наявності у хворого різних автоімунних і системних захворювань (зокрема, позитивного ревматоїдного фактора, автоімунного тиреоїдиту тощо), порушення обміну речовин, під час прийому деяких лікарських препаратів; у новонароджених такі хибнопозитивні реакції можуть виникати за рахунок утворення в організмі дитини антитіл до IgG матері. Хибнонегативні результати ІФА обумовлені конкуренцією між IgМ і IgG, а також технічними помилками під час проведення дослідження [23].
З іншого боку, методи РІА прийняті за еталонні й застосовуються у провідних клінічних і дослідницьких центрах у світі як найбільш чутливі і специфічні. Але істотним недоліком методу РІА є його трудомісткість і необхідність використання радіонуклідів.
Саме тому для поліпшення якості результатів вимірювань Всесвітня організація охорони здоров’я затвердила використання певних стандартів для визначення GAD та IA-2 антитіл [32]. Прогрес у впровадженні міжнародних стандартів для визначення IAA йде повільно. Крім того, досі розробляються і стандарти для визначення автоантитіл до ZnT8. Для подальшої розробки і впровадження стандартизованих методів діагностики антитіл була створена Діабетична стандартизована програма для визначення антитіл (DASP), яка проводить спеціальні тренінги для багатьох лабораторій світу, завдяки чому вдалося значно покращити якість визначення антитіл. Зокрема, йдеться також про впровадження нових методів діагностики, а саме електрохемілюмінесцентного (ECL), що продемонстрував високу чутливість та специфічність [42].
Наприкінці слід зазначити, що кожному пацієнту (особливо віком до 35 років) з уперше виявленим ЦД, окрім звичайних лабораторних методів, слід рекомендувати визначення всіх специфічних антитіл, враховуючи, що дослідження якомога більшої їх кількості допоможе в диференційній діагностиці ЦД 1-го типу і моногенного діабету та формуванні відповідних когорт для генетичного тестування. Однак, згідно з останніми даними, навіть у пацієнтів з MODY можуть бути наявні специфічні автоантитіла (від 1 до 25 % випадків [43]), зокрема GAD, і навіть IA-2 [43, 44], що свідчить про необхідність подальшого пошуку адекватних критеріїв включення для генетичного дослідження моногенного діабету.
1. Lebi J., Pruhova S., Dusatkova P. et al. Does continuous targeted medical education increase the rate of referrals for genetic testing for MODY? The Czech experience // Pediatric Diabetes. — 2012. — Vol. 13 (S.17). — P. 32.
2. Fendler W., Borowiec M., Baranowska-Zazwiecka A. et al. Prevalence of monogenic diabetes amongst Polish children after a nationwide genetic screening campaign — joint epidemiologic report of the PolPedDiab Collаboration and the TEAM Programme // Pediatric Diabetes. — 2012. — Vol. 13 (S.17). — P. 42.
3. Besser R., Shepherd M., McDonald T. et al. Urinary C-Peptide creatinine ratio is a practical outpatient tool for identifying Hepatocyte Nuclear Factor 1-a/Hepatocyte Nuclear Factor 4-a Maturity-Onset Diabetes of the Young from lon-duration type 1 diabetes // Diabetes Care. — 2011. — Vol. 34, № 2. — Р. 286–291.
4. Ellard S., Bellanné–Chantelot C., Hattersley A. Best practice guidelines for the molecular genetic diagnosis of maturity-onset diabetes of the young // Diabetologia. — 2008.
5. Shepherd M., Pearson E., Houghton J., Salt G., Ellard S., Hattersley A. No deterioration in glycemic control in HNF-1alpha maturity-onset diabetes of the young following transfer from long-term insulin to sulphonylureas // Diabetes Care. — 2003. — Vol. 26 (11). — P. 3191–3192.
6. Global IDF/ISPAD Guideline for diabetes in childhood and adolescence // IDF 2011. — P. 31–37.
7. Barker J.M., Barriga K.J., Yu L. et al. Diabetes Autoimmunity Study in the Young. Prediction of autoantibody positivity and progression to type 1 diabetes: Diabetes Autoimmunity Study in the Young (DAISY) // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89. — P. 3896–3902.
8. Ziegler A.G., Rewers M., Simell O. et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children // JAMA. — 2013. — Vol. 309. — P. 2473–2479.
9. Parikka V., Näntö-Salonen K., Saarinen M. et al. Early seroconversion and rapidly increasing autoantibody concentrations predict prepubertal manifestation of type 1 diabetes in children at genetic risk // Diabetologia. — 2012. — Vol. 55. — P. 1926–1936.
10. Vehik K., Fiske S.W., Logan C.A. et al. The TEDDY Study Group. Methods, quality control and specimen management in an international multicentre investigation of type 1 diabetes: TEDDY // Diabetes Metab. Res. Rev. — 2013. — 29. — 557–567.
11. Ziegler A.G., Hummel M., Schenker M., Bonifacio E. Autoantibody appearance and risk for development of childhood diabetes in offspring of parents with type 1 diabetes: the 2 year analysis of the German BABYDIAB Study // Diabetes. — 1999. — Vol. 48. — P. 460–468.
12. Winter W.E., Harris N., Schatz D. Immunological markers in the diagnosis and prediction of autoimmune type 1 diabetes // Clinical Diabetes. — 2002. — Vol. 20 (4). — P. 183–191.
13. Hummel M., Bonifacio E., Schmid S., Walter M., Knopff A., Ziegler A.G. Brief communication: early appearance of islet autoantibodies predicts childhood type 1 diabetes in offspring of diabetic parents // Ann. Intern. Med. — 2004. — Vol. 140 (11). — P. 882–6.
14. Naserke H.E., Bonifacio E., Ziegler A.G. Prevalence, characteristics and diabetes risk associated with transient maternally acquired islet antibodies and persistent islet antibodies in offspring of parents with type 1 diabetes // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 4826–4833.
15. Todd J.A., Bell J.I., McDevitt H.O. HLA-DQ beta gene contributes to susceptibility and resistance to insulin–dependent diabetes mellitus // Nature. — 1987. — 329. — P. 599–604.
16. Redondo M.G., Eisenbarth G.S. Genetic control of autoimmunity in type 1 diabetes and associated disorders // Diabetologia. — 2002. — 45. — P. 605–622.
17. Verge et al. Prediction of type I diabetes in first-degree relatives using a combination of insulin, GAD, and ICA512bdc/IA-2 autoantibodies // Diabetes. — 1996. — Vol. 45. — P. 926–933.
18. Verge C.F., Gianani R., Kawasaki E., Yu L., Pietropaolo M., Chase H.P., Eisenbarth G.S. Number of аutoantibodies (against insulin, GAD or ICA512/IA2) rather then particular autoantibody specificities determines risk of type 1 diabetes // J. Autoimmun. — 1996. — Vol. 9 (3). — Р. 379–383.
19. Bingley P.J., Gale E.A. European Nicotinamide Diabetes Intervention Trial (ENDIT) Group. Progression to type 1 diabetes in islet cell antibody-positive relatives in the European Nicotinamide Diabetes Intervention Trial: the role of additional immune, genetic and metabolic markers of risk // Diabetologia. — 2006. — Vol. 49 (5). — Р. 881–890.
20. Krischer J.P., Cuthbertson D.D., Yu L., Orban T., Maclaren N., Jackson R. et al. Screening strategies for the identification of multiple antibody–positive relatives of individuals with type 1 diabetes // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88 (1). — P. 103–108.
21. Heras P., Mantzioros M., Mendrinos D., Heras V., Hatzopoulos A. et al. Autoantibodies in type 1 diabetes // Diabetes Res. Clin. Pract. — 2010. — Vol. 90 (2). — P. 40–42.
22. Петряйкина Е., Рытикова Н. Диагностика сахарного диабета 1 и 2 типов // Лечащий врач. — 2005. — № 5. — С. 21–24.
23. Горст К.А. Оценка возможности выявления антител к инсулину методом иммуноферментного анализа: Дипломная работа. — Московский государственный университет им. М.В. Ломоносова. Биологический факультет, кафедра биохимии. Москва, 2010. — 46 с.
24. Bottazzo G.F., Florin-Christensen A., Doniach D. Islet-cell antibodies in diabetes mellitus with autoimmune polyendocrine deficiencies // Lancet. — 1974. — Vol. 2 (7892). — Р. 1279–83.
25. Никонова Т.В., Шаповальянц О.С. Диагностическая и прогностическая значимость аутоантител при сахарном диабете. Новый маркер аутоиммунного процесса — антитела к ZnT8 // Сахарный диабет. — 2011. — № 2. — С. 18–22.
26. Ponsonby A., Pezic A., Cameron F.J., Rodda C., Ellis J.A., Kemp A.S., Carlin J., Dwyer T. Phenotypic and environmental factors associated with elevated autoantibodies at clinical onset of paediatric type 1 diabetes mellitus // Results Immunol. — 2012. — № 2. — P. 125–131.
27. Palmer J.P., Hampe C., Chiu H., Goel A., Brooks-Worrell B.M. Is latent autoimmune diabetes in adults distinct from type 1 diabetes or just type 1 diabetes at an older age? // Diabetes. — 2005. — Vol. 54, Suppl. 2. — P. 62–67.
28. Torii S. Expression and function of IA-2 family proteins, unique neuroendocrine-specific protein-tyrosine phosphatases // Endocr. J. — 2009. — Vol. 56 (5). — Р. 639–648.
29. Bonifacio E., Lampasona V., Bingley P.J. IA-2 (islet cell antigen 512) is the primary target of humoral autoimmunity against type 1 diabetes–associated tyrosine phosphatase autoantigens // J. Immunol. — 1998. — Vol. 161 (5). — Р. 2648–2654.
30. Achenbach P., Warncke K., Reiter J., Naserke H.E. et al. Stratification of type 1 diabetes risk on the basis of islet autoantibody characteristics // Diabetes. — 2004. — Vol. 53. — P. 384–392.
31. Palmer J.P., Asplin C.M., Clemons P. et al. Insulin antibodies in insulin-dependent diabetics before insulin treatment // Science. — 1983. — Vol. 222. — Р. 1337–1339.
32. Mueller P.W., Achenbach P., Lampasona V., Schlosser M., Williams A.J. Type 1 Diabetes Autoantibodies. Prediction and Diagnosis of Autoimmune Diabetes // Clinical Laboratory News. — 2010. — Vol. 36 (10). — P. 8–10.
33. Achenbach P., Koczwara K, Knopff A., Naserke H., Ziegler A., Bonifacio E. Mature high-affinity immune responses to (pro) insulin anticipate the autoimmune cascade that leads to type 1 diabetes // J. Clin. Invest. — 2004. — Vol. 114(4). — P. 589–597.
34. Vardi P., Ziegler A., Matthews J.H., Dib S., Keller R., Ricker A. et al. Concentration of insulin autoantibodies at onset of type 1 diabetes. Inverse log-linear correlation with age // Diabetes care. — 1988. — Vol. 11(9). — P. 736–739.
35. Wenzlau J.M., Juhl K., Yu L., Moua O. et al. The cation efflux transporter ZnT8 (Slc30A8) is a major autoantigen in human type 1 diabetes // Proceedings of the National Academy of Sciences (U.S.). — 2007. — Vol. 104 (43). — P. 17040–17045.
36. Wenzlau J.M., Moua O., Sarkar S.A., Yu L., Rewers M., Eisenbarth G.S., Davidson H.W., Hutton J.C. SlC30A8 Is a Major Target of Humoral Autoimmunity in Type 1 Diabetes and a Predictive Marker in Prediabetes // Ann. N. Y. Acad. Sci. — 2008. — Vol. 1150. — P. 256–259.
37. Achenbach P., Lampasona V., Landherr U. et al. Autoantibodies to zinc transporter 8 and SLC30A8 genotype stratify type 1 diabetes risk // Diabetologia. — 2009. — Vol. 52. — P. 1881–1888.
38. Long A., Gooneratne A.T., Rokni S., Williams A.J., Bingley P.J. The Role of Autoantibodies to Zinc Transporter 8 in Prediction of Type 1 Diabetes in Relatives: Lessons from the European Nicotinamide Diabetes Intervention Trial (ENDIT) Cohort // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97. — P. 632–637.
39. Lendrum R., Walker G., Gamble D.R. Islet-cell antibodies in juvenile diabetes mellitus of recent onset // Lancet. — 1975. — Vol. 1. — P. 880–882.
40. Maclaren N.K., Huang S.W., Fogh J. Antibody to cultured human insulinoma cells in insulin-dependent diabetes // Lancet. — 1975. — Vol. 1. — P. 997–1000.
41. MacCuish A.C., Irvine W.J., Barnes E.W., Duncan L.J. Antibodies to pancreatic islet cells in insulin-dependent diabetics with coexistent autoimmune disease // Lancet. — 1974. — Vol. 2. — P. 1529–1531.
42. Polly J.B., Alistair J.K. Islet Autoantibody Testing: An End to the Trials and Tribulations?// Diabetes. — 2013. — Vol. 62(12). — P. 4009–4011.
43. Urbanová J., Rypáčková B., Procházková Z., Kučera P., Cerná M., Anděl M, Heneberg P. Positivity for islet cell autoantibodies in patients with monogenic diabetes is associated with later diabetes onset and higher HbA1c level // Diabet Med. — 2013. — Sep 16. doi: 10.1111/dme.12314. [Epub ahead of print].
44. McDonald T.J., Colclough K., Brown R., Shields B., Shepherd M., Bingley P., Williams A., Hattersley A.T. and Ellard S. Islet autoantibodies can discriminate maturity-onset diabetes of the young (MODY) from Type 1 diabetes // Diabet. Med. — 2011. — Vol. 28. — Р. 1028–1033.

/122/122_2.jpg)