Международный эндокринологический журнал 4 (60) 2014
Вернуться к номеру
Тривалість стаціонарного лікування хворих на цукровий діабет 2-го типу із синдромом діабетичної стопи залежно від стану компенсації вуглеводного обміну
Авторы: Безродний Б.Г., Приступюк М.О., Мартинович Л.Д. - Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Мета роботи: вивчити вплив компенсації цукрового діабету (ЦД) 2-го типу на тривалість стаціонарного лікування хворих із синдромом діабетичної стопи (СДС) нейроішемічної форми. Матеріали й методи дослідження. Обстежені 363 пацієнти (164 чоловіки й 199 жінок), які перебували на лікуванні в хірургічному стаціонарі у зв’язку з СДС нейроішемичної форми. Діагноз захворювання встановлювали шляхом дослідження периферичної чутливості й оцінки стану кровотоку в нижніх кінцівках. Опитування хворих проводилося з використанням шкал неврологічної симптоматики NSS-neurological symptoms score і TSS-total symptoms score. Тактильна чутливість визначалася за допомогою монофіламенту (Semmens-Weinstein), стандартизованого за тиском 10 г/см2, больова — неврологічною голкою Neuropen, температурна — за допомогою термоциліндра Tip-term, вібраційна — з використанням градуйованого камертона Riedel Seifert, 128 Гц. Стан компенсації ЦД оцінювали за вмістом глікованого гемоглобіну (HbA1c). Лікування хворих здійснювали відповідно до вітчизняних протоколів лікування СДС з урахуванням рекомендацій Міжнародної робочої групи з діабетичної стопи (International Working Group on the Diabetic Foot, IWGDF). Результати дослідження. Розріз абсцесів і флегмон було здійснено в 60 % жінок і в 40 % чоловіків, ампутації різного рівня — в 20 % жінок і 40 % чоловіків. Вік чоловіків, яким робили ампутації, був понад 66 років, жінок — понад 70 років. Тривалість пері- і післяопераційного лікування в стаціонарі залежала від ступеня компенсації вуглеводного обміну у хворих. Висновки. Тривалість стаціонарного лікування хворих із нейроішемічною формою СДС при показнику HbA1c 12,6 ± 1,2 % становила 16,60 ± 0,26 дня для чоловіків і 18,95 ± 0,51 — для жінок. При показнику HbA1c 15,5 ± 1,0 % тривалість перебування в стаціонарі становила 34,66 ± 0,40 дня і 31,42 ± 1,18 дня відповідно. Найкраще загоєння післяопераційних ран спостерігається при середньодобовому показнику глікемії не більше 10 ммоль/л.
Цель работы. Изучить влияние компенсации сахарного диабета (СД) 2-го типа на длительность стационарного лечения больных с синдромом диабетической стопы (СДС) нейроишемической формы. Материалы и методы исследования. Обследовано 363 пациента (164 мужчины и 199 женщин), которые находились на лечении в хирургическом стационаре в связи с СДС нейроишемической формы. Диагноз заболевания устанавливали путем исследования периферической чувствительности и оценки состояния кровотока в нижних конечностях. Опрос больных проводился с использованием шкал неврологической симптоматики NSS-neurological symptoms score и TSS-total symptoms score. Тактильная чувствительность определялась с помощью монофиламента (Semmens-Weinstein), стандартизованного по давлению 10 г/см2, болевая — неврологической иглой Neuropen, температурная — с помощью термоцилиндра Tip-term, вибрационная — с использованием градуированного камертона Riedel Seifert, 128 Гц. Состояние компенсации СД оценивали по содержанию гликированного гемоглобина (HbA1c). Лечение больных осуществляли в соответствии с отечественными протоколами лечения СДС с учетом рекомендаций Международной рабочей группы по диабетической стопе (International Working Group on the Diabetic Foot, IWGDF). Результаты исследования. Вскрытие абсцессов и флегмон было осуществлено у 60 % женщин и у 40 % мужчин, ампутации различного уровня — у 20 % женщин и 40 % мужчин. Возраст мужчин, которым производили ампутации, был свыше 66 лет, женщин — более 70 лет. Длительность пери- и послеоперационного лечения в стационаре зависела от степени компенсации углеводного обмена у больных. Выводы. Длительность стационарного лечения больных с нейроишемической формой СДС при показателе HbA1c 12,6 ± 1,2 % составила 16,60 ± 0,26 дня для мужчин и 18,95 ± 0,51 — для женщин. При показателе HbA1c 15,5 ± 1,0 % длительность нахождения в стационаре составила 34,66 ± 0,40 дня и 31,42 ± 1,18 дня соответственно. Наилучшее заживление послеоперационных ран наблюдается при среднесуточном показателе гликемии не более 10 ммоль/л.
Aim of the Study. To investigate the effect of type 2 diabetes mellitus (DM) compensation on the duration of inpatient treatment of patients with neuroischemic diabetic foot syndrome (DFS). Materials and Methods of the Study. We examined 363 patients (164 men and 199 women), who were treated in surgical hospital for neuroischemic DFS. The diagnosis was established by studying peripheral sensitivity and assessment of blood flow in the lower extremities. The survey of patients was conducted with NSS (Neurological symptoms score) and TSS (Total symptoms score). Tactile sensitivity was determined using monofilament (Semmens-Weinstein), standardized by 10 g/cm2 pressure, pain — neurological needle Neuropen, temperature — using Tip-term thermal cylinder, vibration — a graduated tuning-fork Riedel Seifert, 128 Hz. Compensation of DM was evaluated according to glycated hemoglobin (HbA1c) content. Treatment of patients was carried out according to national treatment protocols for DFS taling into account guidelines of International Working Group on the Diabetic Foot (IWGDF). Results of the Study. Lancing of abscess and phlegmons was done in 60 % of women and 40 % of men, amputations of different levels — in 20 % of women and 40 % of men. Age of men to whom amputation was conducted was over 66 years, women — over 70 years. Duration of peri- and postoperative treatment depended on the degree of carbohydrate metabolism compensation in patients. Conclusions. Duration of hospitalisation of patients with neuroischemic DFS in HbA1c level 12.6 ± 1.2 % was 16.60 ± 0.26 days for men and 18.95 ± 0.51 — for women. With average HbA1c level 15.5 ± 1.0 % the duration of hospital stay was 34.66 ± 0.40 days and 31.42 ± 1.18 days, respectively. Best healing of surgical wounds was observed at average daily glycemia no more than 10 mmol/l.
цукровий діабет 2-го типу, синдром діабетичної стопи нейроішемічної форми, глікований гемоглобін.
сахарный диабет 2-го типа, синдром диабетической стопы нейроишемической формы, гликированный гемоглобин.
diabetes mellitus type 2, neuroischemic diabetic foot syndrome, glycated hemoglobin.
Статья опубликована на с. 36-40
Вступ
Синдром діабетичної стопи (СДС) належить до поширеної хірургічної патології у хворих на цукровий діабет (ЦД). Переважна кількість ампутацій у хворих обумовлюється наслідками СДС. Згідно із статистикою МОЗ України, у 2011 році в державі здійснено 3321 ампутацію нижніх кінцівок у хворих на ЦД. Поширеність ампутацій становила 0,74 випадку на 10 тисяч населення з післяопераційною летальністю 6,12 %. У 2012 році проведено 3370 ампутацій (післяопераційна летальність 6,05 %), у 2013 році — 3098 ампутацій (післяопераційна летальність 6,33 % [2–4]. Після аналізу результативності активного лікування виразок у хворих на СДС висловлено припущення, що до 85 % ампутацій можна уникнути. Для цього потрібна адекватна оцінка свого стану пацієнтом, ефективна діагностика та оптимальне лікування командою лікарів-спеціалістів [11, 14]. Зазвичай розвитку діабетичної виразки стопи сприяє діабетична нейропатія та травми стопи внаслідок втрати чутливості. Втрата чутливості та деформація стоп спричинюють виникнення виразок у ділянках підвищеного плантарного тиску. В подальшому прогресуванню виразок сприяють бактеріальна та мікозна дисемінація, прогресування атеросклеротичних уражень, що притаманне погано компенсованому ЦД. Часто ЦД 2-го типу діагностується на тлі виразково-некротичних уражень стоп. Актуальними питаннями у сенсі збереження опорної здатності нижньої кінцівки, уникнення ампутацій є активне виявлення хворих на ЦД 2-го типу, досягнення у них стійкої та тривалої компенсації ЦД, своєчасна діагностика периферичної сенсорної нейропатії.
Мета роботи — встановити значення стану компенсації ЦД за показником глікованого гемоглобіну (HbA1c) для часу загоєння виразкових уражень та гнійних процесів у хворих із нейроішемічною формою СДС та тривалість їх лікування в хірургічному стаціонарі.
Матеріали та методи дослідження
Дослідження здійснено у Київській міській клінічній лікарні № 4 — клінічній базі кафедри хірургії № 2 Національного медичного університету імені О.О. Богомольця. Обстежували хворих на ЦД 2–го типу, які лікувалися у хірургічному стаціонарі у термін з 1 січня 2010 року до 31 грудня 2013 року. Діагноз нейроішемічної форми СДС встановлювали дослідженнями периферичної чутливості та стану кровообігу в нижніх кінцівках пацієнтів. Опитування хворих виконували з використанням шкал неврологічної симптоматики: NSS-neurological symptoms score та TSS-total symptoms score [9, 10]. Враховували типові прояви периферичної діабетичної нейропатії: біль, відчуття жару, затерпання, гіперестезії, дизестезії, судоми нижніх кінцівок. Відповідно до шкали NSS прояви симптомів оцінювали у балах: 0 — симптому немає, 1 — симптом є, 2 — симптоми наростають у спокої. Периферичну чутливість досліджували так. Тактильну чутливість визначали за допомогою монофіламенту, стандартизованого еквівалентно до тиску 10 г/см2 (Semmens — Weinstein), больову чутливість — неврологічною голкою Neuropen, температурну — аплікацією термоциліндрика Tip-term; вібраційну чутливість — градуйованим камертоном Riedel Seifert, 128 Гц. Також визначали стан ахіллового рефлексу за допомогою неврологічного молоточка. Стан магістрального току крові оцінювали за допомогою міні-еходопплера та обчислювали показник кісточково-плечового індексу (КПІ). За наявності діабетичної периферичної нейропатії та показника КПІ до 0,8 встановлювався діагноз нейропатичної форми СДС, показники КПІ 0,8–0,5 були підставою для встановлення діагнозу СДС нейроішемічної форми, показники КПІ менше 0,5 свідчили про наявність ішемічної форми СДС.
Компенсацію ЦД на час госпіталізації пацієнтів оцінювали за показниками HbA1c, який визначали у ліцензованих лабораторних центрах. Під час стаціонарного лікування проводили визначення глюкози капілярної крові натще та впродовж доби. Відповідно до Уніфікованого клінічного протоколу МОЗ України про надання медичної допомоги хворим на ЦД 2-го типу, ЦД вважається компенсованим за показником глікемії натще до 5,56 ммоль/л, на тлі харчування — до 10 ммоль/л [5]. У контролі за пацієнтами ми намагалися досягти зазначених показників глікемії. Заради своєчасної діагностики гіпоглікемічних станів у клінічному спостереженні враховували появу тахікардії, стенокардії, підвищення АТ, невмотивовану пітливість, порушення сну.
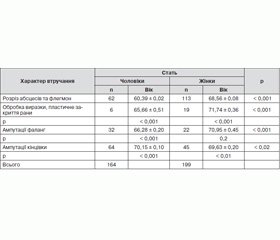
Під спостереженням перебували 363 пацієнти з нейроішемічною формою СДС, у тому числі 164 чоловіки (45 %) та 199 жінок (55 %). До надходження в стаціонар у пацієнтів був стан декомпенсації ЦД (табл. 2).
До госпіталізації пацієнти зазвичай лікувалися пероральними цукрознижувальними препаратами у максимально допустимих дозах. З урахуванням наявності виразково-трофічних уражень усім пацієнтам було призначено препарати інсуліну. Призначаючи для лікування інсулін, ми керувалися необхідністю досягнення компенсації ЦД та можливістю посилення метаболічних процесів у хворих під впливом інсулінотерапії. Використовували препарати людського інсуліну короткої та тривалої дії, а також інсулінові аналоги (короткотривалої дії та пролонговані). Препарати використовували за схемою базис-болюсної інсулінотерапії шляхом введення перед сніданком інсулінів короткої та пролонгованої дії, перед обідом та вечерею — короткої дії та інсулін тривалої дії — о 21 годині. Початкову добову дозу інсуліну розраховували від 0,5 ОД на 1 кг маси тіла. Перше введення інсуліну здійснювали у дозі 16 ОД о 21 годині та поступово титрували дозу із кроком 2 ОД для досягнення показника глікемії натще 6 ммоль/л. Ми не спостерігали проявів гіпоглікемії вночі у жодному випадку. Водночас здійснювалося титрування денних доз інсуліну, щоб досягти показника глікемії до 10 ммоль/л. Усі хворі отримували необхідний комплекс лікування відповідно до протоколів Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, рекомендацій Міжнародної групи з дослідження проблеми діабетичної стопи [6–8]. Здійснювали необхідні хірургічні втручання залежно від поширеності процесу на стопі (табл. 2). У випадках гнійних процесів призначали антибіотики. Як патогенетичні препарати використовували похідні тіоктової кислоти, нейротропні вітамінні препарати, засоби дезагрегантного впливу. Статистичну обробку результатів дослідження здійснювали методами параметричної статистики, використовуючи пакети прикладних програм для персонального комп’ютера. Вірогідність розбіжностей показників дослідження оцінювали за допомогою показника t за Стьюдентом.
Результати дослідження та їх обговорення
Нами опрацьовані результати лікування у хірургічному стаціонарі 363 осіб, серед яких чисельно переважали жінки (55 % від усього контингенту) більш старшого віку. У середньому вік чоловіків становив 65,00 ± 0,20 року, у жінок — 70,00 ± 0,22 року (р < 0, 001). Характер хірургічної патології та необхідні оперативні втручання мали деякі гендерні та вікові відмінності. Найпоширенішою операцією був розріз абсцесів та флегмон, такі операції проведено у 60 % жінок та 40 % чоловіків. Ампутацій кінцівок у чоловіків було здійснено вдвічі більше, ніж у жінок. Цей вид хірургічних втручань становив 20 % від усіх втручань у жінок та 40 % — у чоловіків. Прослідковується також вікова залежність виду хірургічних втручань. Ампутації фаланг та ампутації кінцівок були здійснені у чоловіків віком понад 66 років та понад 70 років — у жінок. Останнє може свідчити про можливе зростання з віком ішемічних ушкоджень у пацієнтів з нейроішемічною формою СДС.
Тривалість лікування хворих у стаціонарі залежно від стану компенсації ЦД наведена у табл. 2.
Як видно із табл. 2, усі пацієнти при надходженні до стаціонару перебували у стані декомпенсації вуглеводного обміну. Стан компенсації ЦД став визначальним чинником щодо тривалості їх перебування у стаціонарі. Незважаючи на лікування ЦД з використанням препаратів інсуліну, первинна тривала декомпенсація захворювання може бути причиною сповільнення репаративних процесів у пацієнтів та збільшення тривалості їх лікування у стаціонарі.
За показниками прандіальної глікемії компенсації ЦД вдається досягти у 22 % чоловіків та 32 % жінок. При цьому тривалість їх перебування у стаціонарі була найменшою. На нашу думку, досягнення компенсації у цієї групи пацієнтів було поштовхом до посилення у них активності репаративних процесів, що вплинуло на зменшення тривалості перебування у стаціонарі. Пацієнти з високою прандіальною глікемією були здебільшого похилого віку (чоловіки — понад 72 роки, жінки — понад 73 роки). Зменшення у них глікемії до 10 ммоль/л викликало відчуття гіпоглікемії: непокоїв голод, зростала частота серцевих скорочень, частина хворих скаржилась на погіршення зору. Тому прандіальну глікемію у межах 11–13 ммоль/л можна вважати задовільною для вказаної категорії пацієнтів. З цим може бути пов’язана більша тривалість їх стаціонарного лікування. Підходи до компенсації ЦД були однаковими для всіх пацієнтів. Перепонами до збільшення дози інсуліну заради компенсації ЦД у стаціонарі були також супротив хворих та членів їх родин щодо лікування препаратами інсуліну, тривала попередня декомпенсація ЦД. У 72 % цих пацієнтів діагноз ЦД встановлений за появи гнійно-некротичних змін на стопах.
За результатами проведеного аналізу потрібно також зауважити, що незадовільна компенсація ЦД 2-го типу може бути обумовленою пізнім призначенням лікування інсуліном. У проведеному дослідженні препарати інсуліну хворі почали отримувати вперше у хірургічному стаціонарі. Необхідність досягнення компенсації вуглеводного обміну для хворих на ЦД 2-го типу обґрунтована тривалими багатоцентровими дослідженнями, (UKPDS, ADVANCE, VADT та ін.) [17]. Гіперглікемія виступає ключовим чинником ушкодження тканин у хворих на ЦД. Тривала гіперглікемія спричинює накопичення кінцевих продуктів глікування та активування оксидантного стресу. При цьому виснажується антиоксидантний пул організму та активується утворення прозапальних цитокінів, відбувається генералізація запального процесу. Задовільна компенсація ЦД попереджає розвиток та прогресування мікросудинних ускладнень та нейропатії [1, 12, 18]. Лікування інсуліном розглядається не лише як засіб унормування вмісту глюкози крові, а також як метод зменшення активності вільнорадикальних реакцій. Причиною розвитку СДС у переважній кількості випадків вважається периферична сенсорна нейропатія, що виявляється у 42–56 % амбулаторних хворих на ЦД 2-го типу [16]. Сенсорна нейропатія, крім втрати чутливості, збільшує уразливість шкіри внаслідок автономної нейропатії через зменшення виділення поту та шкірного жиру [15]. Своєчасно розпочате лікування інсуліном дозволяє зменшити можливість виникнення діабетичних виразок [19]. Усвідомлення необхідності компенсації ЦД як засобу профілактики виразкових уражень значною мірою необхідне для пацієнтів. Виконані опитування пацієнтів після ампутацій кінцівок виявляють у них ігноративне ставлення до компенсації ЦД [13].
Висновки
1. Тривалість лікування хворих на нейроішемічну форму СДС у хірургічному стаціонарі обумовлюється станом компенсації ЦД на час їх надходження на лікування. За показника глікованого гемоглобіну 12,6 ± 1,2 % тривалість перебування у стаціонарі становить 16,60 ± 0,26 дня у чоловіків та 18,95 ± 0,51 дня — в жінок. У пацієнтів із показником глікованого гемоглобіну 15,5 ± 1,0 % тривалість перебування у стаціонарі збільшується до 34,66 ± 0,40 дня в чоловіків та до 31,42 ± 1,18 — у жінок.
2. За однакових показників глікованого гемоглобіну тривалість стаціонарного лікування жінок є більшою, ніж чоловіків (р < 0,001).
3. Досягнення компенсації ЦД з показниками глюкози капілярної крові до 6 ммоль/л (натще) та до 10 ммоль/л (прандіальної) є найбільш сприятливим щодо посилення репаративних процесів у пацієнтів та скорочення терміну їх лікування у хірургічному стаціонарі.
4. Серед осіб, у яких не була досягнута компенсація під час стаціонарного лікування, чоловіків втричі більше, ніж жінок. Це є підставою для посилення вмотивування чоловіків стосовно адекватного лікування та самоконтролю діабету.
1. Азизова О.А. Роль окисленных липопротеинов в патогенезе атеросклероза // Эфферентная терапия. — 2000. — № 1. — С. 24–31.
2. Довідник основних показників діяльності ендокринологічної служби України за 2012 рік. — К., 2013. — 36 с.
3. Довідник основних показників діяльності ендокринологічної служби України за 2013 рік / Чернобровий А.Д., Тронько М.Д. — К., 2014. — 40 с.
4. Ларін О.С., Паньків В.І., Селіваненко М.І. Аналіз діяльності ендокринологічної служби України у 2010 році та перспективи розвитку медичної допомоги хворим з ендокринною патологією // Міжнародний ендокринологічний журнал. — 2011. — № 3. — С. 10–18.
5. МОЗ України. Наказ № 1118 від 21.12.2012. Уніфікований клінічний протокол первинної та вторинної (спеціалізованої) медичної допомоги «Цукровий діабет 2-го типу», розроблений на основі адаптованої клінічної настанови «Цукровий діабет 2-го типу», як джерело доказової інформації про найкращу медичну практику.
6. Протокол надання медичної допомоги хворим з синдромом діабетичної стопи. Наказ Міністерства охорони здоров’я України від 22.05.2009 № 356 в редакції наказу МОЗ України від 05.08.2009 № 574.
7. Протоколи надання медичної допомоги хворим із патологією ендокринної системи. Затверджено вченою радою Українського науково–практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України від 05.09.2011. — К., 2011.
8. Bakker K., Schaper N.C. International Working Group on Diabetic Foot. Editorial Board. The development of global consensus guidelines on the management and prevention of the diabetic foot 2011 // Diabetes. Metab. Res. — 2012. — Vol. 116. — P. 8. doi: 10.1002/dmrr.2254. [Інтернет–ресурс].
9. Bastyr E.J., Price K.L., Bril V.; MBBQ Study Group. Development and validity testing of the neuropathy total symptom score–6: questionnaire for the study of sensory symptoms of diabetic peripheral neuropathy // Clin. Ther. — 2005. — Vol. 27, № 8. — P. 1278–1294.
10. Chawla A., Bhasin G., Chawla R. Validation Of Neuropathy Symptoms Score (NSS) And Neuropathy Disability Score (NDS) In The Clinical Diagnosis Of Peripheral Neuropathy In Middle Aged People With Diabetes. Internet scientific publications [Інтернет-ресурс]. http: // ispub.com/IJFP/12/1/1517
11. Chadwick P., Jeffcoate W., McIntosh C. How can we improve the care of the diabetic foot? // Wounds UK. — 2008. — V. 4, № 4. — Р. 144–148.
12. Gabbay I.E., Gabbay M., Gabbay U. Diabetic foot cellular hypoxia may be due to capillary shunting — A novel. hypothesis // Med. Hypotheses. — 2014. — V. 82. — P. 57–59.
13. Joe Feinglass, Vera P. Shively, Gary J. et al. How ‘preventable’ are lower extremity amputations? A qualitative study of patient perceptions of precipitating factors // Disability and Rehabilitation. — 2012. — Vol. 34, № 25. — P. 2158–2165 [Інтернет-ресурс] (doi:10.3109/09638288.2012.677936).
14. Kim P.J., Steinberg J.S. Complications of the diabetic foot // Endocrinol. Metab. Clin. North. Am. — 2013. — Vol. 42. — P. 833–847. [Інтернет-ресурс]. 10.1016/j.ecl.2013.08.002.
15. Kostev K., Dippel F.W., Rockel T., Siegmund T. Risk of diabetic foot ulceration during treatment with insulin glargine and NPH insulin // J. Wound Care. — 2012. — Vol. 21, № 10. — P. 483–489.
16. Lazo M., Bernabe-Ortiz A., Pinto M.E., Sacksteder, Gilman R.H. Diabetic peripheral neuropathy in ambulatory patients with type 2 diabetes in a general hospital in a middle income country: a cross-sectional study // 7PLoS One. — 2014 May 1. — 9(5). — e95403. doi: 10.1371/journal.pone.0095403. e. — Collection 2014. [Інтернет-ресурс].
17. Terry T., Raravikar K., Chokrungvaranon N., Reaven P.D. Does aggressive glycemic control benefit macrovascular and microvascular disease in type 2 diabetes? Insights from ACCORD, ADVANCE, and VADT // Curr. Cardiol. Rep. — 2012. — Vol. 14, № 1. — P. 79–88.
18. Vlassara H., Striker G.E. Advanced glycation products in diabetes and diabetic complications // Endocrinol. Metab. Clin. N. Am. — 2013. — Vol. 42. — P. 697–719.10.1016/j.ecl.2013.07.005 [Інтернет-ресурс].
19. Vuorisalo S., Venermo M., Lepantalo M. Treatment of diabetic foot ulcers // J. Cardiovasc. Surg (Torino). — 2009. — Vol. 50, № 3. — P. 275-291.
20. Wu S.C., Driver V.R., Wrobel J.S., Armstrong D.G. Foot ulcers in the diabetic patient, Prevention and Treatment // Vasc. Health risk manag. — 2007. — Vol. 3. — P. 65–76.

/38/38.jpg)