Международный эндокринологический журнал 6 (62) 2014
Вернуться к номеру
Ефективність застосування ліраглутиду у хворих на цукровий діабет 2-го типу з ожирінням в реальній клінічній практиці (огляд літератури й дані власних спостережень)
Авторы: Паньків В.І. - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Огляд присвячений найважливішим проблемам сьогоденної ендокринології — цукровому діабету та ожирінню. Приділяється увага новому класу антигіперглікемізуючих засобів — інкретинам, зокрема ліраглутиду. Швидке, стабільне і значне зниження маси тіла при лікуванні пацієнтів із цукровим діабетом 2-го типу, які страждають від ожиріння, а також результати клінічного дослідження II фази, у якому взяли участь добровольці з ожирінням, дозволяють не тільки розглядати ліраглутид як препарат, використовуваний для лікування діабету, а й позиціонувати його для медикаментозної терапії ожиріння.
Обзор посвящен наиболее важным проблемам сегодняшней эндокринологии — сахарному диабету и ожирению. Уделяется внимание новому классу антигипергликемизирующих средств — инкретинам, в частности лираглутиду. Быстрое, стабильное и значительное снижение массы тела при лечении пациентов с сахарным диабетом 2-го типа, которые страдают от ожирения, а также результаты клинического исследования II фазы, в котором приняли участие добровольцы с ожирением, позволяют не только рассматривать лираглутид как препарат, используемый для лечения диабета, но и позицио-
нировать его для медикаментозной терапии ожирения.
This review deals with the most important issues of current endocrinology — diabetes mellitus and obesity. Attention is given to a new class of antihyperglycemic agents — incretins, particularly liraglutide. Fast, stable, and a significant reduction of body weight in the treatment of patients with diabetes mellitus type 2, who suffer from obesity, as well as the findings of phase II clinical trial, which enrolled volunteers with obesity, enable not only to consider liraglutide as a drug used for diabetes treatment, but also to set it for drug therapy of obesity.
цукровий діабет, ожиріння, лікування, ліраглутид.
сахарный диабет, ожирение, лечение, лираглутид.
diabetes mellitus, obesity, treatment, liraglutide.
Статья опубликована на с. 91-101
Цукровий діабет (ЦД) призводить до значного зростання смертності та погіршення якості життя хворих насамперед унаслідок розвитку в них серцево-судинних ускладнень [9]. Захворюваність на ЦД має характер пандемії, охоплюючи більшість економічно розвинених країн [27]. Сучасне розуміння проблеми аргументує необхідність вивчення ЦД 2-го типу, ожиріння й серцево-судинної патології в контексті конкретних популяцій із чинниками ризику [3]. Очевидно, що посилення інсулінорезистентності на тлі будь-якого підходу до лікування ЦД 2-го типу є небажаним чинником. Тому вивчення змін чутливості до інсуліну, динаміки метаболічних показників і впливу поліпшення глікемічного контролю на ці параметри на тлі терапії є актуальним завданням.
Підбір адекватної цукрознижувальної терапії й досягнення бажаного ступеня компенсації захворювання у хворих на ЦД 2-го типу становить певні складнощі. Це обумовлено значною гетерогенністю ЦД 2-го типу, що утруднює пошук патогенетичного лікування в кожному конкретному випадку [7, 28, 35]. На сьогодні є низка препаратів для корекції гіперглікемії при ЦД 2-го типу, що мають різні механізми дії. Загалом вони спрямовані на усунення трьох основних метаболічних порушень, що призводять до гіперглікемії: порушення секреції інсуліну підшлунковою залозою, периферичної інсулінорезистентності, надмірної продукції глюкози печінкою [12, 25].
На сучасному етапі розвитку діабетології основною метою лікування ЦД є досягнення максимально наближених до фізіологічних рівнів глюкози крові без підвищення ризику розвитку гіпоглікемії й без шкоди для якості життя хворих [10, 34].
Забезпечення контролю цільового рівня глюкози в крові за допомогою дотримання здорового способу життя досягається на декілька місяців лише в дуже незначної кількості людей із ЦД 2-го типу. Медикаментозні методи лікування на додаток до немедикаментозних допомагають досягти цільового рівня глюкози в крові. Фактично ЦД 2-го типу без призначення медикаментозної терапії для контролю глікемії не лікується [1].
У зв’язку зі збільшенням на ринку кількості фармакологічних препаратів підходи до контролю рівня глікемії в пацієнтів із ЦД 2-го типу стають все складнішими й до певної міри суперечливішими, особливо якщо брати до уваги можливі небажані явища, спричинені лікарськими препаратами, а також не зовсім доведений ефективний вплив жорстких заходів щодо контролю рівня глікемії з метою профілактики макроангіопатії й пов’язаних із нею ускладнень [8, 36]. Вищезгадані факти ускладнюють вибір оптимальної стратегії лікування лікарем-клініцистом.
Наявні на сьогодні клінічні настанови слід застосовувати індивідуально для кожного пацієнта залежно від його потреб, переваг і переносимості, що є запорукою успіху в лікуванні. Індивідуальний підхід до лікування пацієнта передбачає застосування тієї або іншої терапії залежно від переваг і потреб окремо взятого пацієнта, а також очікуваної користі, що виправдає вибрану тактику лікування. Індивідуальне визначення тактики лікування для конкретного пацієнта є одним із ключових принципів доказової медицини.
Прогресуюче збільшення частоти надмірної маси тіла у всьому світі призвело до того, що ожиріння розглядається як одна з найсерйозніших проблем охорони здоров’я XXI століття. ЦД 2-го типу насамперед характеризується підвищеним умістом у периферичній крові глюкози й вільних жирних кислот (ВЖК), що асоціюється з появою низки таких порушень, як центральне ожиріння, дисліпідемія, збільшення в плазмі кількості маркерів запалення, гіперкоагуляція з пригніченою фібринолітичною активністю, судинні ушкодження та артеріальна гіпертензія (АГ) [6]. Сукупність цих патологічних проявів, що отримала назву метаболічного синдрому (МС), пов’язана з високим ризиком розвитку кардіо- та цереброваскулярних захворювань [24].
За своєю природою ЦД 2-го типу належить до мультифакторних патологій, у генезі яких важливу роль відіграють генетична схильність та чинники довкілля, що індукують порушення функції β-клітин і втрату чутливості тканин до інсуліну [17]. Проте причини виникнення цих дефектів і те, як вони пов’язані між собою у процесі розвитку ЦД, досі остаточно не з’ясовані. З іншого боку, значну проблему становить наявний зв’язок між гіперглікемією та іншими метаболічними проявами хвороби. Доведено, що різні підходи, спрямовані на зниження рівня глюкози в крові (корекція інсулінової недостатності, зменшення утворення глюкози в печінці, пригнічення абсорбції глюкози в кишечнику), не сприяють повному відновленню метаболічного гомеостазу та гальмуванню прогресування ЦД і його ускладнень [4]. Відомо, що застосування інсулін-сенсибілізуючих пероральних цукрознижуючих препаратів посилює чутливість тканин до інсуліну та позитивно впливає не лише на метаболізм глюкози, а й на низку інших порушень, притаманних ЦД 2-го типу [15]. Отже, інсулінорезистентність слід розглядати як одну з найголовніших причин формування МС, тому пошук етіологічних чинників та розкриття механізмів розвитку цього стану є одним із найактуальніших завдань сучасної діабетології.
На сьогодні найбільше уваги приділяється зв’язку між ЦД та ожирінням, адже майже 80 % хворих на ЦД 2-го типу страждають від ожиріння.
Інкретинові гормони — глюкагоноподібний пептид-1 (ГПП-1) і глюкозозалежний інсулінотропний поліпептид (ГІП) — виробляються в шлунково-кишковому тракті у відповідь на прийом їжі з метою регулювання рівня глюкози в крові. Цей ефект отримав назву інкретинового ефекту [26]. Рецептори до ГПП-1 досить широко представлені в різних органах: α- і β-клітинах підшлункової залози, різних відділах шлунково-кишкового тракту, центральній та периферичній нервовій системі, серцевому м’язі, нирках, печінці. Тому додатково до глюкозозалежної стимуляції секреції інсуліну активація рецепторів до ГПП-1 сприяє зниженню секреції глюкагону, уповільненню випорожнення шлунка, зниженню апетиту/підвищенню почуття ситості, а також позитивно впливає на серцево-судинну та центральну нервову систему [20].
У хворих на ЦД 2-го типу інкретиновий ефект значно знижений, що пов’язано як зі зменшенням секреції ГПП-1, так і з дефектом відповіді на ГІП і ГПП-1. Проте екзогенне введення супрафізіологічних концентрацій ГПП-1 (але не ГІП) може відновити інкретиновий ефект у пацієнтів із ЦД 2-го типу. Тому препарати, засновані на ГПП-1, мають великий терапевтичний потенціал [2, 30].
Найбільшим досягненням останніх років у розробці нових антигіперглікемізуючих засобів стала поява нового класу препаратів — інкретинів, агоністів рецепторів ГПП-1, резистентних до дії дипептидилпептидази-4 (ДПП-4), а також інгібіторів ДПП-4, що підвищують ендогенний рівень ГПП-1 [31].
Ліраглутид — синтетичний аналог нативного ГПП-1людини, що на 97 % гомологічний йому за амінокислотною послідовністю і справляє ідентичний глікемічний та інсулінотропний ефект. Час напіввиведення препарату становить від 8 до 13 годин порівняно з двома хвилинами у нативного ГПП-1, що дозволяє вводити ліраглутид 1 раз на добу незалежно від прийому їжі в будь-який фіксований час, вибраний самим пацієнтом. Унікальна будова ліраглутиду зумовлює подвійний шлях виведення — печінкою і нирками, завдяки чому його можна використовувати навіть у пацієнтів із неалкогольною жировою хворобою печінки й початковими стадіями хронічної хвороби нирок [11].
На сьогодні у світі зареєстровано понад 40 рандомізованих клінічних досліджень (понад 20 із них уже завершені) з оцінкою ефективності ліраглутиду у вигляді моно- і комбінованої цукрознижувальної терапії. Детальний опис результатів досліджень та їх вичерпні метааналізи наведені в численних публікаціях [13, 14, 22, 23, 29, 33, 38].
Наявна потужна доказова база дозволяє розглядати ліраглутид як контрольний препарат при вивченні тривалодіючих інкретинових препаратів. Відомі результати програми шести клінічних досліджень III фази «Ефекти і дія ліраглутиду при діабеті» (Liraglutide Effect and Action in Diabetes — LEAD), у яких порівнювали ліраглутид із плацебо, пероральними цукрознижуючими препаратами (ПЦЗП), інсуліном (LEAD-1 — LEAD-5) та екзенатидом (LEAD-6). Програма LEAD оцінює ефективність ліраглутиду практично на всіх етапах терапії ЦД 2-го типу — від стартового призначення цукрознижуючої терапії до використання при неефективності комбінованої пероральної цукрознижуючої терапії [13].
У дослідженнях LEAD-1 — LEAD–6 взяли участь 6800 пацієнтів із 51 країни (терапію ліраглутидом отримували 4445 осіб). Спочатку запланована тривалість досліджень за програмою LEAD становила 26–52 тижні, згодом було прийнято рішення про пролонгацію досліджень LEAD-3 і LEAD-6. Як первинна кінцева точка розглядався рівень HbA1c, а як вторинні — частка пацієнтів, які досягнули цільових значень HbA1c (< 7,0 % і < 6,5 %), рівні глікемії натще (ГН), постпрандіальної глікемії (ППГ). Оцінювали 7-точковий профіль самоконтролю глікемії, масу тіла, ліпідний профіль, функцію бета-клітин, рівень глюкагону, систолічний артеріальний тиск (САТ). Також оцінювали такі основні параметри безпеки, як переносимість, частота розвитку легких і тяжких гіпоглікемій, рівень кальцитоніну в крові. Особливий інтерес становить оцінка комбінованих критеріїв ефективності.
Загальновизнано, що при призначенні стартової терапії ЦД 2-го типу найкращим є вибір препаратів, які не виснажують функцію бета-клітин, сприяють зниженню маси тіла з максимально фізіологічною дією. Враховуючи зазначені аспекти, ліраглутид досліджували як у вигляді монотерапії, так і в комбінації з метформіном — препаратом вибору в медикаментозному управлінні ЦД 2-го типу.
Монотерапія ліраглутидом (1,8 і 1,2 мг/добу) упродовж 52 тижнів (дослідження LEAD-3) призводила до більш значущого зниження HbA1c (–0,84 і –1,14 % відповідно) порівняно з монотерапією глімепіридом (–0,51 %). На тлі прийому ліраглутиду рівень HbA1c вірогідно знижувався вже впродовж перших 8–12 тижнів терапії, при цьому більш значуще — в осіб, які дотримувалися до призначення ліраглутиду монодієтотерапії. При терапії ліраглутидом в дозах 1,2; 1,8 мг/добу і глімепіридом цільвого рівня показника HbA1c < 6,5 % досягнуло 28, 38 і 16 % пацієнтів відповідно, а рівня HbA1c < 7 % — 43, 51 і 28 % відповідно. Зниження ГН до стабільно низьких значень було досягнуто вже через 2 тижні при введенні ліраглутиду і через 4 тижні — при прийомі глімепіриду. До 52-го тижня дослідження при введенні ліраглутиду 1,2; 1,8 мг/добу і глімепіриду ГН становила 8,65; 8,25 і 9,27 ммоль/л відповідно. ГН у межах 5,0–7,2 ммоль/л зафіксована у 37,0 і 41,4 % пацієнтів, які отримували ліраглутид 1,2; 1,8 мг/добу відповідно, у 22,2 % хворих, які приймали глімепірид (p < 0,0001). У всіх підгрупах відзначалося зниження ППГ. Індекс інсулінорезистентності (HOMA-IR) і рівень глюкагону натще значуще знижувалися при введенні ліраглутиду (прийом глімепіриду призводив до підвищення цих показників). Середній АТ не змінювався у всіх трьох підгрупах, однак зниження САТ було більш вираженим у випадку терапії ліраглутидом і мало дозозалежний характер. У групі ліраглутиду було встановлено зниження маси тіла і, навпаки, її збільшення — у групі глімепіриду. Зниження маси тіла на тлі терапії ліраглутидом, зареєстроване до 16-го тижня, зберігалося до завершення дослідження [24]. Спостереження за пацієнтами, які отримували монотерапію ліраглутидом, упродовж подальшого року після завершення LEAD-3 свідчило про довготермінове і стабільне зниження HbA1c, ГН і маси тіла [22, 23]. Можна припустити, що продовження термінів дослідження LEAD-3 на 4 роки дозволить підтвердити безпеку ліраглутиду і виявити групи пацієнтів, які найкраще відповідають на терапію.
Лікування традиційними ПЦЗП (препаратами сульфонілсечовини і піоглітазоном) вважається досить ефективним, однак пов’язане з підвищеним ризиком розвитку гіпоглікемічних станів і збільшенням маси тіла. Установлено, що додавання ліраглутиду до ПЦЗП супроводжується швидким (упродовж перших восьми тижнів) зниженням HbA1c, ГН, ППГ, а також маси тіла, що сприяє оптимізації лікування в огрядних пацієнтів із ЦД 2-го типу [37].
У дослідженні LEAD-2 оцінювалася ефективність комбінованої терапії ліраглутидом і метформіном. Установлено, що призначення ліраглутиду пацієнтам, які вже отримували метформін, порівняно з глімепіридом сприяє поряд з поліпшенням глікемічних параметрів (HbA1c, ГН, ППГ) також і значному зниженню маси тіла [32].
В іншому 16-тижневому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні комбінації ліраглутиду брали участь 929 етнічних пацієнтів азіатської популяції, які проживають на території Китаю, Південної Кореї та Індії, з незначним надлишком маси тіла (індекс маси тіла (ІМТ) 25–26 кг/м2), які отримували до включення в дослідження 1 або 2 цукрознижувальних препарати (за винятком метформіну). До кінця дослідження терапія глімепіридом і ліраглутидом сприяла поліпшенню глікемічного контролю (зниження HbA1c (на 1,2–1,7 %), ГН, ППГ). Однак саме прийом ліраглутиду асоціювався зі зниженням маси тіла, САТ і 10-разовим зменшенням ризику розвитку гіпоглікемії [37].
Результати дослідження LEAD-4, метою якого була оцінка ефективності терапії ліраглутидом додатково до прийому комбінації розиглітазону з метформіном, переконливо підтвердили можливість поліпшення глікемічного контролю при додаванні ліраглутиду. Так, рівень HbA1c істотно знизився до 12-го тижня дослідження (незалежно від дози препарату) і залишався стабільним до його завершення. При цьому вже до 8-го тижня дослідження відзначалося значуще зниження маси тіла. При застосуванні ліраглутиду в дозі 1,8 мг/добу зниження маси тіла пацієнтів було істотнішим [38].
У відкритому клінічному дослідженні LEAD-5 тривалістю 26 тижнів була проведена порівняльна оцінка стартової інсулінотерапії (за допомогою базального інсуліну гларгін) і ліраглутиду в пацієнтів із ЦД 2-го типу, які не досягнули контролю на тлі комбінованої пероральної цукрознижувальної терапії метформіном (1 г/добу) і глімепіридом (4 мг/добу). Кращий глікемічний контроль був досягнутий у групі пацієнтів, які отримували ліраглутид, а не інсулінотерапію (зниження HbA1c на 1,33 і 1,1 % відповідно). При цьому значущих відмінностей у рівнях ГН і ППГ і ризику розвитку гіпоглікемій при лікуванні ліраглутидом та інсуліном гларгін зафіксовано не було [33].
Додатково до позитивного впливу на глікемічний контроль терапія ліраглутидом викликала значне зниження маси тіла (–1,8 кг) порівняно з інсуліном гларгін, застосування якого, навпаки, супроводжувалося збільшенням маси тіла на 1,6 кг.
Отже, у разі неефективності пероральної цукрознижувальної терапії ліраглутид може слугувати альтернативою стартовому призначенню інсуліну продовженої дії.
Дослідження LEAD-6, що завершує програму LEAD, було проведене для порівняльної оцінки ефективності глікемічного контролю при призначенні ліраглутиду та інкретиноміметика екзенатиду пацієнтам із ЦД 2-го типу. Ці пацієнти вже отримували максимально переносимі дози метформіну і/або препаратів сульфонілсечовини, але без досягнення належного глікемічного контролю [14].
Упродовж перших 26 тижнів дослідження позитивний вплив інкретинів сприяв прогресивному поліпшенню глікемічного контролю. Зниження рівня HbA1c становило 1,16 % у пацієнтів, які отримували ліраглутид, і 0,87 % — при введенні екзенатиду (p < 0,001). Інкретини сприяли також досягненню цільових значень HbA1c (у 54 % випадків при призначенні ліраглутиду і 43 % — екзенатиду; p < 0,05). У цій частині дослідження було виявлено однакове зниження маси тіла на тлі терапії ліраглутидом та екзенатидом (на 3,2 і 2,9 кг відповідно; p = 0,2235). Згодом дослідження LEAD-6 було продовжено до 52 тижнів, дизайн передбачав дві гілки — продовження терапії ліраглутидом (200 пацієнтів), а також його призначення 186 пацієнтам, які до цього отримували екзенатид. Контрольні групи (продовження терапії екзенатидом і переведення з ліраглутиду на екзенатид) у розширеній фазі дослідження LEAD-6 не були передбачені. Установлено, що призначення ліраглутиду впродовж 26 тижнів пацієнтам, які до цього отримували терапію екзенатидом, сприяло подальшому поліпшенню глікемічного контролю (зменшення HbA1c на 0,32 %, ППГ — на 0,9 ммоль/л), а також супроводжувалося додатковим зниженням маси тіла (на 0,9 кг) і САТ (на 3,8 мм рт.ст.).
Дані коваріаційного аналізу підтвердили, що зміни показників HbA1c не залежали від супутньої терапії, ІМТ, місця проживання, статі, етнічного походження і віку пацієнта. Динаміка зниження рівня HbA1c характеризувалася дозозалежним ефектом при використанні обох інкретинів, а найбільше зниження (–2,4 і –1,2 % в разі застосування ліраглутиду й екзенатиду відповідно) відзначалося у пацієнтів з початковим рівнем HbA1c понад 10 %.
Дослідження LEAD-6 дозволило виявити й деякі особливості дії досліджуваних інкретинів. Так, ліраглутид більш виражено впливав на зниження ГН (–1,61 порівняно з –0,60 ммоль/л при введенні екзенатиду; p < 0,0001). У свою чергу, екзенатид більшою мірою впливав на ППГ після сніданку і вечері, синхронізованої з ін’єкцією екзенатиду (сніданок — 1,33 ммоль/л; p < 0,0001; вечеря — 1,01 ммоль/л; p = 0,0005), тоді як рівні ППГ у післяобідній час були однаковими в обох групах. Динаміка рівня інсуліну становила 12,43 пмоль/л у разі призначення ліраглутиду і –1,38 пмоль/л — при введенні екзенатиду (p = 0,0355); індекс HOMA змінився на 32,12 і 2,74 % відповідно (p < 0,0001) [14].
Тенденція змін показників ліпідного спектра на тлі терапії різними агоністами ГПП-1 не відрізнялася. Однак ліраглутид більшою мірою сприяв зниженню гіпертригліцеридемії і рівня ВЖК, а також призводив до менш вираженого підвищення рівня холестерину ліпопротеїдів дуже низької щільності (ЛПДНЩ). Призначення ліраглутиду характеризувалося більшими комплайєнтністю пацієнтів завдяки зручності одноразового введення препарату і задоволенням лікуванням за опитувальником DTSQs.
Безпосередня оцінка функції острівцевих клітин можлива тільки в дослідженнях in vitro і в експериментальних моделях ЦД 2–го типу in vivo. Основні характеристики функціональної активності бета-клітин оцінюються в клінічних дослідженнях за допомогою гомеостатичної моделі HOMA-B, співвідношення проінсулін/інсулін (П/І), першої і другої фаз секреції інсуліну в процесі внутрішньовенного глюкозотолерантного тесту.
T. Vilsboll і співавт. [36] продемонстрували поліпшення першої фази секреції бета-клітин при введенні ліраглутиду пацієнтам із ЦД 2-го типу впродовж 14 тижнів в дозі 1,25 і 1,9 мг/добу на 118 і 103 % відповідно, а також аргінін-стимульованої секреції інсуліну — на 114 і 94 % відповідно. Згідно з даними метааналізу досліджень програми LEAD, виконаних групою D.B. Matthews, ліраглутид сприяє поліпшенню як індексу HOMA-B (на 40–71 %), так і співвідношення П/І, що може свідчити про здатність ліраглутиду відновлювати функціональну активність бета-клітин підшлункової залози.
Вираженіший позитивний вплив на функціональну активність бета-клітин спостерігається в пацієнтів із початково більш збереженою функцією бета-клітин.
Так, відзначається значуще поліпшення індексу НОМА-В при введенні ліраглутиду порівняно з плацебо і розиглітазоном (LEAD-1), що можна порівняти з прийомом глімепіриду (LEAD-2). Зміна HOMA-B була більш вираженою в разі застосування ліраглутиду порівняно з екзенатидом.
Зміна показників HOMA-B при прийомі глімепіриду нівелювалася нижчим співвідношенням П/І при постійній секреції інсуліну на відміну від глюкозозалежної на тлі введення ліраглутиду [37].
При порівнянні терапії ліраглутидом та екзенатидом виявлено вірогідне підвищення рівня інсуліну натще (12,43 і –1,38 пмоль/л; p < 0,0355) і HOMA-–B (32,12 і 2,74 %; р < 0,0001) в групі ліраглутиду. Зареєстровано практично однакове зниження рівня глюкагону натще, більш виражене в групі ліраглутиду (–19,44 і –12,33 нг/л відповідно; р = 0,1436) [16].
У дослідженнях in vitro додавання ліраглутиду до культури бета-клітин підшлункової залози людини супроводжувалося зниженням швидкості клітинного апоптозу і збільшенням глюкозозалежного вивільнення інсуліну і відсотка відновлених бета-клітин. В експерименті підтверджений цитопротективний і протизапальний ефект ліраглутиду при використанні його до і після трансплантації бета-клітин. Враховуючи отримані результати, запропоновано внести ліраглутид до клінічного протоколу трансплантації бета-клітин у людини.
Зниження маси тіла асоціюється зі зменшенням кількості жирової тканини (підшкірне й вісцеральне депо). У всіх дослідженнях LEAD зареєстровано зниження маси тіла на тлі застосування ліраглутиду (за винятком застосування ліраглутиду в дозі 1,2 мг/добу в комбінації з препаратами сульфонілсечовини в дослідженні LEAD-1). Зниження маси тіла відбувалося впродовж перших 16 тижнів терапії ліраглутидом, після чого ІМТ залишався стабільним. Відзначалося також зниження вмісту загального жиру, переважно його абдомінального депо, що супроводжувалося зменшенням окружності талії (ОТ) і відсоткового вмісту вісцерального жиру (дані двохенергетичної рентгенівської абсорбціометрії). Утрата маси тіла була більшою при вищому значенні ІМТ. Коваріаційний аналіз даних LEAD підтвердив, що зниження маси тіла не пов’язане з розвитком гастроінтестинальних небажаних ефектів [18].
Швидке, стабільне і значне зниження маси тіла при лікуванні пацієнтів із ЦД 2-го типу, які страждають від ожиріння, а також результати клінічного дослідження II фази, у якому взяли участь добровольці з ожирінням, дозволяють не лише розглядати ліраглутид як препарат, використовуваний для лікування діабету, а й позиціонувати його для медикаментозної терапії ожиріння.
Зміна харчової поведінки, з одного боку, зумовлена уповільненням евакуації шлункового вмісту, з іншого — включенням ще недостатньо вивчених центральних механізмів дії ліраглутиду. У мишей з індукованим ожирінням та інсулінорезистентністю введення ліраглутиду супроводжується значним скороченням обсягу спожитої їжі, поліпшенням ГН і глікемічного контролю.
Виявлено зниження САТ на 8 мм рт.ст. при введенні 1,8 мг/добу ліраглутиду порівняно з групою плацебо [29]. У дослідженні LEAD-1 зафіксовано більш значуще зниження САТ на тлі введення ліраглутиду в дозах 1,8 і 1,2 мг/добу порівняно з групою розиглітазону (–2,81; –2,56 і –0,93 мм рт.ст. відповідно). Додавання ліраглутиду до комбінації метформіну й розиглітазону (LEAD-4) викликає зниження САТ на 4,7 мм рт.ст. уже через 2 тижні і на 6,7 мм рт.ст. — через 26 тижнів застосування. Метааналіз LEAD, виконаний за допомогою коваріаційного аналізу, продемонстрував, що позитивний ефект ліраглутиду на зниження САТ не залежить від попередньої антигіпертензивної терапії. Механізм зниження САТ на тлі введення ліраглутиду остаточно не з’ясований, проте відомо, що введення нативного ГПП-1 посилює натрійурез [16].
Зареєстровано зниження рівня тригліцеридів на 22 % при введенні 1,8 мг/добу ліраглутиду порівняно з плацебо. У дослідженні LEAD-1 продемонстровано зниження рівня тригліцеридів при комбінованій терапії ліраглутидом (1,2 і 1,8 мг/добу) і глімепіридом, а також збільшення ступеня вираженості гіпертригліцеридемії в групі пацієнтів, які отримували розиглітазон (4 мг/добу). Завершена I фаза клінічного дослідження, проведеного з метою вивчення динаміки постпрандіальної тригліцеридемії впродовж 8-годинного періоду після введення ліраглутиду [37].
ГПП–1 позитивно впливає на стан міокарда і зменшує прояви ендотеліальної дисфункції. У рандомізованому клінічному дослідженні, у якому взяли участь 165 пацієнтів із ЦД 2-го типу (ІМТ 28,9–31,2 кг/м2, HbA1c 8,1–8,5 %), які отримували ліраглутид (0,65; 1,25; 1,9 мг/добу) або плацебо впродовж 24 тижнів, продемонстровано значне зниження рівня інгібітору активатора плазміногену-1 (ІАП-1) і мозкового натрійуретичного пептиду, а також незначне, але дозозалежне зниження рівня високочутливого С-реактивного білка (СРБ). ІАП-1 і СРБ розглядаються як основні біомаркери запалення, що асоціюються з підвищеним ризиком розвитку серцево-судинних подій. Рівень ІАП-1 на тлі введення ліраглутиду знижується, що сприяє пригніченню процесів тромбоутворення й зумовлює менший ризик розвитку атеросклерозу [21].
Ліраглутид дозозалежно збільшує продукцію NO в культурі HUVEC (Human umbilical vein endothelial cells), потенціюючи активність ендотеліальної NO-синтетази, а також справляє супресивний ефект на активацію ядерного фактора NF-kB і NF-kB-залежну експресію різних генів, відповідальних за запальну відповідь, і молекул клітинної адгезії (VCAM-1, E-селектину, ICAM-1 і хемоатрактантного білка моноцитів-1). Ці явища пояснюють вазопротективні і протизапальні властивості ліраглутиду, що спостерігаються у пацієнтів із ЦД 2-го типу [26].
Поліпшення кардіальної функції після гострого інфаркту міокарда й черезшкірної коронарної ангіопластики відзначається на тлі введення агоністів ГПП-1. Однак до цього часу патогенетичний механізм поліпшення наслідків ішемії міокарда залишається неуточненим. В експериментальній моделі введення ліраглутиду значно скорочує зону некрозу порівняно з групою контролю (зона некрозу від обсягу лівого шлуночка становить 20,9 ± 1,7 % порівняно з 28,8 ± 3,3 % у контролі; p = 0,02). Більше того, гіпертрофія міокарда, що визначається співвідношенням маси серця до маси тіла, також була значно нижчою при введенні ліраглутиду. Відзначається поліпшення систолічної функції лівого шлуночка. Вважають, що ліраглутид інгібує каспазний шлях, який призводить до апоптозу кардіоміоцитів [30].
Небажані гастроінтестинальні ефекти (діарея, запори, нудота, блювота) при застосуванні ліраглутиду, що оцінюються за інтенсивністю як «слабкі» і «помірні», трапляються нечасто, мають дозозалежний транзиторний характер і зумовлені інгібуванням швидкості звільнення шлунка [5, 29]. Враховуючи це, при старті терапії ліраглутидом передбачається двотижнева –титрація дози 0,6–1,2–1,8 мг/добу, що запобігає розвитку небажаних гастроінтестинальних явищ.
Титр антитіл до ліраглутиду оцінювався в дослідженнях LEAD-1 і LEAD-4-6. При терапії ліраглутидом, що має максимальний ступінь гомологічності з нативним ГПП-1, утворення антитіл до препарату виявлене лише в 9–13 % і не викликає ефекту вислизання терапевтичної дії.
Гіпоглікемічні стани при введенні ліраглутиду трапляються рідко навіть у пацієнтів, які одночасно отримували похідні сульфонілсечовини. У групі монотерапії ліраглутидом ризик розвитку гіпоглікемії відповідав групі плацебо, а ступінь вираженості гіпоглікемії розцінювався як легкий. У клінічній практиці перед призначенням ліраглутиду пацієнтам, які використовують препарати сульфонілсечовини, рекомендується зменшити до мінімуму дозу секретагогу, оскільки саме він робить основний внесок у розвиток гіпоглікемії [34].
Відомо, що у пацієнтів з ЦД 2-го типу й ожирінням ризик розвитку панкреатиту у 2,2 раза перевищує ризик у загальній популяції. У дослідженнях LEAD-1-6 на тлі терапії ліраглутидом у п’яти спостереженнях діагностований гострий панкреатит, у двох — загострення хронічного, в одному спостереженні це ускладнення зареєстроване на тлі прийому препарату порівняння (2,2 порівняно з 0,6 випадку на 1000 пацієнто-років). У дослідженні LEAD-1 у п’яти пацієнтів, які страждали від хронічного панкреатиту до включення в дослідження, загострення на тлі введення ліраглутиду зафіксовано не було [13].
У літературі розглядаються питання гіперплазії С-клітин і медулярного раку щитоподібної залози на тлі прийому агоністів ГПП–1. В експериментальних моделях ЦД 2-го типу у гризунів, які мають високу експресію ГПП-1 в С-клітинах, ліраглутид сприяв їх гіперплазії й розвитку медулярного раку щитоподібної залози. У людини, як і інших приматів, кількість ГПП-1 на С-клітинах незначна. За даними дворічного моніторингу в програмі LEAD, рівень кальцитоніну не відрізнявся від популяційного [38].
Більшість пацієнтів, які брали участь у програмі LEAD, страждають від ЦД 2-го типу в поєднанні з надмірною масою тіла або ожирінням, а також АГ. У зв’язку з коморбідністю ЦД 2-го типу запроваджені комбіновані кінцеві точки, що враховують разом із глікемічним контролем позитивну динаміку позаглікемічних ефектів. Усунення і профілактика чинників ризику розвитку серцево-судинних ускладнень ЦД 2-го типу, які роблять найбільший внесок у структуру витрат, а також підвищення прихильності до лікування дозволять мінімізувати поточні і довготривалі соціально-економічні витрати.
Комбінований критерій «глікемічний контроль, артеріальний тиск і маса тіла» оцінює число пацієнтів, які досягнули цільового рівня HbA1c < 7,0 %, САТ < 130 мм рт.ст. і не збільшили масу тіла. Пацієнти з ожирінням домінують у структурі ЦД 2-го типу, саме для них актуальний вибір препарату, що покращує глікемічний контроль без збільшення маси тіла й підвищення АТ. При використанні ліраглутиду в дозі 1,8 мг/добу кожний четвертий пацієнт досягнув цільових значень. Ліраглутид у дозі 1,2 мг/добу продемонстрував дещо менший відсоток таких пацієнтів, однак обидва дозування ліраглутиду значно перевершували ефективність всіх препаратів порівняння. Установлено, що вірогідність успішного результату при введенні ліраглутиду в 11 разів більша (p < 0,01).
Комбінований критерій «глікемічний контроль, гіпоглікемії і маса тіла» оцінює число пацієнтів, які досягнули цільового рівня HbA1c < 7,0 % без розвитку гіпоглікемій (тобто безпечне досягнення глікемічного контролю, що не призводить до зниження прихильності до терапії) і в них збільшилася маса тіла. Використання обох терапевтичних дозувань ліраглутиду є ефективним, вірогідність успішного результату на порядок перевищує аналогічний показник при застосуванні інших препаратів порівняння (p < 0,01).
Необхідно відзначити, що на сьогодні продовжується низка клінічних досліджень, які оцінюють на основі доказової медицини нові аспекти багатосторонньої дії ліраглутиду.
На базі відділу профілактики ендокринних захворювань Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України нами було проведене дослідження (2011–2013 роки), присвячене комплексному вивченню показників вуглеводного й ліпідного обміну, стану інсулінорезистентності у хворих на ЦД 2-го типу з ожирінням і шляхів їх корекції з використанням агоністів глюкагоноподібного пептиду-1 (ліраглутиду).
У відкрите проспективне рандомізоване дослідження тривалістю шість місяців включені 56 пацієнтів, які відповідали таким критеріям: вік від 39 до 65 років, тривалість ЦД 2-го типу від 3 до 10 років (у середньому 7,82 ± 1,21 року), показник HbA1c не вище ніж 11 %, ІМТ — 31–39 кг/м2 — у поєднанні з будь-якими двома з наведених ознак, а саме: рівень тригліцеридів > 1,7 ммоль/л, вміст холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) < 1,29 ммоль/л, САТ > 130, або ДАТ > 85 мм рт.ст., або здійснювана антигіпертензивна терапія. Критерії виключення: ЦД 1-го типу, гіпотиреоз, наявність в анамнезі коагулопатій, гострого порушення мозкового кровообігу, інфаркту міокарда, тромбоемболії, замісна гормональна терапія, куріння.
56 хворих були розподілені на дві групи — основну й контрольну. У контрольній групі (n = 28) здійснювали заходи з модифікації способу життя (раціональне харчування, фізичні навантаження) на тлі прийому метформіну з поступовою титрацією дози до 2500 мг на добу (по 1250 мг двічі на день після їжі).
В основній групі пацієнтів (n = 28) поряд з аналогічною терапією додатково призначали підшкірні ін’єкції ліраглутиду (препарат Віктоза виробництва компанії «Ново Нордіск») 1 раз на добу незалежно від прийому їжі. Початкова доза препарату становила 0,6 мг/добу. Через тиждень дозу збільшували до 1,2 мг/добу. З 56 осіб, включених у дослідження, повністю курс лікування завершили 48 пацієнтів. Вісім пацієнтів (шість з основної і два — з контрольної групи) передчасно вибули з дослідження, відмовившись від подальшої участі.
У стані декомпенсації вуглеводного обміну перебували 23 (82,1 %) хворі, у стані субкомпенсації — 5 (17,9 %). Рівень САТ становив при первинному обстеженні 138,6 ± 2,7 мм рт.ст., ДАТ — 88,2 ± 1,7 мм рт.ст. Початково рівень глюкози в плазмі крові натще в середньому був 9,1 ммоль/л, HbA1c — 8,72 ± 0,29 %.
Стан функціональної активності бета-клітин оцінювали за індексом НОМА-b. З метою отримання додаткових даних про функціональну активність бета-клітин на тлі терапії проводили визначення вмісту С-пептиду в сироватці крові.
Після шести місяців лікування в обох терапевтичних групах — основній і контрольній спостерігалася статистично вірогідна динаміка антропометричних показників (маса тіла, ІМТ і ОТ). Однак у групі комбінованої терапії, що включала прийом метформіну й ліраглутиду, відзначалася більш виражена динаміка зазначених показників. Так, у групі комбінованої терапії медіана зниження маси тіла становила 9,4 кг (9,2 %), ІМТ — 3,2 кг/м2 (8,7 %), а ОТ — 11 см (8,9 %). У групі монотерапії метформіном відповідні медіани становили 0,5 кг (0,3 %), 0,3 кг/м2 (5,7 %) і 0,9 см (0,6 %). Основна і контрольна групи пацієнтів значно відрізнялися за розподілом обстежених, які досягнули різного ступеня зниження маси тіла. У групі комбінованої терапії клінічно значущого зниження маси тіла — не менше 5 % досягнуло 18 (81,8 %) пацієнтів, тоді як у групі монотерапії метформіном — лише 4 (15,4 %). Отримані нами результати свідчать про вірогідно більшу ефективність комбінованої терапії з призначенням ліраглутиду для зниження маси тіла і маси вісцерального жиру порівняно з монотерапією метформіном. До певної міри це підтверджує дані літератури про вплив метформіну і ліраглутиду на масу і композиційний склад тіла, а також може бути наслідком більшої прихильності пацієнтів, які отримують медикаментозне лікування, до дотримання рекомендацій з харчування і фізичних навантажень [35].
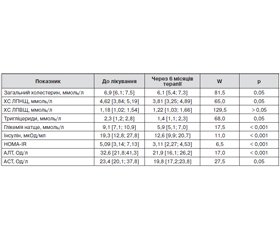
Терапія метформіном з ліраглутидом призвела до вірогідного поліпшення низки біохімічних параметрів (табл. 1). Найбільш значущі позитивні зміни відзначалися з боку всіх досліджуваних показників вуглеводного обміну — глікемії натще, концентрації інсуліну і індексу HOMA-IR. Ці результати досить очікувані, оскільки безпосередньо відображають основні фармакологічні ефекти метформіну і ліраглутиду.
Після лікування параметри вуглеводного обміну вірогідно знижувалися. Так, постпрандіальна глікемія наприкінці спостереження знижувалася до 8,59 ± 0,36 ммоль/л від початкового рівня 11,82 ± 0,39 ммоль/л, тобто на 3,23 ммоль/л (37,6 %). Рівень HbA1c вірогідно зменшився до 7,34 ± 0,27 % (на 18,8 %).
Показники вмісту в крові базального інсуліну, С-пептиду, індексів функціональної активності бета-клітин та інсулінорезистентності в обстежених хворих до і на тлі лікування наведені в табл. 2.
Через 6 місяців терапії у хворих на ЦД 2-го типу з ожирінням вміст С-пептиду в крові вірогідно не змінювався. У той же час нами встановлено значуще підвищення індексу НОМА-β в процесі лікування при одночасному вірогідному зниженні індексу інсулінорезистентності НОМА-IR.
Відомо, що ГПП-1 справляє множинний вплив на ендокринну частину підшлункової залози, але його принциповою дією є потенціювання глюкозозалежної секреції інсуліну [18]. Підвищені рівні внутрішньоклітинного циклічного аденозинмонофосфату стимулюють протеїнкіназу А, що призводить до екзоцитозу інсулінових гранул з бета-клітин [26]. Крім того, в експериментальних роботах показано, що ГПП-1 впливає на масу бета-клітин, стимулюючи їх проліферацію і неогенез, блокуючи апоптоз [21]. Усе це дозволяє припустити, що ГПП-1 може стимулювати утворення нових бета-клітин у пацієнтів із ЦД 2-го типу і недостатньою кількістю функціонуючих клітин. Аналіз отриманих клінічних результатів дозволяє зробити висновок, що комбінація метформіну і ліраглутиду впливає на всі основні патогенетичні механізми розвитку ЦД 2-го типу — інсулінорезистентність, секреторний дефект бета-клітин і гіперпродукцію глюкози печінкою.
У процесі лікування нами вивчені показники вмісту в крові лептину початково і на тлі 6 місяців лікування метформіном і ліраглутидом. На початку лікування вміст лептину становив 25,8 ± 2,6 нг/мл, а при використанні метформіну й ліраглутиду спостерігалося вірогідне зниження лептину крові до 18,9 ± 2,2 нг/мл.
Отже, при терапії метформіном і ліраглутидом в регуляції інсулінорезистентності і розподілі вісцерального жиру активно брали участь й гормони жирової тканини.
Зміни гормональної секреції жирової тканини при лікуванні метформіном і ліраглутидом позначилися на ефективності корекції маси тіла хворих і кількості абдомінального жиру.
Спостерігалося вірогідне зниження маси тіла хворих і зменшення ОТ при терапії метформіном і ліраглутидом.
Так, комбіноване лікування призвело до зниження маси тіла з 114,6 ± 1,4 кг до 107,1 ± 1,8 кг (p < 0,05), ІМТ — з 38,2 ± 0,6 кг/м2 до 35,6 ± 0,8 кг/м2 (p < 0,05).
При цьому знижувалася і кількість абдомінального жиру, оскільки показник ОТ вірогідно зменшився з 118,2 ± 3,4 см до 109,6 ± 2,1 см. Отже, маса тіла хворих на ЦД 2-го типу з ожирінням знижувалася на 7,5 кг, а ОТ — на 8,6 см.
Нами виявлений вірогідний тісний кореляційний зв’язок між індексами інсулінорезистентності, функціональною активністю бета-клітин і лептином при застосуванні метформіну і ліраглутиду.
Комбінована терапія також супроводжувалася статистично значущим підвищенням активності антикоагулянтної системи протеїну С (медіана активності цієї системи підвищилася на 6,1 %; р < 0,05), недостатність якої виявлена на початковому етапі дослідження. Цей факт свідчить про позитивну тенденцію в динаміці функціонування протизгортальної системи на тлі здійснюваного лікування.
Через шість місяців лікування в групі комбінованої терапії виявлено статистично вірогідне підвищення рівня адипонектинемії (14,89 [7,72; 17,61] мкг/мл проти 9,79 [6,81; 16,97] мкг/мл; р < 0,05). Підвищення медіани концентрації адипонектину становило 3,46 мкг/мл (31,8 %), що відображує зниження загального кардіометаболічного ризику на тлі здійснюваного лікування. Зміна рівня адипонектину не залежала від зниження маси тіла, ІМТ і ОТ, проте негативно корелювала зі зміною глікемії натще (r = –0,58; р < 0,05), тобто частково була взаємозв’язана з основним фармакологічним ефектом препаратів. У контрольній групі пацієнтів значущої зміни цього показника не відзначалося, хоча спостерігалася тенденція до підвищення медіани його концентрації на 16,7 % (12,35 [7,67; 15,74] мкг/мл проти 10,64 [7,35; 18,07] мкг/мл; р > 0,05).
Комбінована терапія з прийомом метформіну та ліраглутиду впродовж тривалого періоду добре переносилася, була безпечною і дозволила ефективно впливати на ключові ланки патогенезу ЦД 2-го типу.
Нормалізація вуглеводного обміну при призначенні комбінації метформіну і ліраглутиду досягається не лише за рахунок глюкозозалежної стимуляції синтезу інсуліну, а й за рахунок реалізації таких важливих ефектів, як зниження ліпотоксичності, продукції жировою тканиною лептину, маси тіла, кількості абдомінального жиру, що сприяло зниженню вираженості інсулінорезистентності і підвищенню функціональної активності бета-клітин підшлункової залози.
Подаємо декілька клінічних прикладів застосування ліраглутиду.
Пацієнт К., 1964 р. народження. Хворіє на ЦД 2-го типу протягом шести років. Отримує метформін у добовій дозі 2500 мг, показник HbA1c 8,4 %. Глікемія натще 9,7 ммоль/л, постпрандіальна глікемія 11,3 ммоль/л. Інсулін крові 23,5 мкОд/мл. ІМТ 34,0 кг/м2 (маса тіла 115 кг, ріст 184 см), тригліцериди крові 2,3 ммоль/л, АТ 150/90 мм рт.ст. на тлі антигіпертензивної терапії. Порушень функціонального стану з боку серця і нирок не виявлено.
Враховуючи наявність інсулінорезистентності, ожиріння I ст., неможливість досягнення компенсації ЦД на тлі монотерапії метформіном, хворому було призначено підшкірні ін’єкції ліраглутиду (Віктоза) 1 раз на добу. Початкова доза препарату становила 0,6 мг/добу. Через тиждень дозу збільшили до 1,2 мг/добу.
Після лікування впродовж шести місяців спостерігалося зниження маси тіла на 7,8 кг (на 6,8 %), ІМТ — на 2,3 кг/м2, ОТ — на 6 см. Найвагомішими були зміни з боку рівня глікемії натще (5,9 ммоль/л), постпрандіальної глікемії (7,9 ммоль/л), концентрації інсуліну (зниження до 18,9 мкОд/мл) та індексу HOMA-IR (з 5,1 до 3,6). Рiвень HbA1c через 6 місяців становив 7,1 %.
Через 6 місяців лікування вміст С-пептиду в крові практично не змінювався. Під впливом лікування показники загального холестерину крові, холестерину ЛПНЩ, тригліцеридів і коефіцієнт атерогенності знижувалися і досягнули нормальних значень (пацієнт додатково отримував статини відповідно до протоколу лікування ЦД 2-го типу).
Лікування метформіном та ліраглутидом упродовж тривалого періоду добре переносилося, будь-яких побічних явищ не спостерігалося.
Як бачимо, призначення ліраглутиду сприяло досягненню компенсації ЦД, зниженню маси тіла та інсулінорезистентності із значним поліпшенням якості життя хворого.
Хвора Н., 1957 р. народження. Хворіє на ЦД 2-го типу протягом дев’яти років. Отримує метформін в добовій дозі 2500 мг і гліклазид пролонгованого вивільнення (добова доза 120 мг). Показник HbA1c становить 9,8 %. Глікемія натще 10,3 ммоль/л, постпрандіальна глікемія 12,9 ммоль/л. Інсулін крові 26,1 мкОд/мл. Відзначає збільшення маси тіла за останні 2 роки на 6 кг.
ІМТ 36,2 кг/м2 (маса тіла 102 кг, ріст 168 см), АТ 155/85 мм рт.ст., індекс HOMA-IR 5,9.
Враховуючи стан декомпенсації ЦД на тлі інсулінорезистентності, ожиріння II ст., неможливість досягнення компенсації ЦД призначенням метформіну і похідних сульфонілсечовини, хворій призначено ліраглутид (Віктоза) 1 раз на добу. Початкова доза препарату становила 0,6 мг/добу, а через 7 днів дозу збільшили до 1,2 мг/добу. Доза метформіну не змінювалася впродовж спостереження. Через 3 місяці спостерігали зниження показника HbA1c до 7,9 %, тому дозу гліклазиду пролонгованого вивільнення зменшено до 60 мг/добу. Через 6 місяці показник HbA1c зменшився до 7,2 %, тому похідні сульфонілсечовини були відмінені.
Через 6 місяців лікування спостерігалося зниження маси тіла на 8,5 кг (на 8,4 %), ІМТ — на 3,0 кг/м2, ОТ — на 5 см. Глікемія натще становила 6,1 ммоль/л, постпрандіальна глікемія — 8,0 ммоль/л, вміст інсуліну знизився до 21,4 мкОд/мл, індекс HOMA-IR — до 3,9. Лікування добре переносилося, будь-яких побічних явищ не зареєстровано.
У цьому випадку досягнення стану компенсації відбулося шляхом додаткового призначення агоніста ГПП-1 при поступовому зменшенні дози похідних сульфонілсечовини. Лікування сприяло зниженню маси тіла та показника інсулінорезистентності без побічних реакцій.
Висновки
Комбінована терапія, що включає прийом метформіну і ліраглутиду, сприяє більш значущому зниженню маси тіла порівняно з монотерапією метформіном і дозволяє ефективніше впливати на ключові ланки патогенезу цукрового діабету 2-го типу — вісцеральне ожиріння та інсулінорезистентність, а також сприяє поліпшенню параметрів ліпідного обміну.
У хворих на ЦД 2-го типу і ожиріння на тлі терапії ліраглутидом в комбінації з метформіном відбувається поліпшення показників вуглеводного обміну у вигляді зниження глікемії натще на 28,6 %, постпрандіальної глікемії на 37,6 %, HbA1c — на 18,8 % відносно початкових рівнів. Поліпшення компенсації вуглеводного обміну на тлі лікування ліраглутидом в комбінації з метформіном супроводжується зниженням інсулінорезистентності (на 24,1 % за індексом НОМА-IR), підвищенням функціональної активності бета-клітин підшлункової залози (на 29,8 % за індексом НОМА-β).
Гіполіпідемічний ефект ліраглутиду в комбінації з метформіном у хворих на ЦД 2-го типу з ожирінням проявляється зниженням загального холестерину крові на 15,8 %, холестерину ЛПНЩ — на 30,9 %, тригліцеридів — на 47,8 % і коефіцієнта атерогенності — на 25,5 % відносно початкових рівнів.
Терапія ліраглутидом в комбінації з метформіном призводить до зниження маси тіла, індексу маси тіла, ОТ, що є додатковим чинником підвищення клінічної ефективності поєднання аналога глюкагоноподібного пептиду-1 з метформіном при лікуванні хворих на ЦД 2-го типу з ожирінням.
Гормональна активність жирової тканини при лікуванні хворих на ЦД 2-го типу з ожирінням ліраглутидом і метформіном змінюється у вигляді зниження лептину на 23,2 % відносно початкових рівнів.
1. Аметов А.С., Камынина Л.Л. Роль и место первого человеческого аналога ГПП-1 лираглутида в практике эндокринолога // Сахарный диабет 2 типа: проблемы и решения. — М.: ГЭОТАР, 2011. — С. 380–404.
2. Анциферов М.Б., Дорофеева Л.Г. Перспективы применения первого аналога человеческого глюкагоноподобного пептида-1, лираглутида, в терапии пациентов с сахарным диабетом типа 2 // Фарматека. — 2009. — № 3. — С. 7–23.
3. Арутюнов Г.П. Терапия факторов риска сердечно-сосудистых заболеваний [руководство] / Арутюнов Г.П. — М.: ГЭОТАР-Медиа, 2010. — 672 с.
4. Братусь В.В. Ожирение, инсулинорезистентность, метаболический синдром: фундаментальные и клинические аспекты / В.В. Братусь, Т.В. Талева, В.А. Шумаков. — К.: Четверта хвиля, 2009. — 416 с.
5. Галстян Г.Р. Клинические аспекты использования первого аналога человеческого глюкагоноподобного пептида-1 длительного действия — лираглутида при сахарном диабете 2 типа // Сахарный диабет. — 2010. — Спецвыпуск. — С. 7–10.
6. Дедов И.И., Шестакова М.В. Лираглутид: первый аналог человеческого ГПП-1 в лечении сахарного диабета 2-го типа: Практическое руководство для врачей. — М.: Дипак, 2010. — 48 с.
7. Ефимов А.С. Патогенез и лечение хронических осложнений сахарного диабета / А.С. Ефимов, Н.Д. Тронько, Л.К. Соколова // Вісник фармакології та фармації. — 2007. — № 11. — С. 27–34.
8. Левит Ш. Сахарный диабет 2 типа: время изменить концепцию / Ш. Левит, Ю.И. Филиппов, А.С. Горелышев // Сахарный диабет. — 2013. — № 1. — С. 91–102.
9. Маньковский Б.Н. Сердечно-сосудистые заболевания у больных сахарным диабетом: что важно знать кардиологу, эндокринологу и неврологу / Б.Н. Маньковский, О.Н. Барна // Ліки України. — 2010. — № 4(140). — С. 24–28.
10. Смирнова О.М., Кононенко И.В. Гипогликемизирующая терапия больных сахарным диабетом 2 типа и ишемической болезнью сердца, в том числе с инфарктом миокарда и после интервенционных вмешательств // Сахарный диабет. — 2012. — № 3. — С. 27–38.
11. Шестакова М.В. Лираглутид — возможности комплексного терапевтического подхода в терапии сахарного диабета 2 типа // Сахарный диабет. — 2010. — Спецвыпуск. — С. 3–6.
12. Bennett W.L., Maruthur N.M., Singh S. et al. Comparative effectiveness and safety of medications for type 2 diabetes: an update including new drugs and 2-drug combinations // Ann. Intern. Med. — 2011. — Vol. 154, № 9. — Р. 602–613.
13. Blonde L., Russell-Jones D. The safety and efficacy of liraglutide with or without oral antidiabetic drug therapy in type 2 diabetes: an overview of the LEAD 1–5 studies // Diabetes Obes. Metab. — 2009. — Suppl. 3. — P. 26–34.
14. Buse J.B., Rosenstock J., Sesti G. et al.; LEAD-6 Study Group. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6) // Lancet. — 2009. — Vol. 374(9683). — P. 39–47.
15. Colagiuri S. Optimal management of type 2 diabetes: the evidence // Diabetes Obes. Metab. — 2012. — Vol. 14, Suppl. 1. — P. 3–8.
16. Cranberry M.C. Cardiovascular risk factors associated with insulin resistance: effects of oral antidiabetic agents / M.C. Cranberry, V.A. Fonseca // Am. J. Cardiovasc. Drugs. — 2005. — Vol. 5. — P. 201–209.
17. Cumbie B.C. Current concepts in targeted therapies for the pathophysiology of diabetic microvascular complications / B.C. Cumbie, K.L. Hermayer // Vasc. Health Risk Manag. — 2007. — Vol. 3, № 6. — P. 823–832.
18. Davies M.J., Kela R., Khunti K. Liraglutide — overview of the preclinical and clinical data and its role in the treatment of type 2 diabetes // Diabetes Obes. Metab. — 2011. — Vol. 13(3). — P. 207–220.
19. Ford E.S. Risks for all-cause mortality, cardiovascular disease, and diabetes associated with the metabolic syndrome: a summary of the evidence // Diabetes Care. — 2005. — Vol. 28. — P. 1769–1778.
20. Gallwitz B., Vaag A., Falahati A., Madsbad S. Adding liraglutide to oral antidiabetic drug therapy: onset of treatment effects over time // Int. J. Clin. Pract. — 2010. — Vol. 64(2). — P. 267–276.
21. Garber A. Glucagon-like peptide-1 — based therapies: new developments and emerging data // Journal Diabetes Compilations. — 2008. — Vol. 10 (Suppl. 3). — Р. 22–35.
22. Garber A., Henry R., Ratner R.T. et al.; LEAD-3 (Mono) Study Group. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): randomised, 52-week, phase III, double-blind, parallel-treatment trial // Lancet. — 2009. — № 373. — P. 438–439.
23. Garber A., Henry R., Ratner R. et al. Monotherapy with liraglutide, a once-daily human GLP-1 analog, provides sustained reduction in A1C, FGP and weight compared with glimepiride in type 2 diabetes: LEAD-3 Mono 2-years results // 69th ADA Scientific Sessions Abstract Book. — 2009. — Р. 162-OR.
24. Ghandehari H. Abdominal obesity and the spectrum of global cardiometabolic risk in US adults / H. Ghandehari, V. Le, S. Kamal-Bahl et al. // Int. J. Obes. (Lond) — 2009. — Vol. 33, № 2. — P. 239–248.
25. Gier B., Butler P.C., Lai C.K. et al. Glucagon like peptide-1 receptor expression in the human thyroid gland // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97(1). — P. 121–131.
26. Holst J. The physiology and pharmacology of incretins in type 2 diabetes // Diabetes Obes. Metab. — 2008. — Vol. 10 (Suppl. 3). — Р. 14–21.
27. IDF Diabetes Atlas 2013. http://www.idf.org/diabetesatlas/6e/Update 2013.
28. Inzucchi S.E. Management of hyperglycaemia in type 2 diabetes: a patient-centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) / S.E. Inzucchi, R.M. Bergenstal // Diabetologia. — 2012. — Vol. 55, № 6. — P. 1577–1596.
29. Marre M., Shaw J., Brandle M. et al.; LEAD–1 SU study group. Liraglutide, a once-daily human GLP-1 analogue, added to a sulphonylurea over 26 weeks produces greater improvements in glycaemic and weight control compared with adding rosiglitazone or placebo in subjects with Type 2 diabetes (LEAD-1 SU) // Diabet Med. — 2009. — Vol. 26(3). — P. 268–278.
30. Matthews D., Vilsboll T., Courreges J.-P. et al. Liraglutide improves b-cell function as assessed by HOMA-B and proinsulin:insulin ratio: Meta-analysis of 6 clinical trials // 70th ADA Scientific Sessions. — 2010. — 1513.
31. McGill J.B. Liraglutide: effects beyond glycaemic control in diabetes treatment // Int. J. Clin. Pract. Suppl. — 2010. — Vol. 64(167). — P. 28–34.
32. Nauck M., Frid A., Hermansen K. et al.; LEAD–2 Study Group. Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin, in type 2 diabetes: the LEAD (liraglutide effect and action in diabetes)-2 study // Diabetes Care. — 2009. — Vol. 32(1). — P. 84–90.
33. Russell-Jones D., Vaag A., Schmitz O. et al. Liraglutide Effect and Action in Diabetes 5 (LEAD-5) met+SU Study Group. Liraglutide vs insulin glargine and placebo in combination with metformin and sulfonylurea therapy in type 2 diabetes mellitus (LEAD-5 met+SU): a randomised controlled trial // Diabetologia. — 2009. — Vol. 52(10). — P. 2046–2055.
34. Taton J. Diabetologia kliniczna / Taton J., Czech A., Bernas M. — Warszawa: Wydawnictwo lekarskie, 2008. — 922 p.
35. Type 2 diabetes in practice / Ed. by A.J. Krentz, C.J. Bailey. — Royal Society of Medicine Press Ltd., 2007. — 190 p.
36. Vilsboll T., Brock B., Perrild H. et al. Liraglutide, a once-daily human GLP-1 analogue, improves pancreatic B-cell function and arginine-stimulated insulin secretion during hyperglycaemia in patients with Type 2 diabetes mellitus // Diabet. Med. — 2008. — Vol. 25(2). — P. 152–156.
37. Yang W., Chen L., Ji Q. et al. Liraglutide provides similar glycaemic control as glimepiride (both in combination with metformin) and reduces body weight and systolic blood pressure in Asian population with type 2 diabetes from China, South Korea and India: a 16-week, randomized, double-blind, active control trial // Diabetes Obes. Metab. — 2011. — Vol. 13(1). — P. 81–88.
38. Zinman B., Gerich J., Buse J.B. et al.; LEAD-4 Study Investigators. Efficacy and safety of the human glucagon-like peptide-1 analog liraglutide in combination with metformin and thiazolidinedione in patients with type 2 diabetes (LEAD-4 Met+TZD) // Diabetes Care. — 2009. — Vol. 32(7). — P. 1224–1230.

/97/97.jpg)