Резюме
Мета. Удосконалення відомих способів діагностики уражень нирок у хворих на гіпотиреоз із компонентами метаболічного синдрому, вивчення впливу комплексного лікування на функціональний стан нирок. Матеріал і методи. У дослідження включено 240 хворих на первинний гіпотиреоз (серед них — 130 хворих на первинний гіпотиреоз із компонентами метаболічного синдрому). Всі рандомізовані пацієнти були розподілені на 2 групи: І група включала 42 хворих на гіпотиреоз без ожиріння (вік 44,8 ± 5,7 року; індекс маси тіла (ІМТ) 21,3 ± 2,6 кг/м2); II група — 45 хворих на гіпотиреоз із абдомінальним ожирінням (вік 43,8 ± 6,1 року; ІМТ 33,4 ± 4,8 кг/м2). До групи контролю входили 20 здорових осіб (вік 43,5 ± 5,9 року; ІМТ 22,0 ± 2,4 кг/м2). Ураження нирок констатували за порушення проникності клубочкового фільтра — появи альбумінурії та за показниками швидкості клубочкової фільтрації (ШКФ), визначеної за формулами CKD-EPI. Концентрацію моноцитарного хемоатрактантного протеїну-1 (МХП-1), лептину, інсуліну визначали методом імуноферментного аналізу. Результати. При проведенні кореляційного аналізу ШКФ у хворих І групи встановлено: зворотний середньої сили кореляційний зв’язок між рівнем ШКФ і тиреотропного гормону (ТТГ) (r = 0,571), ШКФ і васкулоендотеліальним фактором росту (r = –0,616), ШКФ та інтерлейкіном-6 (IL-6) (r = –0,418), загальним холестерином (ХС) (r = –0,311), ШКФ та індексом інсулінорезистентності (ІІР) (r = –0,606) та слабкий зворотний зв’язок між рівнем ШКФ і МХП-1 (r = –0,2917). У хворих ІІ групи: прямий сильний кореляційний зв’язок між рівнем ШКФ та ІІР (r = 0,819), індексом Каро (r = 0,793) і зворотний сильний кореляційний зв’язок між ШКФ і ТТГ (r = –0,782), ШКФ та індексом Хома (r = –0,875), зворотний середньої сили кореляційний зв’язок між рівнем ШКФ і ХС (r = –0,577), лептином (r = –0,476), ШКФ і IL-6 (r = –0,418), ШКФ і глюкозою (r = –0,436) та васкулоендотеліальним фактором росту (r = –0,337). Висновки. У пацієнтів з некомпенсованим гіпотиреозом виявлено порушення функції нирок, що характеризувалось зниженням ШКФ, появою альбумінурії. Комплексне лікування із включенням інгібітора АПФ (еналаприлу) та аторвастатину виявляє патогенетично обґрунтований вплив на маркери ушкодження функціонального апарату нирок.
Цель. Усовершенствование известных способов диагностики поражений почек у больных гипотиреозом с компонентами метаболического синдрома, изучение влияния комплексного лечения на функциональное состояние почек. Материал и методы. В исследование включены 240 больных первичным гипотиреозом (из них — 130 больных первичным гипотиреозом с компонентами метаболического синдрома). Все рандомизированные пациенты были разделены на две группы: I группа включала 42 больных гипотиреозом без ожирения (возраст 44,8 ± 5,7 года; индекс массы тела (ИМТ) 21,3 ± 2,6 кг/м2); II группа — 45 больных гипотиреозом с абдоминальным ожирением (возраст 43,8 ± 6,1 года; ИМТ 33,4 ± 4,8 кг/м2). В группу контроля входили 20 здоровых лиц (возраст 43,5 ± 5,9 года; ИМТ 22,0 ± 2,4 кг/м2).
Поражения почек констатировали по нарушению проницаемости клубочкового фильтра — появлению альбуминурии и показателям скорости клубочковой фильтрации (СКФ), определенной по формулам CKD-EPI. Концентрацию моноцитарного хемоаттрактантного протеина-1 (МХП-1), лептина, инсулина определяли методом иммуноферментного анализа. Результаты. При проведении корреляционного анализа СКФ установлено у больных I группы: обратной средней силы корреляционная связь между уровнем СКФ и тиреотропного гормона (ТТГ)
(r = 0,571), СКФ и васкулоэндотелиальным фактором роста (r = –0,616), СКФ и интерлейкином-6 (IL-6) (r = –0,418), общим холестерином (r = –0,311), СКФ и индексом инсулинорезистентности (ИИР) (r = –0,606) и слабая обратная связь между уровнем СКФ и МХП-1 (r = –0, 2917). У больных ІІ группы: прямая сильная корреляционная связь между уровнем СКФ и ИИР (r = 0,819), индексом Caro (r = 0,793) и обратная сильная корреляционная связь между СКФ и ТТГ (r = –0,782), СКФ и индексом HOMA (r = –0,875), обратная средней силы корреляционная связь между уровнем СКФ и холестерином (ХС) (r = –0,577), лептином (r = –0,476), СКФ и IL-6 (r = –0,418), СКФ и гликемией (r = –0,436) и ВЭФР (r = –0,337). Выводы. У пациентов с некомпенсированным гипотиреозом выявлено нарушение функции почек, характеризующееся снижением СКФ, появлением альбуминурии. Комплексное лечение с включением ингибитора АПФ (эналаприла) и аторвастатина обнаруживает патогенетически обоснованное влияние на маркеры повреждения функционального аппарата почек.
Objective. To improve known methods of diagnosing kidney damage in patients suffering from hypothyroidism with elements of metabolic syndrome, to study the effect of combined treatment on renal function. Materials and methods. The study included 240 patients with primary hypothyroidism (among them — 130 patients with primary hypothyroidism with components of the metabolic syndrome). All patients were divided into 2 groups: the I group included 42 patients with hypothyroidism without obesity (age 44.8 ± 5.7 years; body mass index (BMI) 21.3 ± 2.6 kg/m2); group II — 45 patients with hypothyroidism and abdominal obesity (age 43.8 ± 6.1 years; BMI 33.4 ± 4.8 kg/m2). The control group included 20 healthy individuals (age 43.5 ± 5.9 years; BMI 22.0 ± 2.4 kg/m2). Kidney damage was detected in violation of glomerular filter permeability — occurrence of albuminuria and parameters of glomerular filtration rate (GFR) were determined using CKD-EPI formulas. The concentration of monocyte chemoattractant protein-1 (MCP-1), leptin, insulin was determined by immunoenzyme assay. Results. During the correlation analysis, between GFR in patients of group I we have established: moderate inverse correlation between the level of GFR and thyroid stimulating hormone (TSH) (r = 0.571), GFR and vascular endothelial growth factor (r = –0.616), GFR anf interleukin-6 (IL-6) (r = –0.418), total cholesterol (ChS) (r = –0.311), GFR and insulin resistance index (IIR) (r = –0.606) and weak inverse relationship between level of GFR and MCP-1 (r = –0.2917). In the II group of patients, a strong direct correlation between the level of GFR and IIR (r = 0.819), Caro index (r = 0.793) and a strong inverse correlation between GFR and TSH (r = –0.782), GFR and HOMA index (r = –0.875), moderate inverse correlation between the levels of GFR and ChS (r = –0.577), leptin (r = –0.476), GFR and IL-6 (r = –0.418), GFR and glucose (r = –0.436) and vascular endothelial growth factor (r = –0.337). Conclusions. In patients with uncompensated hypothyroidism, we have detected renal dysfunction, which was characterized by a decrease in GFR, albuminuria appearance. During combined treatment with the inclusion of angiotensin-converting enzyme inhibitor (enalapril) and atorvastatin, we have noted pathogenetically grounded effect on markers of functional kidney injury.
Статтю опубліковано на с. 97-103
Роботу виконано в рамках науково-дослiдної роботи кафедри ендокринології ДВНЗ «Iвано-Франкiвський нацiональний медичний унiверситет»: «Розробка нових підходів до комплексного лікування гіпотиреозу» (номер державної реєстрацiї 0113U005376; 2013–2018 рр.). Автори гарантують вiдсутнiсть конфлiкту iнтересiв і власної фiнансової зацiкавленостi при виконаннi роботи та написаннi статтi.
Вступ
Останніми роками активно вивчаються взаємозв’язки між нирками і щитоподібною залозою (ЩЗ) [4, 8, 14–19, 23]. Встановлено, що не тільки тиреоїдні гормони здійснюють гормональну регуляцію основних ниркових функцій, але й нирки, в свою чергу, беруть участь у метаболізмі тиреоїдних гормонів [4]. Нирки надзвичайно чутливі до нестачі або відсутності тиреоїдних гормонів. Дефіцит тиреоїдних гормонів супроводжується порушенням процесів метаболізму з подальшим розвитком змін різного ступеня вираженості у всіх без винятку органах і системах, у тому числі викликає значні зміни ниркової функції [19]. У даний час питання взаємозв’язку функціонального стану ЩЗ і нирок недостатньо вивчене і є предметом численних публікацій, в яких висловлюються різні патофізіологічні концепції. Слід зазначити, що гіпотиреоз викликає значні зміни ниркової функції, такі як зниження реабсорбції натрію в проксимальних канальцях, порушення концентраційної функції дистальних канальців, зменшення екскреції сечової кислоти, зниження ниркового кровотоку і швидкості клубочкової фільтрації (ШКФ) [17]. Ефект тиреоїдних гормонів на ці параметри проявляється на різних рівнях. Серед преренальних факторів можна виділити зниження серцевого викиду. Регуляція ренального потоку крові в сторону зменшення при гіпотиреозі також пов’язана з підвищенням периферичного судинного опору, внутрішньонирковою вазоконстрикцією, зниженням ниркової відповіді на вазодилататори, зниженням експресії ренальних вазодилататорів. Крім того, ренальний потік крові може знижуватись через патологічні зміни в структурі клубочків при гіпотиреозі, такі як потовщення базальної мембрани клубочка і розширення мезангіального матриксу. Ряд авторів описують ниркову недостатність, спричинену гіпотиреозом [18], а також вказують на частий зв’язок між гіпотиреозом і зниженням ШКФ у хворих із прогресуючою хронічною хворобою нирок (ХХН) і у пацієнтів зі збереженою функцією нирок.
Нещодавно проведені епідеміологічні дослідження показали, що серед пацієнтів із порушенням функції нирок маніфестний гіпотиреоз виникає у 18–20 % пацієнтів із хронічним захворюванням нирок (без необхідності в замісній нирковій терапії), поширеність гіпотиреозу збільшується у міру наростання ступеня тяжкості порушення ниркової функції [18, 23]. На думку G. Basu [14], порушення функції нирок у хворих на маніфестний гіпотиреоз відбувається під впливом таких неімунних факторів, як підвищений рівень загального холестерину (ЗХС), артеріальна гіпертензія (АГ), внутрішньоклубочкова гіпертензія.
З другого боку, навіть незначне зниження функції нирок асоціюється з підвищенням серцево-судинного ризику, що зростає обернено пропорційно до рівня ШКФ. Зі зростанням рівня креатиніну крові підвищується ризик розвитку фатальних кардіоваскулярних подій. Інтегральним маркером кардіоренальних взаємозв’язків можна вважати мікроальбумінурію (МАУ) [7]. Основне клінічне значення МАУ полягає в тому, що це незалежний фактор ризику розвитку як термінальної хронічної ниркової недостатності, так і серцево-судинних ускладнень [20, 22]. Мультиваріантний регресійний аналіз показує, що МАУ відображає комплекс патологічних процесів, які відбуваються в організмі [7]. Так, регістр NHANES III демонструє, що вже підвищений нормальний артеріальний тиск (АТ) за класифікацією JNC7 (130–139/85–89 мм рт.ст.) [2] спричиняє появу МАУ: вірогідність її в цієї категорії пацієнтів збільшується в 2,13 раза порівняно зі строго нормотензивними. Збільшення середнього АТ на 10 мм рт.ст. підвищує ризик виникнення МАУ в 1,41 раза, систолічного АТ — в 1,27 раза, діастолічного АТ — в 1,29 раза.
Отже, незважаючи на пильний інтерес учених до даної проблеми, в даний час це питання продовжує залишатися недостатньо вивченим і є предметом численних публікацій, в яких висловлюються різноманітні патофізіологічні концепції ушкодження нирок при гіпотиреозі, проте вони є досить неоднозначними.
Мета дослідження — удосконалення відомих способів діагностики уражень нирок у хворих на гіпотиреоз із компонентами метаболічного синдрому, вивчення впливу комплексного лікування на функціональний стан нирок.
Матеріал і методи
У дослідження включені 240 хворих на первинний гіпотиреоз (серед них — 130 хворих на первинний гіпотиреоз з абдомінальним ожирінням). Критеріями включення були: вік пацієнтів від 36 до 60 років, уперше виявлений або декомпенсований гіпотиреоз. Наявність будь-якого гострого або хронічного захворювання нирок, ішемічна хвороба серця були критеріями виключення. Діагноз встановлювався на підставі скарг, даних анамнезу, характерної клінічної картини гіпотиреозу та підтверджувався результатами гормонального дослідження. Проводили визначення антропометричних характеристик з оцінкою індексу маси тіла (ІМТ), який розраховували за формулою Кетле (ІМТ = МТ/Р2, де МТ — маса тіла, кг; P — зріст, м). Для з’ясування типу ожиріння розраховували відношення окружності талії (ОТ) до окружності стегон (ОС). Для подальшого дослідження рандомізовано 87 хворих. Всі пацієнти були розподілені на дві групи: І група включала 42 хворих на гіпотиреоз без ожиріння (вік 44,8 ± 5,7 року; ІМТ 21,3 ± 2,6 кг/м2); II група — 45 хворих на гіпотиреоз із абдомінальним ожирінням (вік 43,8 ± 6,1 року; ІМТ 33,4 ± 4,8 кг/м2). У групу контролю увійшли 20 здорових (вік 43,5 ± 5,9 року; ІМТ 22,0 ± 2,4 кг/м2) осіб.
Для контролю вуглеводного обміну натще визначали концентрацію глюкози глюкозооксидазним методом. Рівень ендогенного інсуліну визначали імуноферментним методом з використанням реактивів DRG Diagnostics (Німеччина). Індекс інсулінорезистентності розраховували за формулою: НОМА-ІR = глюкоза натще (ммоль/л) × інсулін натще (мкМО/мл)]/22,5). Ураження нирок констатували за порушенням проникності клубочкового фільтра — появою альбумінурії і за показниками ШКФ, визначеними за формулами CKD-EPI. Рівень гормонів ЩЗ (вТ4 і вТ3), а також тиреотропного гормону (ТТГ) визначали в імунологічній лабораторії обласної клінічної лікарні з використанням аналізатора StatFax 303 та набору реактивів DRG (США). ЗХС і тригліцериди (ТГ) визначали ферментативним методом за допомогою реактивів фірми Human, холестерин ліпопротеїнів високої щільності (ЛПВЩ) — реактивами фірми «Діакон-ДС» на аналітичному аналізаторі Accept-200. Рівень ХС ліпопротеїнів дуже низької щільності (ЛПДНЩ) у крові обчислювали, застосовуючи математичну формулу: ЛПДНЩ = ТГ/2,2 ммоль/л, а рівень ХС ліпопротеїнів низької щільності (ЛПНЩ) — за математичною формулою: ЛПНЩ = ЗХС – (ЛПВЩ + ТГ/2,2) ммоль/л. Розраховували також коефіцієнт атерогенності (КА) за формулою: КА = (ХС ЛПВЩ)/ЛПВЩ. Вміст лептину (норма 3,7–11,1 нг/мл) визначали за допомогою набору Diagnostics Biochem Canada Inc. Концентрацію моноцитарного хемоатрактантного протеїну-1 (МХП-1) визначали методом імуноферментного аналізу з використанням тест-системи виробництва фірми Bender MedSystem (Австрія), васкулоендотеліальний фактор росту (ВЕФР) — тест-системами виробництва фірми ЗАТ «Вектор-Бест» (м. Новосибірськ, РФ), інтерлейкін-6 (IL-6) — тест-системами виробництва фірми Bender MedSystem (Австрія).
Обов’язкове інструментальне обстеження включало вимірювання АТ, ультразвукове дослідження органів сечової системи, ультразвукову допплерографію ниркового кровотоку.
Статистичний аналіз проводився варіаційно-статистичним методом. При аналізі матеріалу розраховували середні величини (M), їх стандартні похибки (m) і довірчий інтервал. Вірогідність відмінностей оцінювали за t-критерієм Стьюдента для залежних і незалежних вибірок, при нерівномірності розподілів використовували непараметричний критерій Mann — Whitney (U), Wilkonson (W). Відмінності вважали вірогідними при р < 0,05. Залежність показників оцінювалася методом Спірмена з обчисленням коефіцієнта кореляції. Статистичне опрацювання матеріалу проведене методом варіаційної й описової статистики за допомогою стандартного пакета статистичних розрахунків Statistica 6.0, Foxbase, Exсel 6.0 на персональному комп’ютері Pentium III.
Результати
За результатами проведених досліджень, середній рівень ТТГ у хворих І групи становив 11,89 ± 2,71 мМО/л та 16,26 ± 2,45 мМО/л у хворих ІІ групи. Порушення бар’єрної функції виявлено у 52,6 % всіх обстежених хворих, з них у 40 % І групи та 63,6 % ІІ групи. У 35 % пацієнтів І групи виявлена МАУ, у 5 % — протеїнурія. Рання стадія нефропатії (гіперфільтрація без МАУ) відзначалася у 24 %. Серед пацієнтів ІІ групи МАУ виявлена в 50 %, у 13,6 % пацієнтів — протеїнурія.
При порівнянні середніх значень рівня АТ у хворих на гіпотиреоз було виявлено: систолічний артеріальний тиск (САТ) у пацієнтів І групи становив 129,98 ± 8,33 мм рт.ст., що вірогідно не відрізнявся від САТ здорових осіб — 121,85 ± 3,33 мм рт.ст.; діастолічний АТ (ДАТ) — 82,30 ± 2,47 мм рт.ст., що вірогідно вище, ніж у здорових — 63,71 ± 5,81 мм рт.ст., проте відповідає критеріям нормального АТ. Пульсовий АТ (ПАТ) був вірогідно нижчим — 47,68 ± 5,86 мм рт.ст. (р < 0,001) порівняно із здоровими — 58,14 ± 1,53 мм рт.ст. У ІІ групі пацієнтів рівні САТ — 149,78 ± 2,28 мм рт.ст., ДАТ — 91,83 ± 1,7 мм рт.ст. і ПАТ — 57,98 ± 1,28 мм рт.ст. були вірогідно вищими, ніж у І групі.
При проведенні КА встановлено, що ймовірність виникнення МАУ зростає при збільшенні як САТ, так і ДАТ, а також встановлена вірогідна залежність між рівнем ПАТ і частотою виявлення МАУ (р = 0,045). Подібні результати були отримані в інших дослідженнях при дослідженні рівнів МАУ у хворих із симптоматичною артеріальною ренопаренхіматозною гіпертензією [4].
Рівень креатиніну в сироватці крові був вірогідно вищий в обох досліджуваних групах — 89,79 ± 0,16 мкмоль/л та 92,91 ± 4,85 мкмоль/л (р < 0,001), ніж у здорових осіб — 62,81 ± 1,74 мкмоль/л, проте у ІІ групі вони були вірогідно вищі, ніж у І групі.
Отримані нами результати підтверджують дані J.G. Hollander і співавт., що гіпотиреоз викликає значні зміни ниркової функції, такі як зниження реабсорбції натрію в проксимальних канальцях, порушення концентраційної функції дистальних канальців, зменшення екскреції сечової кислоти, зниження ниркового кровотоку і ШКФ [17].
ШКФ була нижчою у ІІ групі — 60,12 ± 1,84 мл/хв/1,73 м2, ніж у І — 77,99 ± 2,18 мл/хв/1,73 м2 (р<0,05) і вірогідно меншою в обох групах хворих, ніж у практично здорових осіб — 107,03 ± 1,72 мл/хв/1,73 м2, що свідчить про більше порушення функції нирок у хворих на гіпотиреоз із ожирінням. Негативний вплив ожиріння на структуру нирок пояснюють впливом гіперлептинемії, гіперінсулінемії, активацією локальної РААС адипоцитів та гемодинамічними факторами (компресія жировою тканиною, невідповідність кількості нефронів розмірам тіла, констрикція виносної артеріоли, гіпер- та гіпофільтрація, внутрішньоклубочкова гіпертензія) [9, 10, 21].
У групі пацієнтів із гіпотиреозом також спостерігалось статистично значиме підвищення рівня МХП-1: 143,15 ± 2,25 нг/мл — у пацієнтів без надмірної маси тіла та до 167,34 ± 3,85 нг/мл відповідно у пацієнтів із гіпотиреозом та ожирінням. Медіана даного показника в усіх перевищувала верхню границю референтного інтервалу нормальних значень для МХП-1, що становить 0–139 пг/мл. Підвищення рівнів МХП-1 свідчить про наявність формування активної запальної відповіді в групі пацієнтів із маніфестним гіпотиреозом та активацію моноцитарної ланки імунітету. Крім того, суттєве значення в зростанні рівня МХП-1 може мати вплив таких факторів, як АГ, протеїнурія та азотемія.
У нашому дослідженні при проведенні КА ШКФ встановлено у хворих І групи: зворотний середньої сили кореляційний зв’язок між рівнем ШКФ і ТТГ (r = 0,571), ШКФ і ВЕФР (r = –0,616), ШКФ і IL-6 (r = –0,418), ЗХС (r = –0,311), ШКФ і ІІР (r = –0,606) та слабкий зворотний зв’язок між рівнем ШКФ і МХП-1 (r = –0,2917).
У хворих ІІ групи встановлено прямий сильний кореляційний зв’язок між рівнем ШКФ і ІІР (r = 0,819), індексом Caro (r = 0,793) та зворотний сильний кореляційний зв’язок між ШКФ і ТТГ (r = –0,782), ШКФ та індексом HOMA (r = –0,875), зворотний середньої сили кореляційний зв’язок між рівнем ШКФ і ЗХС (r = –0,577), лептином (r = –0,476), ШКФ і IL-6 (r = –0,418), ШКФ і глікемією (r = –0,436) та ВЕФР (r = –0,337).
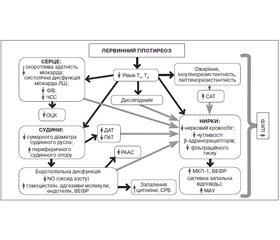
Отже, у пацієнтів із некомпенсованим гіпотиреозом виявлено порушення функції нирок, що характеризувалось зниженням ШКФ, появою альбумінурії. Отримані дані свідчать про те, що в патогенезі ураження нирок у хворих на гіпотиреоз без ожиріння однакову роль відіграють неімунні та імунні фактори: підвищений рівень ЗХС, IL-6, МХП-1, ВЕФР. У хворих на гіпотиреоз із абдомінальним ожирінням гіперінсулінемія, інсулінорезистентність і лептинорезистентність є медіаторами ренального ушкодження. Основні патогенетичні фактори формування порушення функції нирок відображені на рис. 1.
/100.jpg)
Золотим стандартом лікування гіпотиреозу будь-якої етіології є замісна терапія препаратами левотироксину. Призначення замісної гормональної терапії оптимізує ліпідознижувальний ефект статинів, але не є альтернативою ліпідознижувальній терапії [7]. Результати досліджень останніх років показали, що статини мають додаткові, так звані плейотропні, ефекти, що впливають на апоптоз, функцію ендотелію, протизапальну, антитромботичну дію та гальмують проліферацію гладком’язових клітин, оксидативні процеси. Сучасна стратегія нефропротекції є комплексом лікувальних впливів, насамперед медикаментозних, спрямованих на гальмування прогресування ураження нирок і запобігання (або уповільнення темпів розвитку) хронічній нирковій недостатності [5, 23]. Основу цієї стратегії становлять інгібітори ангіотензинперетворюючого ферменту (ІАПФ), захисний ефект яких обумовлений зниженням внутрішньоклубочкового тиску і протеїнурії, а також внутрішньониркового утворення ангіотензину II (АТII), який має профіброгенний вплив. Іншою особливістю дії ІАПФ є гальмування деградації брадикініну — потужного стимулятора вивільнення ендотелійрозслаблюючих факторів, таких як оксид азоту, фактор гіперполяризації і простациклін.
Всі хворі залежно від призначеного лікування були розподілені на 4 групи (табл. 1).
Лікування складалось з двох етапів. Перший етап — титрування дози LТ4 та еналаприлу. Інгібітор АПФ (еналаприл) призначали методом титрування відповідно від 2,5 мг/добу до досягнення максимально переносимої дози, оптимізувавши підбір дози для кожного пацієнта під контролем гемодинамічних показників.
Другий етап лікування — до індивідуально підібраних доз LТ4 та еналаприлу додавали аторвастатин 20 мг/добу. У жодного пацієнта не було протипоказань до призначення аторвастатину та еналаприлу. Для оцінки безпеки аторвастатину, згідно з інструкцією препарату, через 4 тижні в усіх пацієнтів визначали рівень глюкози крові, креатинфосфокінази, рівні печінкових трансаміназ (АлАТ, АсАТ) та сечової кислоти. Суттєвих відхилень у досліджуваних показниках виявлено не було.
Застосування LТ4 і особливо його поєднання з еналаприлом та аторвастатином сприяло покращенню клінічного стану хворих, зменшенню проявів гіпотиреозу, зниженню маси тіла, помірному зниженню АТ, а також нормалізації показників функції нирок.
Так, у ІА групі рівні як САТ, так і ДАТ під впливом лікування LТ4 вірогідно не знизились, хоча мали незначну тенденцію до зниження. У ІБ групі відзначалось вірогідне зниження як САТ, так і ДАТ і зростання ПАТ. У ІІА групі САТ знизився невірогідно, а ДАТ вірогідно знизився, проте залишався на рівні високого (86,64 ± 1,35 мм рт.ст.). При порівнянні результатів ІІБ групи виявлено вірогідне зниження САТ, ДАТ, причому рівні ДАТ відповідали нормальному рівню.
У процесі лікування вірогідного зниження рівня МАУ вдалося досягнути в усіх досліджуваних групах, проте гранично допустимій нормі відповідали показники ІБ групи — 29,29 ± 0,39 мг/дл (табл. 2). У ІІБ групі рівень МАУ вдалось знизити під впливом комплексного лікування на 48,2 %: із 88,18 ± 0,1 мг/дл до 42,5 ± 0,39 мг/дл, проте середній рівень продовжував утримуватись вище за норму, що свідчить про необхідність продовження терапії (табл. 2).
Обговорення
Клубочкова фільтрація є оборотною на фоні замісної гормональної терапії приблизно в 55 % випадків. У нашому дослідженні при визначенні рівня ШКФ у динаміці в пацієнтів ІА групи хоча і спостерігалось вірогідне підвищення рівня ШКФ, проте середнє значення показників продовжувало відповідати рівню
I ступеня ХХН. У ІБ групі зміни були найбільш вираженими — ШКФ підвищилась на 20,97 %: із 74,14 ± 2,03 мл/хв/1,73 м2 до 93,81 ± 1,85 мл/хв/1,73 м2 (р < 0,05), що відповідає 0-му ст. ХХН. На відміну від І групи в ІІА групі зміни були невірогідними, хоча показники ШКФ мали тенденцію до підвищення, а в ІІБ — вірогідними. Отже, застосоване лікування має позитивний вплив на процеси клубочкової фільтрації.
Позитивний вплив аторвастатину на ШКФ у хворих на симптоматичну АГ отримали в своєму дослідженні й інші автори [5], що пояснюється нормалізацією патологічних відхилень ліпідного спектра крові, а також позитивним нормалізуючим впливом на ендотеліальну дисфункцію.
Отже, пацієнти з гіпотиреозом, особливо з поєднаним абдомінальним ожирінням, потребують, крім доброї компенсації гіпотиреозу, ще й комплексного лікування для покращення функціонального стану нирок.
Висновки
1. У пацієнтів із некомпенсованим гіпотиреозом виявлено порушення функції нирок, що характеризувалось зниженням ШКФ, появою альбумінурії.
2. У патогенезі ураження нирок у хворих на гіпотиреоз без ожиріння однакову роль відіграють неімунні та імунні фактори: підвищений рівень загального холестерину, IL-6, МХП-1, ВЕФР.
3. У хворих на гіпотиреоз із абдомінальним ожирінням гіперінсулінемія, інсулінорезистентність та лептинорезистентність є медіаторами ренального ушкодження.
4. Комплексне лікування з включенням інгібітора АПФ (еналаприлу) та аторвастатину виявляє патогенетично обґрунтований вплив на маркери ушкодження функціонального апарату нирок.
Перспективи подальших досліджень
Вивчення можливостей медикаментозної корекції виявлених уражень інших органів-мішеней на фоні порушеного функціонального стану нирок у хворих на гіпотиреоз.
Список литературы
1. Захарова С.М. Ожирение и гипотиреоз / Захарова С.М., Савельева Л.В. // Ожирение и метаболизм. — 2013. — № 2. — С. 54-58.
2. Добронравов В.А. Многогранная альбуминурия: аспекты клинического значения / В.А. Добронравов, А.В. Смирнов, И.Г. Каюков // Нефрология. — 2009. — Т. 13, № 3. — С. 33-38.
3. Зелінська Н.Б. Діагностика патології серцево-судинної системи у хворих на гіпотиреоз / Н.Б. Зелінська // Клінічна ендокринологія та ендокринна хірургія. — 2010. — № 1(30). — С. 58-60.
4. Кузьменко Ю.Ю. Морфофункціональні зміни паренхіми нирки щурів при тривалому експериментальному гіпотиреозі / Ю.Ю. Кузьменко // Український морфологічний альманах. — 2011.– Т. 9, № 1. — С. 60-62.
5. Купновицька І.Г. Ниркові ефекти аторвастатину / І.Г. Купновицька, І.В. Мартинів, Л.А. Мигаль // Український терапевтичний журнал — 2011. — № 3. — С. 97-10.
6. Мітченко О.І. Серцево-судинний ризик на тлі дисфункції щитоподібної залози / О.І. Мітченко, В.Ю. Романов, А.О. Логвиненко // Український кардіологічний журнал. — 2011 — № 1. — С. 21-28.
7. Мухин Н.А. Микроальбуминурия — универсальный маркер неблагоприятного прогноза / Н.А. Мухин, В.В. Фомин, С.В. Моисеев // Клиническая медицина. — 2008. — № 11. — С. 4-9.
8. Орлова М.М. Диагностическая значимость исследования сывороточной концентрации и мочевой экскреции некоторых цитокинов при манифестном гипотиреозе / М.М. Орлова, Т.И. Родионова // Цитокины и воспаление. — 2012. — № 2(11). — С. 24-28.
9. Перцева Т.О. Вплив інсулінорезистентності на ренальну функцію в осіб з абдомінальним ожирінням / Т.О. Перцева, М.К. Рокутова // Медичні перспективи. — 2015. — Т. 20, № 2. — С. 30-36.
10. Федорова Е.Ю. Механизмы прогрессирования поражения почек при ожирении / Е.Ю. Федорова, И.М. Кутырина // Нефрология и диализ. — 2006. — Т. 8, № 2. — С. 104-111.
11. Andersen N.H. Decreased left ventricular longitudinal contraction in normotensive and normoalbuminuric patients with Type II diabetes mellitus: a Doppler tissue tracking and strain rate echocardiography study / N.H. Andersen, S.H. Poulsen, H. Eiskjer et al. // Clinical Science. — 2003. — Vol. 105. — P. 59-66.
12. Association between blood pressure and serum thyroid-stimulating hormone concentration within the reference range: a population-based study / B.O. Asvold, T. Bjoro, T.I .Nilsen, L.J. Vatten // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92(3). — P. 841-845.
13. Association between obesity and kidney disease: a systemic review and meta-analysis / Y. Wang, X. Chen, Y. Song [et al.] // Kidney Int. — 2008. — Vol. 73. — P. 19-33.
14. Basu G. Interactions between thyroid disorders and kidney disease / G. Basu, A. Mohapatra // Indian J. Endocrinol. Metab. — 2012. — Vol. 16(2). — P. 204-213.
15. Cirillo L. Definition of kidney dysfunction as a cardiovascular risk factor. Use of urinary albumin excretion and estimated glomerular filtration rate / L. Cirillo, P. De Santo, D. Mancini et al. // Arch. Intern. Med. — 2008. — Vol. 168, № 6. — P. 617-624.
16. Clinical and biochemical implications of low thyroid hormone levels (total and free forms) in euthyroid patients with chronic kidney disease / J.J. Carrero, A.R. Qureshi, J. Axelsson et al. // Journal of Internal Medicine. — 2007. — Vol. 262, № 6. — P. 690-701.
17. Correlation between severity of thyroid dysfunction and renal function / J.G. Hollander, R.W. Wulkan, M.J. Mantel, A. Berghout // Clin. Endocrinol (Oxf). — 2005. — Vol. 62. — P. 423-427.
18. Connor А. Renal impairment resulting from hypothy–roidism / A. Connor, J.E. Taylor. // NDT Plus. 2008. — Vol. 6. — P. 440-441.
19. Decrease in renal function associated with hypo–thyroidism / P. Stoyanov, J.A. Navarro, E.M. Herrero, M.J. Sanchez // Nephrologia. — 2010. — Vol. 30, № 3. — P. 378-380.
20. De Zeeuw D. Microalbuminuria as an early marker for cardiovascular disease / D. De Zeeuw, H.H. Parving, R.H. Henning // J. Am. Soc. Nephrol. — 2006. — Vol. 17, № 8. — P. 2100-2105.
21. Praga M. Clinical features and long-term outcome of obesity-associated focal segmental glomerulosclerosis. / M. Praga, E. Hern'andez, E. Morales et al. // Nephrol Dial Transplant. — 2001 — Vol. 16. — P. 1790-1798.
22. Sarafidis P.A. Microalbuminuria and chronic kidney disease as risk factor for cardiovascular disease / P.A. Sarafidis, G.L. Bakris // Nephrol. Dial. Transplant. — 2006. — Vol. 21, № 9. — P. 2366-2374.
23. Shin D.H., Lee M.J., Kim S.J. Preservation of renal function by thyroid hormone replacement therapy in chronic kidney disease patients with subclinical hypothyroidism // The Journal of Clinical Endocrinology and Metabolism. — 2012. — June 20 [Epub ahead of print].
1. Zakharova SM, Savelieva LV. Obesity and hypothyroidism. Obesity and metabolism. 2013; 2:54 -58.
2. Dobronravov VA, Smirnov AV, Kayukov IG. Diverse albuminuria: aspects of clinical value. Nephrology. 2009; 13 (3): 33-38.
3. Zelinska NB. Diagnostic pathologies of the cardiovascular system in patients with hypothyroidism. Clinical Endocrinology and Endocrine Surgery. 2010; 1 (30): 58-60.
4. Kuzmenko Yu Yu. Morphological and functional changes in renal parenchyma of rats with prolonged experimental hypothyroidism. Ukrainian morphological almanac. 2011; 9 (1): 60-62.
5. Kupnovytska IG, Martyniv IV, Myhal LA. Renal effects of atorvastatin. Therapeutic Ukrainian Magazine. 2011; 3: 97-10.
6. Mitchenko OI, Romanov VYu, Logvinenko AO. Cardiovascular risk on the background of thyroid dysfunction. Ukrainian Cardiological Magazine. 2011; 1:21-28.
7. Mukhin NA, Fomin VV, Moisieiev SV. Microalbuminuria – a universal marker of poor prognosis. Clinical medicine. 2008; 11: P.4-9.
8. Orlova MM, Rodionova TI. Diagnostic significance of studying serum concentrations and urinary excretion of some cytokines with manifest hypothyroidism. Cytokines and Inflammation. 2012; 2 (11): 24-28.
9. Pertseva TO, Rokutova MK. Effect of insulin resistance on renal function in patients with abdominal obesity. Medical prospects. 2015; 20 (2): 30-36.
10. Fedorova EYu, Kutyrina IM. Mechanisms of kidney damage progression with obesity. Nephrology and dialysis. 2006; 8 (2): 104-111.
11. Andersen NH, Poulsen SH, Eiskjer H. et al. Decreased left ventricular longitudinal contraction in normotensive and normoalbuminuric patients with Type II diabetes mellitus: a Doppler tissue tracking and strain rate echocardiography study. Clinical Science. 2003; 105: 59-66.
12. Asvold BO, Bjoro T, Nilsen TI, Vatten LJ. Association between blood pressure and serum thyroid-stimulating hormone concentration within the reference range: a population-based study. J. Clin. Endocrinol. Metab. 2007; 92(3): 841-845.
13. Wang Y, Chen X, Song Y. Association between obesity and kidney disease: a systemic review and meta-analysis. Kidney Int. 2008; 73: 19-33.
14. Basu G, Mohapatra A. Interactions between thyroid disorders and kidney disease. Indian J. Endocrinol. Metab. 2012; 16 (2): 204-213.
15. Cirillo L, Santo PDe, Mancini D. et al. Definition of kidney dysfunction as a cardiovascular risk factor. Use of urinary albumin excretion and estimated glomerular filtration rate. Arch. Intern. Med. 2008; 168 (6): 617-624.
16. Carrero J.J, Qureshi A.R, Axelsson J. et al. Clinical and biochemical implications of low thyroid hormone levels (total and free forms) in euthyroid patients with chronic kidney disease. Journal of Internal Medicine. 2007; 262 (6): 690-701.
17. Hollander J.G, Wulkan R.W, Mantel M.J, Berghout A. Correlation between severity of thyroid dysfunction and renal function. Clin. Endocrinol (Oxf). 2005; 62: 423-427.
18. Connor А, Taylor JE. Renal impairment resulting from hypothyroidism. NDT Plus. 2008; 6: 440-441.
19. Stoyanov P, Navarro JA, Herrero E, Gutierrez M.J. Decrease in renal function associated with hypothyroidism. Nephrologia. 2010; 30 (3): 378-380.
20. Zeeuw De D, Parving HH, Henning RH. Microalbuminuria as an early marker for cardiovascular disease. J. Am. Soc. Nephrol. 2006; 17 (8): 2100-2105.
21. Praga M, Hernández E, Morales E. et al. Clinical features and long-term outcome of obesity-associated focal segmental glomerulosclerosis. Nephrol. Dial. Transplant. 2001; 16:1790-1798.
22. Sarafidis PA, Bakris GL. Microalbuminuria and chronic kidney disease as risk factor for cardiovascular disease. Nephrol. Dial. Transplant. 2006; 21(9): 2366-2374.
23. Shin DH, Lee MJ, Kim SJ. Preservation of renal function by thyroid hormone replacement therapy in chronic kidney disease patients with subclinical hypothyroidism.The Journal of Clinical Endocrinology and Metabolism. 2012; 20 [Epub ahead of print].

/100.jpg)
/100_2.jpg)
/101.jpg)