Статтю опубліковано на с. 9-12
Вступ
Дефіцит гормона росту (ДГР), або соматотропна недостатність, може розвинутися внаслідок різних причин у будь-якому віці та призвести до небажаних наслідків. Патологічні зміни в системі «гормон росту/інсуліноподібний фактор росту 1» (ГР/ІФР‑1) можуть призводити до порушень нормальної структури та функції серцево-судинної системи [10]. У загальній популяції дорослих ішемічна хвороба серця супроводжується підвищенням рівнів маркерів запалення, зокрема маркера гострої фази субклінічного запалення С-реактивного білка (С-РБ) [1]. ДГР та ІФР‑1 при виникненні в дорослому віці асоціюються зі зниженням якості життя, порушенням композиції тіла, метаболічними змінами та підвищеним ризиком серцево-судинних захворювань [7]. Дослідження J. Lohr та співавт. свідчать про тісний взаємозв’язок ІФР‑1 та запальних біомаркерів (С-РБ, інтерлейкін‑6, фібриноген) у дорослих з акромегалією та ДГР [13]. Тривале існування недостатності ІФР‑1, а саме виникнення ДГР в ранньому дитинстві та його збереження в постпубертатному віці та в молодих дорослих, може значно прискорити розвиток серцево-судинної патології й різке погіршення якості життя пацієнтів.
Є багато досліджень, що стосуються головним чином вивчення чинників кардіоваскулярного ризику в дорослих пацієнтів, у яких ДГР виник вже в дорослому віці внаслідок травми, пухлини головного мозку, запального/інфекційного процесу. Проте у фаховій літературі відсутні систематизовані дані щодо маркерів кардіоваскулярного ризику в дітей, підлітків і молодих дорослих з соматотропною недостатністю, що виникла в дитячому віці. Також залишаються суперечливими питання взаємозв’язку гормона росту й ростових чинників з маркерами кардіоваскулярного ризику при соматотропній недостатності, що виникла в дитинстві та зберігається в дорослому віці. На сьогодні відкритим залишається питання доцільності продовження/відновлення терапії рекомбінантним гормоном росту (рГР) з метою зниження захворюваності та смертності від серцево-судинної патології [2].
Метою роботи було дослідження рівнів маркера кардіоваскулярного ризику — високочутливого С-реактивного білка в крові пацієнтів з соматотропною недостатністю, що розвинулась у дитинстві та триває в молодому дорослому віці, у динаміці терапії рГР.
Матеріали і методи
ІФР‑1 у плазмі крові визначали за допомогою радіоімунологічного методу з використанням стандартних наборів IRMA IGF‑1 (Immunotech, Чеська Республіка). Вимірювання зросту здійснювали за допомогою стадіометра System Dr. Keller J., масу тіла вимірювали за допомогою електронних ваг Tanita BC587 (Японія). Кістковий вік визначали за атласом W.W. Greulich, S.P. Pyle (1993). Рівень С-РБ у плазмі крові визначали високочутливим латекс-турбідиметричним методом (аналізатор та тест система Cobas 6000 (с501 модуль) (Roche Diagnostics (Швейцарія) з межами визначення від 0,1 до 16 160 мг/л) у динаміці лікування препаратами рГР (до початку лікування, через 3, 6, 9, 12, 24 та 36 міс. на тлі лікування). Препарат рГР вводили в дозі 0,033 мг/кг/добу увечері підшкірно щоденно. Під нашим наглядом перебували 174 пацієнти (із них 124 пацієнти чоловічої статі) віком від 19 до 34 років. Період спостереження становив до 36 місяців. У роботі використані матеріали бази даних Реєстру пацієнтів із соматотропною недостатністю, створеного на базі відділу дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України».
Наявність соматотропної недостатності було встановлено в дитинстві при першому зверненні пацієнта до клініки (проведення двох функціональних фармакологічних тестів з інсуліном, клонідином/L-dopa) та повторно підтверджено при включенні до нашого дослідження. За норму стимульованої секреції ГР при стандартних пробах у дитячому віці вважали рівні, вищі за 10,0 нг/мл; у віці після 18 років — вищі за 3,0 нг/мл. На момент обстеження у більшості хворих КВ був ≥ 15 років. Показники росту становили від 138,0 до 174,0 см, індекс маси тіла — від 19,2 до 33,3.
До включення в наше дослідження пацієнти через різні обставини не отримували препарати рГР або, у виняткових випадках, отримували рГР короткими курсами (не більше ніж 12 місяців) у дитинстві (понад 10 років до включення в дослідження). Значна кількість хворих (71 пацієнт, 40,8 %) отримувала препарати левотироксину в дозі 75–125 мкг/добу; препарати кори надниркових залоз отримували 28 пацієнтів (16,09 %) у дозі 10–15 мг/добу. Серед 174 пацієнтів на момент включення в наше дослідження 30 (28 із них — чоловіки) отримували препарати статевих гормонів.
Статистична обробка результатів досліджень виконувалась із використанням статистичних програм Microsoft Excel із застосуванням методів варіаційної статистики. Результати подано у вигляді середніх значень та їх стандартної похибки (M ± m). Оцінка статистичної вірогідності здійснювалася за параметричним критерієм Стьюдента (t). Різниця в результатах вважалася вірогідною при р < 0,05.
Результати дослідження
У всіх обстежених пацієнтів без винятку встановлено різке зниження викиду ГР (0,05–0,06 нг/мл) при проведенні функціональних проб (з інсуліном/клонідином). Рівень ІФР‑1 був у межах від –25,0 до 90,4 нг/мл; SDS ІФР‑1 становив від –8,46 до –2,76 (при референтних значеннях ± 2 SDS). Рівні білка, що зв’язує ІФР‑1 (ІФР-ЗБ‑3), у крові хворих також були значно зниженими й були в межах від 1,15 до 2,93 мг/л; SDS ІФР-ЗБ‑3 становив від –7,91 до –1,60. Усе це вказує на наявність серйозного дефіциту гормона росту в усіх пацієнтів до початку терапії. На тлі лікування рГР відбувалось поступове збільшення рівнів ІФР‑1 та ІФР-ЗБ‑3; через 6 місяців рівні ІФР‑1 та ІФР-ЗБ‑3 вірогідно перевищували базальний рівень, але не досягали нормальних значень у більшості пацієнтів.
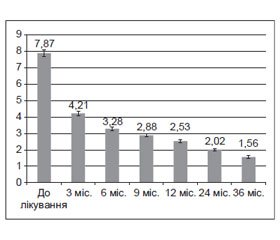
Визначення рівнів С-РБ в плазмі крові пацієнтів, які не отримували лікування препаратами рГР, показало суттєве підвищення рівнів С-РБ у цілому по групі (7,87 ± 0,20 мг/л, n = 174) порівняно з контрольними показниками (2,22 ± 0,13 мг/л, n = 52) та референтними значеннями (< 5,0 мг/л). Індивідуальні коливання становили від 1,25 до 13,22 мг/л.
Протягом лікування рГР відбувалось поступове вірогідне (р < 0,001) зниження показників рівня С-РБ (рис. 1).
Так, суттєве зниження рівнів С-РБ (у середньому в 1,5–2 рази) відзначалося вже через три місяці після початку лікування (4,21 ± 0,13 мг/л, n = 160, р < 0,001). У пацієнтів, що мали переважно дуже високий базальний рівень С-РБ (> 8,0 мг/л), спостерігали 3–4-кратне зниження рівня С-РБ. У цілому після 6 місяців терапії рГР спостерігали відносно стабільні показники С-РБ, що були в межах нормальних значень. Отже, у молодих дорослих з ДГР, що виник у дитинстві, на тлі різкого зниження секреції ГР, ІФР‑1 та ІФР-ЗБ‑3 спостерігається суттєве підвищення рівнів С-РБ у плазмі крові. Замісна терапія препаратами рГР сприяє поступовому підвищенню рівнів ГР, ІФР‑1 і ІФР-ЗБ‑3 та вірогідному зниженню й нормалізації рівнів С-РБ.
Обговорення результатів
Експериментальні та клінічні дані сучасної літератури свідчать про вирішальну роль запалення при виникненні та прогресуванні атеросклерозу [14]. В останні роки поряд з традиційними чинниками ризику розвитку ішемічної хвороби серця, атеросклерозу (вік, артеріальна гіпертензія, високий рівень загального холестерину, паління, обтяжена спадковість) були визначені нові біологічні та генетичні маркери, що допомагають зрозуміти етіопатогенез серцевих захворювань і сформувати групи пацієнтів з високим кардіоваскулярним ризиком [5, 15, 16]. Серед таких маркерів, зокрема, виділяють рівень С-РБ — класичного маркера гострого запалення, що визначають високочутливими методами W. Koenig [11]. Рівень С-РБ надає додаткову інформацію щодо виникнення серцево-судинних захворювань і смертності [9].
Дефіцит ГР, що виникає в дорослому віці, асоціюється з високим рівнем серцево-судинної захворюваності та ранньою смертністю [12]; при лікуванні рГР відбувається вірогідне зниження рівнів аполіпопротеїнів В та С-РБ. У дорослих пацієнтів з дефіцитом ГР виявляються підвищені рівні таких важливих маркерів кардіоваскулярного ризику, як прозапальні цитокіни, С-РБ та адипокіни [2]. Дорослі пацієнти з дефіцитом ГР мають найвищі показники рівня С-РБ, найнижчі показники фіксуються в пацієнтів з активною аденомою гіпофіза [8].
У дитячому віці соматотропна недостатність також може супроводжуватись підвищенням рівня С-РБ у крові та його зниженням при призначенні відповідного лікування рГР [6]. Так, встановлено вірогідне підвищення С-РБ та Р-селектину в підлітків із генетично-обумовленим ДГР без лікування порівняно з лікованими та здоровими особами. Висловлюють припущення, що в підлітків за наявності ДГР незначне запалення маніфестує у вигляді підвищення рівня циркулюючого С-РБ та асоціюється з активацією судинних ендотеліальних клітин [3].
У той же час D. Capalbo та співавт. не виявили змін рівнів С-РБ до та через 2 роки після лікування рГР у дітей з соматотропною недостатністю (середній вік 9,8 ± 3,6 року), однак відзначали наявність інших кардіометаболічних чинників ризику (підвищені рівні тригліцеридів, загального холестерину, холестерину ліпопротеїнів низької щільності, лептину, фібриногену, гомоцистеїну) [7].
Наші дані свідчать про наявність суттєвого порушення вмісту С-РБ у молодих дорослих, які не отримували лікування, з ДГР, що виник у дитячому віці, а саме про різке зниження рівнів С-РБ, а також рівнів ГР, ІФ‑1 та ІФР-ЗБ‑3 за умови тривалого дефіциту гормона росту. Враховуючи дані літератури та наші власні, можна зробити припущення, що при тривалому дефіциті ГР (з дитинства) саме в постпубертатному та молодому дорослому віці маніфестують зміни в рівні С-РБ.
Терапія препаратами рГР позитивно впливає на вміст С-РБ у плазмі крові молодих дорослих: відбувається вірогідне зниження рівня С-РБ вже через 3 місяці після початку терапії. Протягом терапії відбувається поступова нормалізація рівнів ІФР‑1 та С-РБ, що, відповідно, знижує ризик виникнення серцево-судинної патології в осіб молодого віку з ДГР.
Подальше вивчення взаємозв’язку системи ГР/ІФР‑1 із системою запальних біомаркерів є дуже важливим для прогнозування серцево-судинних захворювань, особливо за умов тривалого дефіциту ГР.
Висновки
1. Тривалий, наявний з дитинства дефіцит ендогенного гормона росту в молодих дорослих асоціюється із суттєвим підвищенням рівня С-реактивного білка в плазмі крові пацієнтів, що може значно підсилювати ризик розвитку раннього атеросклерозу та серцево-судинних захворювань у хворих на соматотропну недостатність уже в молодому віці.
2. Терапія препаратами рекомбінантного гормона росту призводить до нормалізації показників С-реактивного білка вже через 3–6 місяців після початку/поновлення терапії.
3. Молоді дорослі із соматотропною недостатністю, що виникла в дитинстві та триває надалі, повинні розглядатися як група пацієнтів з високим ризиком розвитку кардіоваскулярної патології.
4. Визначення рівня високочутливого С-реактивного білка в плазмі крові пацієнтів постпубертатного та молодого дорослого віку з соматотропною недостатністю може бути використане для раннього виявлення в них ризику розвитку серцево-судинної патології.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Список литературы
1. Andreassen M. Concentrations of the acute phase reactants high-sensitive C-reactive protein and YKL‑40 and of interleukin‑6 before and after treatment in patients with acromegaly and growth hormone deficiency / M. Andreassen, H. Vestergaard, L.Ø. Kristensen // Clin. Endocrinol. (Oxf.). — 2007. — Vol. 67, № 6. — P. 909-916.
2. Cardiovascular risk in adult patients with growth hormone (GH) deficiency and following substitution with GH — an update / C. Gazzaruso, M. Gola, I. Karamouzis [et al.] // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99, № 1. — P. 18-29.
3. Circulating levels of high-sensitivity C-reactive protein and soluble markers of vascular endothelial cell activation in growth hormone-deficient adolescents / R. Lanes, H. Marcano, O. Villaroel [et al.] // Horm. Res. — 2008. — Vol. 70, № 4. — P. 230-235.
4. Cluster of cardiometabolic risk factors in children with GH deficiency: a prospective, case-control study / D. Capalbo, G. Mattace Raso, A. Esposito [et al.] // Clin. Endocrinol. (Oxf.). — 2014. — Vol. 80, № 6. — P. 856-862.
5. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women / P.M. Ridker, C.H. Hennekens, J.E. Buring, N. Rifai // N. Engl. J. Med. — 2000. — Vol. 342, № 12. — P. 836-843.
6. Decrease of small dense LDL and lipoprotein-associated phospholipase A2 due to human growth hormone treatment in short children with growth hormone deficiency and small for gestational age status / A. Krebs, T. Kratzin, J. Doerfer [et al.] // J. Pediatr. Endocrinol. Metab. — 2016. — Vol. 29, № 2. — P. 203-208.
7. Discontinuing long-term GH replacement therapy — a randomized, placebo-controlled crossover trial in adult GH deficiency / N.H. Filipsson, E.J. Barbosa, A.G. Nilsson [et al.] // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97, № 9. — P. 3185-3195.
8. Effects of growth hormone deficiency on body composition and biomarkers of cardiovascular risk after definitive therapy for acromegaly / E. Lin, T.L. Wexler, L. Nachtigall [et al.] // Clin. Endocrinol. (Oxf.). — 2012. — Vol. 77, № 3. — P. 430-438.
9. Fonseca F.A. High-sensitivity C-reactive protein and cardiovascular disease across countries and ethnicities / F.A. Fonseca, M.C. Izar // Clinics (Sao Paulo). — 2016. — Vol. 71, № 4. — P. 235-242.
10. GH and the cardiovascular system: an update on a topic at heart / J. Isgaard, M. Arcopinto, K. Karason, A. Cittadini // Endocrine. — 2015. — Vol. 48, № 1. — P. 25-35.
11. Koenig W. High-sensitivity C-reactive protein and atherosclerotic disease: from improved risk prediction to risk-guided therapy / W. Koenig // Int. J. Cardiol. — 2013. — Vol. 168, № 6. — P. 5126-5134.
12. Positive effects of a physiological dose of GH on markers of atherogenesis: a placebo-controlled study in patients with adult-onset GH deficiency / J. Bollerslev, T. Ueland, A.P. Jørgensen [et al.] // Eur. J. Endocrinol. — Vol. 154, № 4. — P. 537-543.
13. Relation of insulin-like growth factor-I and IGF binding protein 3 with markers of inflammation: results of a population-based study / J. Lohr, A. Grotevendt, M. Nauck [et al.] // Clin. Endocrinol. (Oxf.). — 2014. — Vol. 80, № 1. — P. 148-154.
14. Ross R. Atherosclerosis — an inflammatory disease / R. Ross // N. Engl. J. Med. — 1999. — Vol. 340, № 2. — P. 115-126.
15. Rudolf J. Cholesterol, lipoproteins, high-sensitivity C-reactive protein, and other risk factors for atherosclerosis / J. Rudolf, K.B. Lewandrowski // Clin. Lab. Med. — 2014. — Vol. 34, № 1. — P. 113-127.
16. Zakynthinos E. Inflammatory biomarkers in coronary artery disease / E. Zakynthinos, N. Pappa // J. Cardiol. — 2009. — Vol. 53, № 3. — P. 317-333.
/10.jpg)