Международный эндокринологический журнал 4 (76) 2016
Вернуться к номеру
Пути совершенствования профилактики послеродового тиреоидита (обзор и собственные данные)
Авторы: Гончарова О.А. - Харьковская медицинская академия последипломного образования, г. Харьков, Украина
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Бурхливий прогрес фундаментальної імунології, що спостерігається впродовж останніх двох десятиріч, сприяв активації наукових досліджень, що стосуються імуногенезу автоімунних захворювань, до яких належить і післяпологовий тиреоїдит (ПТ). У роботі проаналізовані дані наукових публікацій щодо механізмів ініціації даного процесу, розглянуті особливості перебігу ПТ. Особливу увагу приділено шляхам профілактики ПТ у жінок із чинниками ризику його розвитку. З урахуванням результатів власних досліджень і даних літератури обґрунтовано перспективи використання препаратів селену, який сприяє позитивній динаміці порушень гуморального і клітинного імунітету і є антиоксидантом. Установлений автором селенодефіцит у населення областей України підкреслює актуальність проблеми.
Бурный прогресс фундаментальной иммунологии, наблюдаемый в последние два десятилетия, способствовал активации научных исследований, касающихся иммуногенеза аутоиммунных заболеваний, к которым относится и послеродовой тиреоидит (ПТ). В работе проанализированы данные научных публикаций относительно механизмов инициации данного процесса, рассмотрены особенности течения ПТ. Особое внимание уделено путям профилактики ПТ у женщин с факторами риска его развития. С учетом результатов собственных исследований и данных литературы обоснована перспективость использования препаратов селена, который способствует положительной динамике нарушений гуморального и клеточного иммунитета и является антиоксидантом. Установленный автором селенодефицит у населения ряда областей Украины подчеркивает актуальность проблемы.
The rapid progress of basic immunology observed in the last two decades contributed to the activation of researches on the immunogenesis of autoimmune diseases, which include postpartum thyroiditis (PT). The paper analyzes the data of scientific publications on the mechanisms of initiation of this process, considers the features of PT course. Particular attention is paid to the ways of prevention of PT in women with risk factors for its development. Based on the results of our own studies and literature data, perspectives of using selenium preparations were substantiated, it contributes to the positive dynamics of violations of humoral and cellular immunity and is an antioxidant. Selenium deficiency detected by the author in population of several regions of Ukraine emphasizes the urgency of the problem.
післяпологовий тиреоїдит, дисбаланс між парадигмами Т-хелперів, селеновмісні препарати.
послеродовой тиреоидит, дисбаланс между парадигмами Т-хелперов, селенсодержащие препараты.
postpartum thyroiditis, imbalance between the paradigms of T-helper cells, selenium-containing drugs.
Статья опубликована на с. 112-117
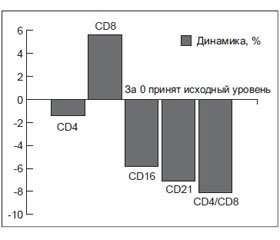
Послеродовой тиреоидит (ПТ) — это синдром транзиторной тиреоидной дисфункции, возникающий в течение первого года после родов и имеющий в основе аутоиммунное воспаление щитовидной железы (ЩЖ). Он также может возникнуть после срыва (прерывания) беременности на 5–20-й неделе гестации [1, 2].
/114.jpg)
/115.jpg)
/115_2.jpg)
1. Marqusee E. Thyroiditis after pregnancy loss / Marqusee E., Hill J.A., Mandel S.J. // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82 (8). — Р. 2455-2457.
2. Krajewski D.A. Thyroid disorders during pregnancy / Krajewski D.A., Burman K.D. // Endocrinol. Metab. Clin. North Am. — 2011. — Vol. 40. — P. 739.
3. Buyon J.P. Autoimmune-associated congenital heart block: demographics, mortality, morbidity and recurrence rates obtained from a national neonatal lupus registry / Buyon J.P., Hiebert R., Copel J., Craft J., Friedman D. et al. // J. Am. Coll. Cardiol. — 1998. — Vol. 31 (7). — P. 1658-1666.
4. Wilder R.L., Hormones, pregnancy, and autoimmune diseases // Annals New York Academy of Science. — 1998. — Vol. 840. — P. 45-50.
5. Olsen N.J., Hormones, pregnancy, and rheumatoid arthritis / Olsen N.J., Kovacs W.J. // J. Gend. Specif. Med. — 2002. — Vol. 5. — P. 28-37.
6. Sykes L. The Th1: Th2 Dichotomy of Pregnancy and Preterm Labour / Sykes L., MacIntyre D.A., Yap X.J., Teoh T.G., Bennett P.R. // Mediators of Inflammation. — 2012. — Vol. (2). — P. 1-12.
7. Saito S. Th1/Th2/Th17 and Regulatory T-Cell Paradigm in Pregnancy / Saito S., Nakashima A., Shima T., Ito M. // Am. J. of Reproductive Immunology. — 2010. — Vol. 3. — P. 601-610.
8. Sakaguchi S. Naturally arising Foxp3-expressing CD25 + CD4 + regulatory T cells in immunological tolerance to self and non-self / Sakaguchi S. // Nat. Immunol. — 2005. — Vol. 6. — P. 345-352.
9. Akbar A.N. The dynamic co-evolution of memory and regulatory CD4+ T cells in the periphery / Akbar A.N., Vukmanovic-Stejic M., Taams L.S., Macallan D.C. // Nat. Rev. Immunol. — 2007. — Vol. 7. — P. 231-237.
10. AluvihareV. R. Regulatory T cells mediate maternal tolerance to the fetus / Aluvihare V.R., Kallikourdis M., Betz A.G. // Nature Immunology. — 2004. — Vol. 5 (3). — P. 266-271.
11. Groër M. Neuroendocrine and immune relationships in postpartum fatigue / Groër M., Davis M., Casey K., Short B., Smith K., Groër S. // MCN Am. J. Matern. Child Nurs. — 2005. — Vol. 30 (2). — P. 133-138.
12. De Groot L. Management of thyroid dysfunction during pregnancy and postpartum: an endocrine society clinical practice guideline / De Groot L., Abalovich M, Alexander E.K., Amino N., Barbour L., Cobin R.H. et al. // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97. — P. 2543-2565.
13. Kanellopoulos-Langevin C. Tolerance of the fetus by the maternal immune system: role of inflammatory mediators at the feto-maternal interface / Kanellopoulos-Langevin C., Caucheteux S.M., Verbeke P., Ojcius D.M. // Reproductive Biology and Endocrinology. — 2003. — Vol. 1. — P. 121.
14. Dealtry G.B., The Th2 cytokine environment of the placenta / Dealtry G.B., O’Farrell M.K., Fernandez N. // International Archives of Allergy and Immunology. — 2000. — Vol. 123 (2). — P. 107-119.
15. Weetman A.P. The immunology of pregnancy / Weetman A.P. // Thyroid. — 1999. — Vol. 9. — P. 643-646.
16. Arck P. Progesterone during pregnancy: endocrine-immune cross talk in mammalian species and the role ofstress / Arck P., Hansen P.J., MulacJericevic B., Piccinni M.P., Szekeres-Bartho // J. Am. J. Reprod. Immunol. — 2007. — Vol. 58. — P. 268-279.
17. Raghupathy R. Progesterone-induced blocking factor (PIBF) modulates cytokine production by lymphocytes from women with recurrent miscarriage or preterm delivery / Raghupathy R., Al-Mutawa E., Al-Azemi M., Makhseed M., Azizieh F., Szekeres-Bartho J. // Journal of Reproductive Immunology. — 2009. — Vol. 80 (1–2). — P. 91-99.
18. Amino N. Postpartum autoimmune thyroid syndrome: a model of aggravation of autoimmune disease / Amino N., Tada H., Hidaka Y. // Thyroid. — 1999. — Vol. 9, № 7. — P. 705-713.
19. Li C.Y. The dynamic changes of serum Thl and Th2 cytokines in postpartum thyroiditis / Li C.Y., Li Y.S., Guan H.X., Fan C.L., Teng Y., Ouyang Y.H., Cong Q., Shan Z.Y., Teng W.P. // Zhonghua NeiKeZaZhi. — 2006. — Vol. 15. — P. 448-451.
20. Piccinni M.P. T cells in normal pregnancy and recurrent pregnancy loss / Piccinni M.P. // Reprod. Biomed. Online. — 2006. — Vol. 13 (6). — P. 840-844.
21. Curry A.E. Mid-pregnancy maternal plasma levels of interleukin 2, 6, and 12, tumor necrosis factor-alpha, interferon-gamma, and granulocyte-macrophage colony-stimulating factor and spontaneous preterm delivery / Curry A.E., Vogel I., Drews C., Schendel D., Skogstrand K., Flanders W.D., Hougaard D., Olsen J., Thorsen P. // Acta Obstet. Gynecol. Scand. — 2007. — Vol. 86 (9). — P. 1103-1110.
22. Gaberšček S. Thyroid physiology and autoimmunity in pregnancy and after delivery / Gaberšček S., Zaletel K. // Expert Rev. Clin. Immunol. — 2011. — Vol. 7 (5). — P. 697-706.
23. Shields BMFive-year follow-up for women with subclinical hypothyroidism in pregnancy / Shields B.M., Knight B.A., Hill A.V., Hattersley A.T., Vaidya B. // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98 (12). — Р. 1941-1945.
24. Балаболкин М.И. Фундаментальная и клиническая тиреоидология: Учеб. пособие / Балаболкин М.И., Клебанова Е.М., Креминская В.М. — М.: Медицина, 2007. — 816 с.
25. Abalovich М. Management of Thyroid Dysfunction during Pregnancy and Postpartum: An Endocrine Society Clinical Practice Guideline / Abalovich М., Amino N., Barbour L.A. et al. // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92 (8 Suppl.). — P. 1-47.
26. Muller A.F. Postpartum Thyroiditis and Autoimmune Thyroiditis in Women of Childbearing Age: Recent Insights and Consequences for Antenatal and Postnatal Care / A.F. Muller, H.A. Drexhage, A. Berghout // Endocrine Reviews. — 2013. — Vol. 22 (5). — P. 605-630.
27. Топалян С.П. Послеродовой тиреоидит / Топалян С.П., Фадеев В.В. // Международный эндокринологический журнал. — 2007. — № 2 (8). — С. 48-55.
28. Фадеев В.В., Лесникова С.В. Аутоиммунные заболевания щитовидной железы и беременность // Пробл. эндокринол. — 2003. — Т. 49, № 2. — С. 23-31.
29. Stagnaro-Green A. Postpartum thyroiditis / Stagnaro-Green A. // Best Pract. Res. Clin. Endocrinol. Metab. — 2004. — Vol. 18. — P. 303-316.
30. Groer M.W. Positive thyroid peroxidase antibody titer is associated with dysphoric moods during pregnancy and postpartum / Groer M.W., Vaughan J.H. // Journal of Obstetric, Gynecologic, Neonatal Nursing. — 2013. — Vol. 42 (1). — E26-E32.
31. Brockington I. Postpartum psychiatric disorders / Brockington I. // Lancet. — 2004. — Vol. 363. — P. 303-10.
32. Harris B., Randomized trial of thyroxine to prevent postnatal depression in thyroid antibody positive women / Harris B., Oretti R., Lazarus J. et al. // Br. J. Psychiatry. — 2002. — Vol. 180. — P. 327-330.
33. Premawardhana L.D.K.E. Thyroid peroxidase antibodies in early pregnancy: utility for prediction of postpartum thyroid dysfunction and implications for screening / Premawardhana L.D.K.E., Parkes A.B., John R. et al. // Thyroid. — 2004. — Vol. 14. — P. 610-615.
34. Stagnaro-Green A. Thyroid disorders in pregnancy / Stagnaro-Green A., Pearce E. // Nat Rev Endocrinol. — 2012. — Vol. 8 (11). — P. 650-658.
35. Premawardhana L.D.K.E. Postpartum thyroiditis and long-term thyroid status: prognostic influence of thyroid peroxidase antibodies and ultrasound echogenicity / Premawardhana L.D.K.E., Parkes A.B., Ammari F., John R., Darke C., Adams H., Lazarus J.H. // J. Clin. Endocrinol. Metab. — 2000. — Vol. 85. — P. 71-75.
36. Мельниченко Г.А. Заболевания щитовидной железы и беременность / Мельниченко Г.А., Фадеев В.В., Дедов И.И. — М., 2003.
37. Stagnaro-Green A. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum / Stagnaro-Green A., Abalovich M., Alexander E., Azizi F., Mestman J., Negro R. et al. // Thyroid. — 2011. — Vol. 21. — P. 1081-1025.
38. Stagnaro-Green A. Approach to the Patient with Postpartum Thyroiditis / Stagnaro-Green A. // J. Clinical. Endocrinology Metab. — 2012. — Vol. 97 (2). — P. 334-342.
39. Gallas P.R.J. Thyroid dysfunction during pregnancy and in the first postpartum year in women with diabetes mellitus type 1 / Gallas P.R.J., Stolk R.P., Bakker K. et al. // Eur. J. Endocrinol. — 2002. — Vol. 147. — P. 443-451.
40. Duntas L.H. Effects of a sixmonth treatment with selenomethionine in patients with autoimmune thyroiditis [Text] / L.H. Duntas, E. Mantzou, D.A. Koutras // Eur. J. Endocrinol. — 2003. — Vol. 148. — P. 389-393.
41. Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations [Text] / R. Gaertner, B.C. Gasnier, J.W. Dietrich [et al.] // J. Clin. Endocrinol. Med. — 2002. — Vol. 8. — P. 1687-1691.
42. Гончарова О.А. Характеристика імунокоригуючого впливу препарату Цефасель у жінок з аутоімунним тиреоїдитом постменопаузального віку / О.А. Гончарова, І.М. Ільїна // Ендокринологія: Мат-ли ІІ Конгресу асоціації ендокринологів України. — 2012. — Т. 17, № 1. — С. 22-23.
43. Гончарова О.А. Селен и щитовидная железа / О.А. Гончарова // Эндокринология. — 2014. — Т. 19 (2). — С. 149-155.
44. Abalovich M. Peripheral parameters of oxidative stressing Graves’ disease: the effects of methimazole and 131 iodine treatments / Abalovich M., Llesuy S., Gutierrez S., Repetto M. // Clin. Endocrinol. (Oxf). — 2003. — Vol. 59 (3). — P. 321-327.
45. Караченцев Ю.И. Обеспеченность селеном отдельных регионов Сумской области и особенности частоты патологии щитовидной железы / Караченцев Ю.И., Гончарова О.А., Подорога Е.И., Ильина И.М., Никишина Л.Е. // Міжнародний ендокринологічний журнал. — 2013. — № 5 (53). — С. 17-20.
46. Караченцев Ю.И. Микроэлементный дисбаланс при диффузно-очаговой форме аутоиммунного тиреоидита / Ю.И. Караченцев, О.А. Гончарова, И.М. Ильина // Международный эндокринологический журнал. — 2014. — № 5 (61). — С. 39-42.
47. Гончарова О.А. Обоснование необходимости выявления селенодефицитных территорий в Украине и организация корригирующих мероприятий / Гончарова О.А. // Проблеми ендокринної патології. — 2016. — № 1. — С. 63-70.
48. Negro R. The influence of selenium supplementation on postpartum thyroid status in pregnant women with thyroid peroxidase autoantibodies / Negro R., Greco G., Mangieri T., Pezzarossa A., Dazzi D., Hassan H. // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 1263-1268.

/113.jpg)
/114_2.jpg)
/115_3.jpg)