На сьогодні однією з головних проблем охорони здоров’я є цереброваскулярна патологія — за поширенням третя причина смертності та одна з головних причин інвалідизації населення в багатьох країнах світу. Як стверджують експерти Всесвітньої організації охорони здоров’я, у майбутньому кількість цереброваскулярних захворювань буде зростати. Це пов’язано зі старінням населення планети та збільшенням поширення в популяції як в розвинутих країнах, так і в країнах, що розвиваються, таких факторів ризику цереброваскулярних захворювань, як артеріальна гіпертензія (АГ), цукровий діабет, гіперхолестеринемія, паління, ожиріння, гіподинамія та ін. Саме неврологічні захворювання знаходяться в переліку найбільш інвалідизуючих, адже втрата або зниження керівної ролі нервової системи над функціями організму може суттєво погіршити життєдіяльність [1].
Величезну проблему становлять ко- та поліморбідні стани, коли в однієї людини, окрім цереброваскулярної, спостерігається декілька патологій, що взаємно обтяжують одна одну та впливають на перебіг основного захворювання й ускладнюють його. У зв’язку з цим зростає навантаження не тільки на невролога, але й на терапевта, ендокринолога та ін. Особливо це стосується лікарів первинної ланки медичної допомоги — сімейних лікарів, адже задачі, що поставила перед ними держава, надзвичайно актуальні й спрямовані на підвищення рівня медичної допомоги населенню при різних захворюваннях для зниження рівня захворюваності, інвалідності та смертності, підвищення якості життя людей. Як відомо, крім стандартних загальноклінічних обстежень, до їх компетенції належить клінічна оцінка стану нервової системи, ендокринних, лор-органів тощо, співпраця на користь пацієнтові зі спеціалістами вузького профілю в протидії поширеності факторів ризику та різних захворювань, метаболічних та інших змін, загроза від яких має тенденцію до зростання [4, 12].
У дослідженні EUROASPIRE-111 було продемонстровано стрімке зростання поширеності метаболічного синдрому (МС) у вигляді ожиріння (до 43 %), при цьому частка центрального (абдомінального) ожиріння збільшилася до 62 %, 71 % осіб мають підвищений артеріальний тиск (АТ) (вище 140–90 мм рт.ст.), у 79 % виявлено підвищений рівень загального холестерину, 39 % осіб мають цукровий діабет, у 53 % рівень глікованого гемоглобіну перевищує 6,5 % [12]. Передумовами зростання поширеності цього синдрому були збільшення кількості спожитих калорій, гіподинамія, хронічний стрес, що, зі свого боку, призводять до виникнення АГ, ожиріння, цукрового діабету. Поширеність МС в різних країнах становить 25–35 % населення, а у віковій категорії понад 60 років зростає до 43,5 % [3, 14, 17].
Для України ця проблема має не менш гостре і медико-соціальне значення. За останні 10 років темпи зростання поширеності цереброваскулярної патології виросли вдвічі [1].
Однією з головних ланок МС є АГ. Головний мозок є органом-мішенню при АГ, атеросклерозі та інших серцево-судинних захворюваннях. Ураження головного мозку при АГ включає цілий комплекс порушень, таких як звивистість сонних та хребтових артерій, стеноз сонних артерій, збільшення товщини комплексу інтима-медіа, дисфункція ендотелію, порушення реактивності судин мозку, гіпертонічна енцефалопатія (ГЕ). Одним із найчастіших порушень є ураження білої речовини головного мозку — лейкоенцефалопатія. Отже, ГЕ (хронічна ішемія мозку) є повільно прогресуючим ураженням головного мозку, обумовленим хронічним порушенням кровопостачання, зв’язаним із тривало існуючою АГ. Приєднання атеросклерозу судин погіршує кровопостачання та призводить до значного погіршення перебігу хвороби [1, 5].
Морфологічний субстрат гіпертонічної хронічної ішемії мозку характеризується дрібновогнищевими та дифузними змінами білої речовини мозку. При ГЕ виявляються зміни артерій мозку на всій їх довжині за типом деструктивних процесів: плазмо- та геморагії, а також некрозів із витонченням інтрацеребральних судин. Усе це створює умови для розвитку мікроаневризм та геморагічних інсультів. Визначаються репаративні та адаптивні процеси, утворюється гіпертрофія м’язової оболонки екстрацеребральних судин із появою гіпертонічних стенозів та подальшою облітерацією їх просвіту. Перекалібровка артерій призводить до редукції мозкового кровотоку в коркових відділах, ішемії мозкової тканини та розвитку ішемічних інсультів [8, 9]. Порушуються структурно-функціональні властивості еритроцитів та тромбоцитів: погіршується їх резистентність до деформації, підвищується гематокрит, збільшується в’язкість крові, що призводить до порушення мікроциркуляції. Патоморфологічні, а також поодинокі клінічні дослідження венозної системи головного мозку при АГ свідчать про виражені порушення, практично до облітерації венозних синусів. Виникають зміни судинної стінки з підвищеною її проникністю, перивентрикулярним набряком, вторинним вдавленням венул, утрудненням венозного відтоку [10, 11].
Окремим предиктором МС, за визначенням IDF (2005), вважаються порушення гіпофізарно-адреналової системи. Як відомо, маркером функціональної активності передньої частки гіпофіза є тиреотропний гормон (ТТГ), зміни рівня якого мають прямий патогенетичний зв’язок із дисфункцією щитоподібної залози (ЩЗ) [15].
За даними Міністерства охорони здоров’я України, ще у 2007 р. понад 3,5 млн осіб в Україні перебували на диспансерному обліку з різною патологією ЩЗ, що має подальшу тенденцію до зростання захворюваності [16].
Поширеність маніфестного гіпотиреозу у світі серед усієї популяції досягла 2 % випадків. У той же час субклінічний гіпотиреоз, що характеризується ізольованим підвищенням ТТГ при нормальних рівнях тиреоїдних гормонів, спостерігається в 10 % жінок (а у віці понад 60 років — у 20 %). У чоловіків незалежно від віку такий стан виявляють лише в 3 % випадків. Значущість цієї патології обумовлена тим, що протягом першого року 5–15 % випадків субклінічного гіпотиреозу переходять у маніфестну форму з розвитком серцево-судинних ускладнень у 70–80 % випадків. Поширеність протилежного функціонального стану ЩЗ — гіпертиреозу становить лише 1–2 % у популяції [13].
Найбільш частими ускладненнями гіпофункції ЩЗ на сьогодні є дисліпідемії, що спостерігаються в 70 % хворих і зумовлюють підвищений ризик раннього розвитку атеросклерозу. Механізмами розвитку дисліпідемії при гіпотиреозі прийнято вважати низку біохімічних змін: порушення структури холестерину (ХС); зниження активності ХС ефірного транспортного білка та печінкової ліпази, що забезпечують приблизно 30 % зворотного транспорту ХС; порушення структури ХС ліпопротеїнів високої щільності і апо-А (збільшення рівня фосфоліпідів і апо-Е), що призводить до порушення зворотного транспорту ХС; зниження кількості та чутливості рецепторів ХС ліпопротеїнів низької щільності (ХС ЛПНЩ) у печінці, що спричиняють зниження печінкової екскреції ХС і в подальшому — підвищення рівнів ХС ЛПНЩ та ХС ліпопротеїнів дуже низької щільності, а також порушення функції ниркових клубочків (зниження швидкості клубочкової фільтрації) та уповільнення швидкості кліренсу ХС ЛПНЩ [3, 13].
Окрім ліпідних механізмів прогресування атеросклерозу, при тиреоїдній недостатності виділяють низку неліпідних предикторів розвитку серцево-судинних ускладнень, таких як діастолічна гіпертензія; збільшення жорсткості стінки артерії; ендотеліальна дисфункція; інсулінорезистентність; підвищення дрібних, щільних ХС ЛПНЩ із великою кількістю апо-В; активація системи згортання крові; підвищення рівня С-реактивного білка; автоімунна агресія (на тлі автоімунного тиреоїдиту), що призводить до можливості тиреоїдних автоантитіл індукувати атеросклероз унаслідок локального запалення [16].
Вплив тиреоїдної дисфункції на параметри центральної та периферичної гемодинаміки, систолічну та діастолічну функцію серця, толерантність до фізичних навантажень, ліпідний спектр у практично здорових осіб вивчався досить широко. Дані про зміни функції серцево-судинної системи в пацієнтів із гіпертонічною хворобою за умов субклінічного гіпо- або гіпертиреозу поодинокі. Традиційно вважається, що АГ, спричинена гіпотиреозом, характеризується переважно підвищенням діастолічного АТ як наслідок вираженого підвищення периферичного опору судин. При цьому частота виявлення діастолічної АГ при гіпотиреозі відрізняється. На противагу цьому для гіпертиреозу характерно підвищення систолічного АТ до 160–170 мм рт.ст. при нормальному або зниженому діастолічному АТ, що призводить до значного підвищення пульсового тиску [6, 7].
Окремий інтерес викликають анатомо-фізіологічні особливості вегетативного забезпечення різних відділів серцево-судинної та ендокринної систем, їх функціональна взаємодія, що заслуговує на подальші дослідження [8].
АГ не є типовим проявом ураження серцево-судинної системи при гіпотиреозі. Більшість дослідників вважають АГ захворюванням, що розвивається незалежно від наявності у хворого гіпотиреозу, однак разом із тим відзначають стабілізацію АГ на тлі проведення адекватної замісної терапії левотироксином [18]. Інші, навпаки, вважають ознакою субклінічного гіпотиреозу наявність діастолічної гіпертензії. Тому це твердження дотепер залишається дискусійним. Розвиток АГ при гіпофункції ЩЗ спричиняють такі фактори, як підвищення периферичного опору судин; підвищення вмісту в тканинах кислих мукополісахаридів, що затримують натрій і воду в інтерстиціальному просторі; зменшення секреції натрійуретичного гормона; підвищення синтезу вазопресину, що в нормі пригнічується тиреоїдними гормонами; зниження активності реніну, підвищення секреції альдостерону (за рахунок збільшення секреції тироліберину); гіперінсулінемія [2].
За даними багатьох досліджень, доведена необхідність вивчення рівня ТТГ у всіх пацієнтів із гіперліпідемією. У клінічних та епідеміологічних дослідженнях давно встановлений зв’язок дисліпідемії та АГ, що розглядається як один із основних факторів ризику розвитку цереброваскулярних захворювань; з іншого боку, до половини осіб із підвищеним рівнем ХС у крові мають систолічну або діастолічну гіпертензію [6, 7].
Таким чином, стан ліпідного спектра крові у хворих на гіпотиреоз та гіпертиреоз стали предметом вивчення в багатьох дослідженнях унаслідок значної асоціації дисліпідемії та серцево-судинних захворювань. Однак ми не зустрічали робіт, в яких був поданий аналіз порушень мозкового кровообігу, а разом із тим і мозкових функцій у осіб із дисфункцією ЩЗ та гіпертонічною хворобою. Усе це обґрунтувало необхідність проведення досліджень у даному напрямку, що й дозволило виявити цілий перелік змін. Зокрема, було визначено, що в пацієнтів із гіпертонічною дисциркуляторною енцефалопатією та супутнім гіпотиреозом на відміну від пацієнтів із ГДЕ без гіпотиреозу церебральні розлади мають більш виражене прогресування, вірогідно частіше (p < 0,05) спостерігається церебростенічний, вестибулоатактичний, мнестичний синдроми [21].
Було виявлено, що наявність ГДЕ та гіпотиреозу проявляється вірогідним (p < 0,05) погіршенням церебрального кровопостачання за рахунок зниження еластичності та підвищення тонусу мозкових судин, зменшення швидкості кровотоку, переважно в вертебробазилярному басейні, а також кореляційної залежності між рівнем ТТГ у крові та пульсовим артеріальним кровонаповненням судин у каротидному та вертебробазилярному басейнах (r = 0,43 та r = 0,37 відповідно) порівняно з показниками хворих без гіпотиреозу(табл. 1) [19, 20].
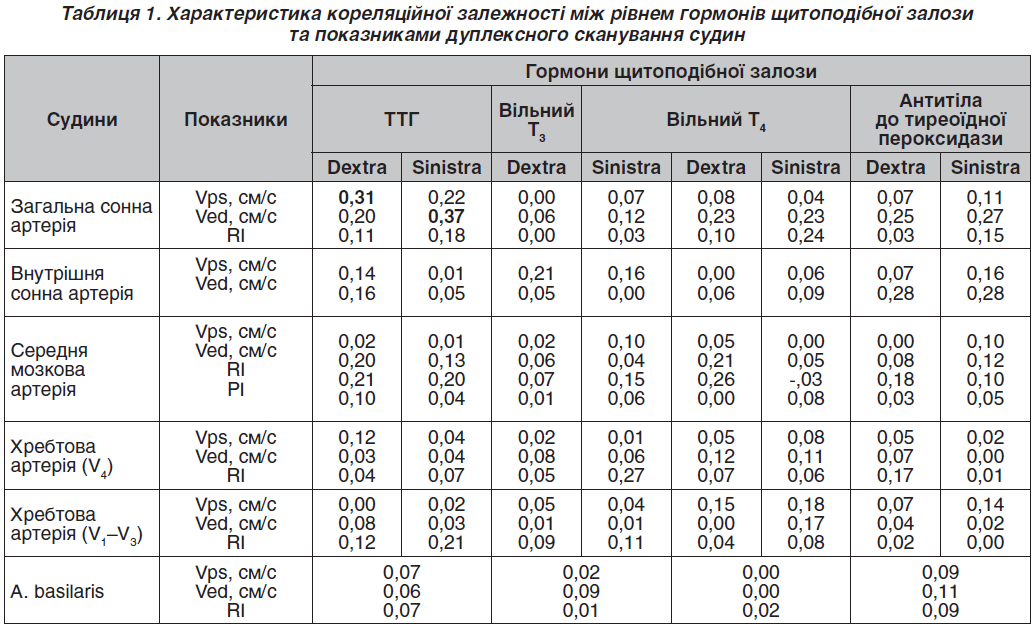
Визначено, що в пацієнтів із гіпертонічною дисциркуляторною енцефалопатією та супутнім гіпотиреозом рівень реактивної та особистісної тривожності за шкалою тривожності Спілбергера — Ханіна є вірогідно вищим (p < 0,001) на відміну від хворих на ГДЕ без гіпотиреозу. Гіпотиреоз сприяє розвитку депресії легкого ступеня. Тому людей із високою особистісною тривожністю слід розглядати як групу ризику щодо розвитку функціональної недостатності ЩЗ, як контингент із низькою стресорезистентністю [21].
У хворих на ГДЕ та супутній гіпотиреоз порушені когнітивні функції: вірогідно переважає деменція легкого ступеня. Серед усіх когнітивних функцій за шкалою MMSE найбільш порушені пам’ять (p < 0,001), здатність сприйняття та виконувати лічильні операції (p < 0,05) (табл. 2) [21].
Наявність гіпотиреозу у хворих на ГДЕ супроводжується погіршенням функціональної активності головного мозку. Так, у хворих із коморбідною патологією (ГДЕ та гіпотиреоз) показники щодо наявності тета-хвиль, подразнення діенцефальних структур, міжпівкульної асиметрії та зниження частоти альфа-ритму в центральній ділянці зліва та потиличній ділянці з обох боків вірогідно (p < 0,05) відрізнялися від показників хворих без гіпотиреозу [21]. Отримані результати є ще одним поштовхом до подальших досліджень та інтерпретацій даних.
Висновки
Поєднання дисциркуляторної енцефалопатії у хворих з АГ та гіпотиреозу є надзвичайно актуальною проблемою, адже особливості патогенезу обтяжують перебіг коморбідної патології, сприяють розвитку гемодинамічних змін, а саме знижується еластичність стінок загальних сонних, середньомозкових та хребцевих артерій, що призводить до гіпоперфузії головного мозку. Порушення функції судинної системи при гіпотиреозі залежить не тільки від стану судин за рахунок атеросклерозу, але також і від переважання дисметаболічних механізмів, які призводять до зниження реактивності судинної стінки, що підтверджується кореляційною залежністю, яка спостерігалася між рівнем гормонів щитоподібної залози та гемодинамічними та клінічними даними. Разом із цим патологія супроводжується зниженням функціональної активності головного мозку, погіршенням когнітивних функцій та підвищенням рівня тривожності та депресії.
У зв’язку з цим раннє виявлення патології та факторів ризику сприятиме ранній діагностиці та розробці комплексних профілактичних та лікувально-реабілітаційних заходів. Зокрема, стануть у пригоді й практичні рекомендації, що логічно випливають із вищесказаного:
1. При виявленні у хворого з гіпертонічною дисциркуляторною енцефалопатією прогресування захворювання при контрольованому рівні артеріального тиску слід запідозрити супутню патологію щитоподібної залози, а саме гіпотиреоз, та направити пацієнта на консультацію до ендокринолога.
2. Хворі з коморбідною патологією (ГДЕ та супутній гіпотиреоз) потребують більш прискіпливого диспансерного нагляду в амбулаторно-поліклінічних умовах із більш частим контролем стану клініко-неврологічних проявів, церебральної гемодинаміки та функціональної активності головного мозку, а також додаткового контролю гормонального статусу в критичні періоди життєдіяльності пацієнта (психічні та фізичні перенавантаження, кліматичні та погодні умови тощо). Такий підхід потребує тісної взаємодії невролога, ендокринолога, терапевта та сімейного лікаря.
3. Нейропсихологічне тестування в поліклінічних умовах є доцільним для скринінгу усім хворим із гіпертонічною дисциркуляторною енцефалопатією для виявлення ранніх когнітивних порушень, що може бути пов’язане із супутньою ендокринною патологією, а саме гіпотиреозом.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Мищенко Т.С., Здесенко И.В., Мищенко В.Н. Новые возможности лечения больных с дисциркуляторной энцефалопатией // Міжнародний неврололічний журнал. — 2015. — № 5(75). — С. 55-64.
2. Ларін О.С., Паньків В.І., Селіваненко М.І., Грачова О.О. Аналіз діяльності ендокринологічної служби України у 2010 році та перспективи розвитку медичної допомоги хворим з ендокринною патологією // Міжнародний ендокринологічний журнал. — 2011. — № 3(35). — С. 23-27.
3. Логвіненко А.О., Мітченко О.І. Особливості ліпідного та вуглеводного обмінів у хворих з метаболічним синдромом та дисфункцією щитоподібної залози // Український кардіологічний журнал. — 2009. — № 4. — С. 53-54.
4. Матюха Л.Ф., Гойда Н.Г., Одринський В.А. та ін. Становлення нової моделі надання первинної медико-санітарної допомоги на засадах сімейної медицини в Україні — не данина моди, а об’єктивна реальність // Сімейна медицина. — 2013. — № 4(48). — С. 157-158.
5. Коваленко О.Є. Вертебрально-базилярний кровообіг та артеріальна гіпертензія: приховані зв’язки // Здоров’я України. — 2013. — № 3(26). — С. 42-45.
6. Velkeniers B., van Meerhaeghe A., Poppe K. et al. Levothyroxine treatment and pregnancy outcome in women with subclinical hypothyroidism undergoing assisted reproduction technologies: systematic review and meta-analysis of RCTs // Hum. Reprod. Update. — 2013. — Vol. 19(3). — P. 251-258.
7. Jonklaas J., Bianco A.C., Bauer A.J. et al. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement // Thyroid. — 2014. — Vol. 24(12). — P. 1670-1751.
8. Nguyen J., Nishimura N., Fetcho R.N. et al. Occlusion of cortical ascending venules causes blood flow decreases, reversals in flow direction, and vessel dilation in upstream capillaries // J. Cereb. Blood Flow Metab. — 2011. — Vol. 31. — P. 2243-2254.
9. Melville N.A. New ATA guidelines stick with levothyroxine for hypothyroidism // Available at: http://www.medscape.com/viewarticle/832682
10. Winther K.H., Cramon P., Watt T. et al. Disease-Specific as Well as Generic Quality of Life Is Widely Impacted in Autoimmune Hypothyroidism and Improves during the First Six Months of Levothyroxine Therapy // PLoS One. — 2016. — Vol. 11(6). — e0156925.
11. Busko M. Optimal levothyroxine doses for hypothyroidism in pregnancy. Available at: http://www.medscape.com/viewarticle/817459
12. EUROASPIRE 111: Lifestyle, Risk factor and therapeutic management in people at risk of developing cardiovascular disease from 12 European regions / A. David Clinical Trial Update 111. — Session № 4480-4481.
13. Surks M.I. Subclinical Thyroid Dysfunction: A Joint Statement on Management from the American Association of Clinical Endocrinologists, the American Thyroid Association, and The Endocrine Society // J. Clin. Endocrin. Metabolism. — 2011. — Vol. 90, №1. — P. 586-587.
14. Chakera A.J., Pearce S.H.S., Vaidya B. Treatment for primary hypothyroidism: current approaches and future possibilities // Drug. Des. Devel. Ther. — 2012. — Vol. 6. — P. 1-11. — Published online 2011, Dec 22. — doi: 10.2147/DDDT.S12894 PMCID: PMC3267517.
15. Балаболкин М.И., Клебанова Е.И. Фундаментальная и клиническая эндокринология. — М., 2007. — 816 с.
16. Gray S.G. Epigenetic treatment of neurological di–sease // Epigenomics. — 2011. — Vol. 3(4). — P. 431-450. — doi: 10.2217/epi.11.67.
17. Паньків В.І. Синдром гіпотиреозу / В.І. Паньків // Международный эндокринологический журнал. — 2012. — № 5(45). — С. 136-148.
18. Паньків В.І. Практична тиреоїдологія / В.І. Паньків. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
19. Коваленко О.Є., Литвин О.В. Особливості церебральної гемодинаміки у хворих на гіпертонічну дисциркуляторну енцефалопатію та супутній гіпотиреоз // Сімейна медицина. — 2013. — № 2. — С. 140-143.
20. Коваленко О.Є., Литвин О.В. Застосування цитиколіну у хворих на гіпертонічну дисциркуляторну енцефалопатію та супутній гіпотиреоз // Міжнародний неврологічний журнал. — 2013. — № 3(57). — С. 111-115.
21. Коваленко О.Є., Литвин О.В. Когнітивні порушення у хворих на гіпертонічну дисциркуляторну енцефалопатію та супутній гіпотиреоз: Збірник наукових праць співробітників НМАПО імені П.Л. Шупика. — 2013. — Вип. 22, Кн. 2. — С. 124-129.



