Резюме
Актуальність. У статті автори наводять результати досліджень особливостей прогресування діабетичної нефропатії (ДН) у хворих на цукровий діабет (ЦД) 2-го типу з ожирінням. Мета. Вивчення особливостей поєднання ожиріння й ураження нирок у хворих на ЦД 2-го типу. Матеріали та методи. Обстежено 50 хворих на ЦД 2-го типу: 17 чоловіків і 33 жінки (середній вік — 58,5 ± 7,0 року), які перебували на стаціонарному лікуванні в Республіканському спеціалізованому науково-практичному центрі ендокринології у 2014–2016 рр. Виділяли групи хворих з ожирінням (індекс маси тіла (ІМТ) > 30 кг/м2) — 38 чоловік (76 %) і без ожиріння (ІМТ < 30 кг/м2) — 12 чоловік (24 %). Критеріями виключення були: виражені стадії ДН (швидкість клубочкової фільтрації (ШКФ) < 60 мл/хв/1,73 м2, протеїнурія понад 2 г/добу), гематурія, гострі серцево-судинні події впродовж останніх 6 місяців, вік понад 70 років. У всіх хворих визначали антропометричні показники, ІМТ, окружність талії (ОТ), окружність стегон (ОС), співвідношення ОТ/ОС. У сироватці крові визначали рівні креатиніну, сечової кислоти, тригліцеридів, ліпопротеїни високої щільності, ліпопротеїни низької щільності, глікований гемоглобін. Ураження нирок оцінювали за рівнем ШКФ і альбумінурії. Результати. У групі хворих на ЦД 2-го типу з ожирінням частота гіперфільтрації, мікроальбумінурії і протеїнурії вища (15; 26,6; 50 % відповідно) на відміну від групи без ожиріння (8; 11; 11 %) при тривалості ЦД понад 5 років. У хворих з ІМТ > 30 кг/м2 порівняно з хворими з ІМТ < 30 кг/м2 частіше констатували більш високі рівні артеріального тиску (артеріальна гіпертензія 3-ї ст. — 13 %), сечової кислоти, частіше відзначали зниження ліпопротеїнів високої щільності (55,1 %). Висновки. У хворих на ЦД 2-го типу з ожирінням виявлена значна поширеність ураження нирок порівняно з хворими без ожиріння, що свідчить про те, що, крім властивих СД специфічних механізмів ураження нирок, ожиріння здійснює свій внесок у розвиток ДН. Вплив ожиріння на функцію нирок реалізується внаслідок посилення гемодинамічних розладів, метаболічних порушень.
В статье авторы приводят результаты исследований особенностей прогрессирования диабетической нефропатии (ДН) у больных сахарным диабетом (СД) 2-го типа с ожирением. Цель. Изучение особенностей сочетания ожирения и поражения почек у больных СД 2-го типа. Материалы и методы. Обследовано 50 больных СД 2-го типа: 17 мужчин и 33 женщины (средний возраст — 58,5 ± 7,0 года), находившихся на стационарном лечении в Республиканском специализированном научно-практическом центре эндокринологии в 2014–2016 гг. Выделяли группы больных с ожирением (индекс массы тела (ИМТ) > 30 кг/м2) — 38 человек (76 %) и без ожирения (ИМТ < 30 кг/м2) — 12 человек (24 %). Критериями исключения были: выраженные стадии ДН (скорость клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2, протеинурия более 2 г/сутки), гематурия, острые сердечно-сосудистые события в течение последних 6 месяцев, возраст старше 70 лет. У всех больных определяли антропометрические показатели, ИМТ, окружность талии (ОТ), окружность бедер (ОБ), соотношение ОТ/ОБ. В сыворотке крови определяли уровни креатинина, мочевой кислоты, триглицеридов, липопротеины высокой плотности, липопротеины низкой плотности, гликированный гемоглобин. Поражение почек оценивали по уровню СКФ и альбуминурии. Результаты. В группе больных СД 2-го типа с ожирением частота гиперфильтрации, микроальбуминурии и протеинурии выше (15; 26,6; 50 % соответственно) в отличие от группы без ожирения (8; 11; 11 %) при длительности СД более 5 лет. У больных с ИМТ > 30 кг/м2 в сравнении с больными с ИМТ < 30 кг/м2 чаще констатировали более высокие уровни артериального давления (артериальная гипертензия 3-й ст. — 13 %), мочевой кислоты, чаще отмечали снижение липопротеинов высокой плотности (55,1 %). Выводы. У больных СД 2-го типа с ожирением выявлена большая распространенность поражения почек по сравнению с больными без ожирения, что свидетельствует о том, что, помимо свойственных СД специфических механизмов поражения почек, ожирение вносит свой собственный вклад в развитие ДН. Влияние ожирения на функцию почек реализуется из-за усиления гемодинамических расстройств, метаболических нарушений.
Background. The article describes the results of the studies of diabetic nephropathy in obese patients with type 2 diabetes mellitus (DM). The aim of the study is to investigate the combination of obesity and renal pathology in patients with type 2 diabetes mellitus. Materials and methods. The study included 50 patients with type 2 DM (17 men and 33 women), mean age 58.5 ± 7.0 years treated at the Republican Specialized Scientific and Practical Centre of Endocrinology in 2014–2016. The patients were randomized into 2 groups: with obesity (BMI > 30 kg/m2; n = 38) and without it (BMI < 30 kg/m2; n = 12). Exclusion criteria included manifested diabetic nephropathy (DN) (glomerular filtration rate (GFR) below 60 ml/min/m2, albuminuria over 2 g/24 hr), hematuria, acute cardiovascular events less than last 6 month ago, age over 70 years. Anthropometric parameters included body mass index, waist and hips circumference, waist-to-height ratio. Serum creatinine, uric acid, triglycerides levels, high-density lipoprotein cholesterol, low-density lipoprotein cholesterol, glycosylated hemoglobin were determined. Severity of renal pathology was estimated by GFR and albumin excretion in urine. Results. Prevalence of hyperfiltration, microalbuminuria and proteinuria increased in patients with obesity (15, 26.6, 50 %, respectively) compared to the patients without obesity (8, 11, 11 %, respectively) when the DM duration over 5 years. Patients with BMI > 30 kg/m2 more frequently presented higher blood pressure levels (arterial hypertension stage 3 in 13 %), enhanced uric acid and reduced low-density lipoprotein cholesterol level (55.1 %) than the patients with BMI < 30 kg/m2. Conclusions. The obese patients with type 2 DM and obesity (BMI > 30 kg/m2) more frequently had renal pathology than non- obese patients. It suggests an independent role of obesity in the development of DN in addition to specific mechanisms of renal pathology in diabetic patients. This effect of obesity is mediated through the enhancement of hemodynamic and metabolic disorders.
Введение
Эпидемия ожирения изначально считалась феноменом западных стран, но в действительности ожирение является международной проблемой. Установлено, что приблизительно 1,5 млрд взрослых людей страдают ожирением или имеют избыточную массу тела [1, 2]. Эпидемия ожирения связана прежде всего с сочетанием малоподвижного образа жизни, что обычно ассоциировано с употреблением высококалорийной пищи и отсутствием физической активности. Возможной причиной является избыток поступающей извне энергии над накопительной способностью белой жировой ткани. При этом липиды накапливаются в эктопических органах [3, 4], что способствует метаболическим расстройствам, таким как резистентность к инсулину и изменение в метаболизме глюкозы и липидов, с развитием гипергликемии, дислипидемии, артериальной гипертензии (АГ), нарушению толерант–ности к глюкозе и атеросклерозу [5, 6]. Более того, центральное ожирение — один из важных факторов риска сахарного диабета (СД) и АГ, которые являются вместе одной из основных причин развития терминальной стадии почечной недостаточности [7].
Жировую ткань рассматривают как сложную динамическую ткань, продуцирующую адипокины, такие как лептин, адипонектин, фактор некроза опухоли α, трансформирующий фактор роста, ангиотензин II [8, 9]. Равновесие между этими адипокинами позволяет жировой ткани регулировать аппетит, всасывание пищи, клиренс глюкозы, расходование энергии. Нарушение баланса при ожирении стимулирует воспалительную среду и приводит к инсулинорезистентности. Заболевания почек в сочетании с ожирением связаны с расстройствами гемодинамики в почках, дисфункцией эндотелия, повреждением базальной мембраны гломерул, мезангиальной экспансией, тубулярной атрофией, интерстициальным фиброзом и прогрессирующим снижением функции почек (увеличением альбуминурии и снижением скорости клубочковой фильтрации (СКФ)), ведущей к терминальной почечной недостаточности [10].
Цель исследования: изучение особенностей поражения почек у больных сахарным диабетом 2-го типа и ожирением.
Материалы и методы
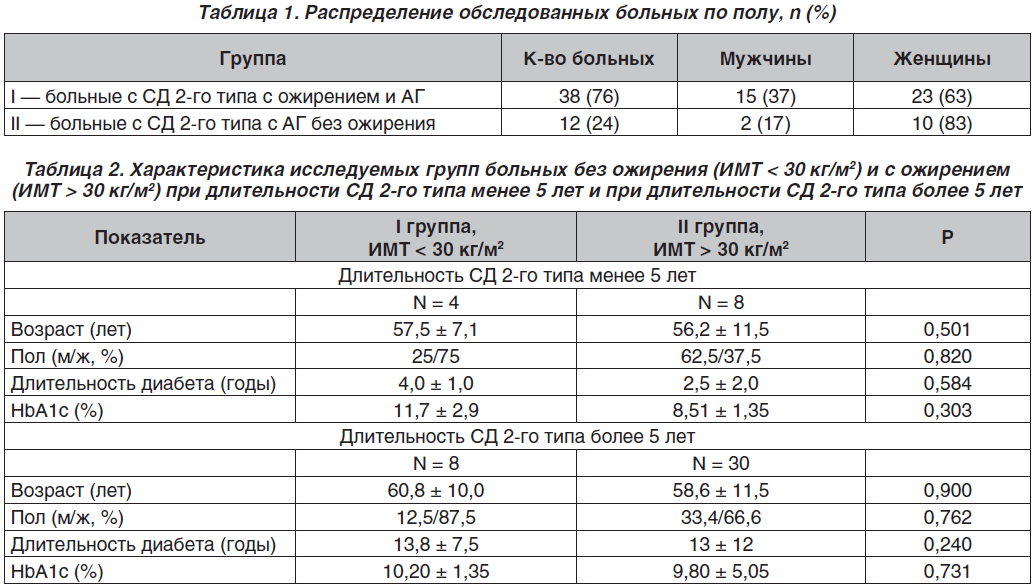
В исследование включено 50 больных с СД 2-го типа в возрасте от 45 до 69 лет (средний возраст — 58,5 ± 7,0 года), находившихся на лечении в Республиканском специализированном научно-практическом центре эндокринологии в 2014–2016 гг. Все обследованные больные разделены на две группы в зависимости от наличия или отсутствия ожирения: I группа — 38 (76 %) больных с СД 2-го типа с ожирением и АГ. Первая группа в зависимости от степени ожирения была разделена на три подгруппы: подгруппа с ожирением I степени (n = 20), II степени (n = 10), III степени (n = 8). Вторую группу составили 12 (24 %) больных с СД 2-го типа без ожирения, но с наличием АГ (табл. 1).
Всем больным проводился спектр исследований, включавший антропометрические (определение индекса массы тела (ИМТ), окружности талии (ОТ), окружности бедер (ОБ), соотношения ОТ/ОБ)), общеклинические, биохимические исследования — общие анализы крови, мочи, липидный спектр, уровень креатинина и мочевой кислоты, гликированный гемоглобин (HbA1c). Статистический анализ проведен с помощью компьютерных программ Microsoft Excel и Statistica 6. Вычислялись средние значения (М), стандарт–ные отклонения средних (m). Достоверность различий в уровне между группами оценивалась по величине доверительного интервала и критерия Стьюдента (р). Различия считали статистически значимыми при р < 0,05.
Результаты
Учитывая длительный бессимптомный период развития СД 2-го типа и значение длительности заболевания как фактора риска развития диабетических осложнений, в частности прогрессирования диабетической нефропатии (ДН), нами отдельно проведен анализ групп больных с длительностью СД менее 5 лет и с длительностью СД более 5 лет.
Исследуемые группы больных с ожирением и без ожирения как при длительности СД менее 5 лет, так и при длительности СД более 5 лет были сопоставимы по возрасту, полу, длительности СД и степени компенсации углеводного обмена (табл. 2).
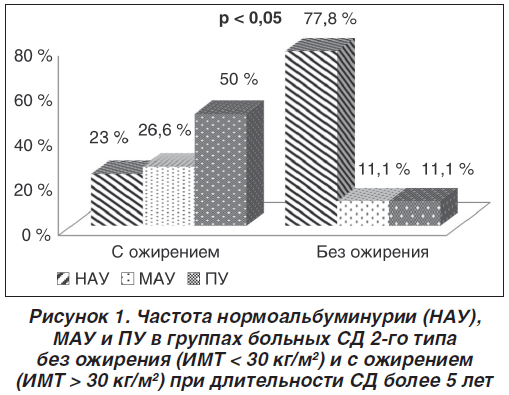
В результате проведенного исследования установлена более высокая частота поражения почек у больных СД 2-го типа с ожирением по сравнению с больными без ожирения при длительности СД более 5 лет: развитие гиперфильтрации (СКФ > 90 мл/мин/1,73 м2), микроальбуминурии (МАУ) и протеинурии (ПУ) у больных с ожирением наблюдалось достоверно чаще.
Гиперфильтрация в группе без ожирения составила 8 %, тогда как в группе с ожирением она составила 15 %. Частота МАУ у больных без ожирения составляла 11,1 %, у больных с ожирением — 26,6 %, частота ПУ — 11,1 и 50 % соответственно (рис. 1).
При длительности СД менее 5 лет частота развития МАУ, ПУ у больных СД с ожирением также была выше и составляла 62 %, тогда как у больных СД без ожирения — 25 %, хотя эти различия не являются достоверными. Мы также наблюдали СКФ у 28 пациентов (12 — без ожирения и 16 — с ожирением) в течение 5 лет (с 2010 по 2015 г.). При этом значительное снижение фильтрационной способности почек отмечалось в группе с ожирением (на 15,7 мл/мин/1,73 м2) в отличие от группы без ожирения (на 11,2 мл/мин/1,73 м2).
Обсуждение
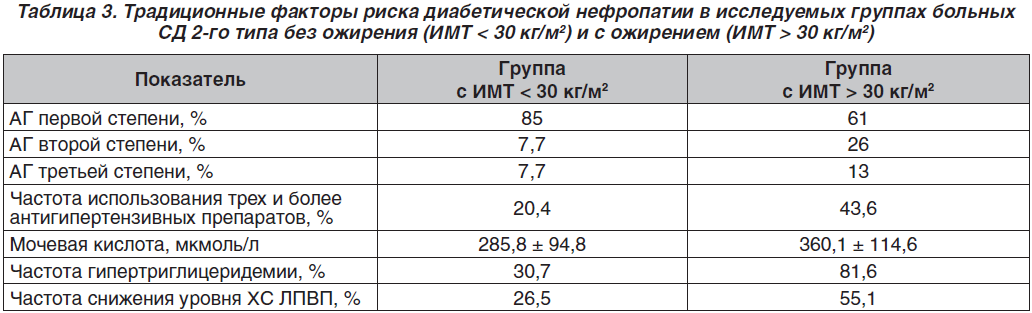
При оценке традиционных факторов риска ДН у больных СД 2-го типа с ожирением при длительности СД более 5 лет выявлены более тяжелые системные гемодинамические расстройства: чаще определялась АГ третьей степени и в большем проценте случаев появлялась необходимость использования трех и более антигипертензивных препаратов.
Кроме того, у больных с ожирением были более выражены расстройства пуринового и липидного обменов: повышение уровня мочевой кислоты в сыворотке крови, снижение холестерина липопротеинов высокой плотности (ХС ЛПВП) (табл. 3).
При проведении многофакторного регрессионного анализа в исходную модель включали факторы, обладающие влиянием на риск развития МАУ и ПУ: возраст, пол, длительность СД, уровень HbА1с, антропометрические показатели (ИМТ, ОТ, ОБ), артериальное давление (систолическое (САД) и диастолическое), длительность АГ, уровень мочевой кислоты, показатели липидного спектра (триглицериды, ХС липопротеинов низкой плотности, ХС ЛПВП).
Наиболее значимыми оказались следующие факторы: уровень HbА1с (р = 0,001), ОТ (р = 0,0027) и САД (р = 0,014), что, по-видимому, отражает тесную связь ожирения с декомпенсацией СД 2-го типа и развитием систолической АГ.
Учитывая, что окружность талии (показатель массы висцерального жира) является самостоятельным фактором риска развития МАУ, ПУ, можно предположить, что неблагоприятное влияние ожирения на функцию почек может реализовываться не только через нарушения углеводного обмена и гемодинамические механизмы, но, вероятно, существуют и иные факторы, ассоциированные с ожирением, способствующие развитию ДН.
Выводы
1. При СД 2-го типа абдоминальное ожирение наряду с нарушениями углеводного обмена и систолической артериальной гипертензией является самостоятельным фактором риска поражения почек (окружность талии, р = 0,0027; гликированный гемоглобин, р = 0,001; САД, р = 0,014). В группе больных СД 2-го типа с ожирением частота гиперфильтрации, микроальбуминурии и протеинурии выше по сравнению с больными СД 2-го типа без ожирения.
2. Более частое поражение почек у больных СД 2-го типа с ожирением обусловлено ассоциированными с ожирением нарушениями липидного и пуринового обменов, а также нарушениями системной гемодинамики (артериальной гипертензией) и внутрипочечной гемодинамики (гиперфильтрацией).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. International Obesity Task force. Obesity: the Global Epidemic. International Association for the Study of Obesity [cited 2012 August 1]. Available from: http://www.iaso.org/ iotf/obesity/obesitytheglobalepidemic/.
2. Samuel V.T., Shulman G.I. Mechanisms for insulin resistance: common threads and missing links // Cell. — 2012. — Vol. 148(5). — P. 852-871.
3. Bruce K.D., Hanson M.A. The developmental origins, mechanisms, and implications of metabolic syndrome // J. Nutr. — 2010. — Vol. 140(3). — P. 648-652.
4. Collins A.J. et al. US Renal Data System 2010 Annual Data Report // Am. J. Kidney Dis. — 2011. — Vol. 57(Suppl. 1). — P. 1-526.
5. Cao H. Adipocytokines in obesity and metabolic disease // J. Endocrinol. — 2014. — Vol. 220(2). — P. 47-59.
6. Sikaris K.A. The clinical biochemistry of obesity-more than skin deep // Heart Lung. Circ. — 2007. — Vol. 16(Suppl. 3). — P. 45-50.
7. Chagnac A. et al. Glomerular hemodynamics in severe obesity // Am. J. Physiol. Renal. Physiol. — 2000. — Vol. 278(5). — P. 17-22.
8. National Kidney Foundation. KDOQI clinical practice guideline for diabetes and CKD: 2012 update // Am. J. Kidney Dis. — 2012. — Vol. 60. — P. 850-886.
9. De Boer I.H., Rue T.C., Cleary P.A. et al. Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria: An analysis of the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications cohort // Arch. Intern. Med. — 2011. — Vol. 171. — P. 412-420.
10. Ruzicka M., Quinn R.R., McFarlane P. et al. Canadian Society of Nephrology commentary on the 2012 KDIGO clinical practice guideline for the management of blood pressure in CKD // Am. J. Kidney Dis. — 2014. — Vol. 63(6). — P. 869-887.a