Вступ
На сьогодні у світі поширеність цукрового діабету (ЦД) досягає масштабів епідемії, щорічна летальність від його ускладнень становить ~4,6 млн осіб працездатного віку. За даними IDF (2015), у світі налічується 415 млн хворих на ЦД, тоді як ще 10 років тому експерти до 2025 р. прогнозували тільки 330 млн. Близько 2 % усього населення України страждає від даної недуги, але реальна кількість хворих значно (у 2–3 рази) вища [11, 20]. Варіабельність показників вуглеводного обміну, стан хронічної гіперглікемії вважають провідними чинниками розвитку й прогресування мікро- і макроваскулярних ускладнень ЦД, а результати великих епідеміологічних досліджень свідчать про потребу інтенсифікації глікемічного контролю з метою їх профілактики [2, 12, 22]. На жаль, недостатню увагу приділяють лікарі-клініцисти ще одному хронічному ускладненню ЦД — діабетичному гастропарезу (ДГ), що зумовлено тяжкістю ранньої діагностики у зв’язку з його перебігом під масками інших нозологічних одиниць. На сьогодні основними видами моторно-евакуаторної (М-Е) діяльності шлунка у хворих на ЦД 2-го типу, що обговорюються й найчастіше виявляються в клінічній практиці, є уповільнення шлункової евакуації за відсутності механічної перешкоди з багатогранністю клінічних проявів. До них належать: відчуття переповнення, швидкого насичення після прийому їжі, важкість/дискомфорт в епігастральній ділянці, для тяжкого перебігу характерне зригування, блювання фонтаном, що не приносить полегшення, різке схуднення пацієнта, лабільність перебігу (часті гіпоглікемії, що змінюються гіперглікемією) основного захворювання. Відсутні фактичні дані про поширеність гастропарезу серед хворих на ЦД 2-го типу, проте, за даними наукових джерел, ДГ не є рідкісним явищем, оскільки його частота перебуває у межах від 25 до 70 % випадків у популяції [1, 3, 5, 8, 28]. Слід зазначити, що існують суперечливі думки науковців щодо добових коливань глюкози в крові у хворих на ЦД 2-го типу й розвитку ускладнень зі сторони шлунково-кишкового тракту як одного з проявів тяжких автономних порушень. Проте більшість науковців доводять багатокомпонентність патогенетичних механізмів розвитку дисмоторики шлунка у хворих на ЦД, але найбільш вагомим фактором виникнення порушень вважають стан хронічної гіперглікемії [6, 21, 23].
У світі проводиться постійний пошук нових технологій боротьби із станом хронічної гіперглікемії, тому неупинно зростає кількість нових класів антидіабетичних засобів. Традиційні методи контролю вуглеводного обміну, такі як зміна способу життя, раціональна дієтотерапія, дозоване фізичне навантаження, застосування препаратів із групи похідних сульфонілсечовини (ПСС) і метформіну, за короткий період часу стають малоефективними. На сьогодні сучасна фармакотерапія ЦД 2-го типу повинна бути спрямована не тільки на досягнення цільових рівнів вуглеводного обміну, а й на забезпечення адекватної якості життя пацієнтів і зниження кількості летальних випадків. Одним із провідних чинників лабільного перебігу й поганої компенсації ЦД 2-го типу слід вважати уповільнення М-ЕФ шлунка, що запускає хибне коло: тяжкі порушення антродуоденальної акомодації сприяють декомпенсації вуглеводного обміну, а гіперглікемія викликає брадигастрію [7, 10, 14]. У свою чергу, навіть безсимптомне уповільнення моторики шлунка може сприяти зміні часу початку, піку дії цукрознижувальних засобів і розвитку «шлункової» постпрандіальної гіпоглікемії. Епізоди гіпоглікемії при ЦД 2-го типу більш небезпечні, ніж у хворих на ЦД 1-го типу, оскільки потужний стресовий фактор (низький цукор крові) провокує розвиток серцево-судинних катастроф, що викликають раптову смерть.
За даними літератури виявлено низку дискусійних питань про можливість використання різних класів антидіабетичних препаратів при дисмоториці шлунка [18, 25, 26], тому що деякі з них за механізмом дії можуть навіть потенціювати виникнення симптомів уповільнення М-ЕФ шлунка. Іноді в пацієнтів, які отримують метформін, інгібітори дипептидилпептидази-4 (ДПП-4), аналоги глюкагоноподібного пептиду 1 (ГПП-1), виявляють небажані ефекти зі сторони шлунково-кишкового тракту, зокрема нудоту, діарею, блювання, метеоризм і біль у животі, що слід вважати причинами відмови хворих від прийому цих лікарських засобів. Недостатньо вивчені патогенетичні властивості глікемічного контролю в постпрандіальний період, його вплив на стан М-ЕФ шлунка у хворих на ЦД 2-го типу, але, без сумніву, досягнення компенсації вуглеводного метаболізму сприяє зменшенню клінічних проявів ДГ. На жаль, на основі даних доказової медицини не розроблені принципи корекції вуглеводного метаболізму в цієї групи пацієнтів.
Тому метою дослідження було визначення впливу М-ЕФ шлунка на ризик розвитку гіпоглікемічних станів у хворих на цукровий діабет 2-го типу.
Матеріали та методи
Після підписання інформованої згоди на участь у дослідженні пацієнти отримали друковані матеріали з інформацією про методику обстеження та індивідуальний алгоритм лікування. Згідно з даними наукової літератури [4, 16, 19, 29] був розроблений покроковий діагностичний алгоритм. Комплексне обстеження хворих на ЦД 2-го типу включало анкетування, загальноклінічне й лабораторно-інструментальне дослідження. Усім обстеженим до й після лікування за результатами анкетувань (PAGI-SYM — Patient Assessment of Gastrointestinal Disorders Symptom Severity Index, GCSI — Gastroparesis Cardinal Symptom Index) визначено ступінь тяжкості гастроінтестинальних проявів ДГ, а частоту виникнення й тяжкість симптомів низького вмісту цукру крові визначено за шкалами опитувальника страху гіпоглікемій (HFS — Hypoglycemia fear scale). За допомогою глюкозооксидантного методу на автоматичному аналізаторі АГКМ-01 «Кверті-Мед» (Україна) вимірювали глюкозу крові, рівень глікованого гемоглобіну (HbA1с) визначали методом високочутливої іонообмінної рідинної хроматографії. У діагностиці ЦД 2-го типу та оцінці ступеня компенсації вуглеводного обміну керувались національними стандартами (Накази МОЗ України № 574 від 05.08.2009, № 1118 від 21.12.2012 «Уніфіковані клінічні протоколи первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги хворим на цукровий діабет 2 типу»). Визначення М-ЕФ шлунка проводилося за допомогою 13С-октаноєвого дихального тесту (13С-ОДТ). Аналіз дихальних проб виконувався за допомогою інфрачервоної спектроскопічної системи IRIS із визначенням концентрації 13СО2. Оцінку результатів проведено за часом напіввиведення (Т1/2) вмісту шлунка у дванадцятипалу кишку: нормальний показник Т1/2 становить 40–75 хвилин, прискорення моторики — якщо Т1/2 менше від 40 хвилин, легкий ступінь сповільнення моторики — 75–95 хвилин, уповільнення середнього ступеня — від 96 до 115 хвилин, уповільнення тяжкого ступеня — понад 115 хвилин.
Критеріями виключення з дослідження були наявність в анамнезі непереносимості чи алергічні реакції на засоби цукрознижувальної терапії; тяжкі захворювання шлунково-кишкового тракту, нирок; хронічні захворювання серцево-судинної системи з розвитком недостатності кровообігу вище від II функціонального класу за класифікацією NYHA; вагітність, лактація; онкологічні захворювання; системні захворювання сполучної тканини; хронічні захворювання з алергічним компонентом у генезі (бронхіальна астма та ін.); психічні хвороби; гостре запальне та/або загострення хронічного запального захворювання; інші ендокринні захворювання.
На момент скринінгу нами обстежено 112 хворих на ЦД 2-го типу віком від 35 до 76 років, серед них 62 чоловіки і 50 жінок. Пацієнтів розподілили на 4 групи залежно від виду цукрознижувальної терапії: група 1 — похідні сульфонілсечовини (ПСС) + метформін; група 2 — ПСС + метформін + інгібітор ДПП–4/аналог ГПП–1/інгібітори натрій-глюкозного котранспортера 2-го типу (НЗКТГ-2)/інгібітори α-глюкозидази; група 3 — інсулінотерапія; група 4 — інсулінотерапія + ПСС + метформін/інсулінотерапія + метформін. Протягом усього періоду дослідження за даними щоденника самоконтролю виконувалося титрування дози цукрознижувальних препаратів за індивідуальними схемами, що не перевищували максимальне дозування з урахуванням цільових рівнів HbA1с. Визначення ризику гіпоглікемій відіграє важливу роль у виборі препаратів цукрознижуючої терапії другої лінії. При використанні інгібіторів ДПП-4, α-глюкозидази, НЗКТГ-2, аналогів ГПП-1 наявний мінімальний ризик виникнення епізодів низького цукру крові, тоді як при застосуванні інсулінотерапії і/або ПСС частота випадків гіпоглікемій значно зростає, що свідчить про хвилеподібні коливання показників цукру крові. Для виявлення ефективності терапії визначали глікемічний профіль із 4–6 визначеннями рівня глюкози капілярної крові. Детально результати скринінгового огляду хворих на ЦД 2-го типу відображено в табл. 1.
Як видно з табл. 1, між групами за віком, тривалістю ЦД 2-го типу, основними показниками фізикального огляду (ІМТ, ОТ, вегетативний індекс Кердо (ВІК), неврологічний дисфункціональний рахунок (НДР)), хронічними ускладненнями захворювання, показниками вуглеводного (HbA1с, глюкоза натще, постпрандіальна глікемія) обміну вірогідної різниці не було, тобто групи були порівнянними. А також при ретельному вивченні анамнезу захворювання, супутньої патології за результатами анкетування у всіх групах обстежених виявлено хворих із підозрою на ДГ. На рис. 1 зображено відсотковий розподіл пацієнтів у досліджуваних групах з ознаками уповільнення М-ЕФ шлунка і без них.
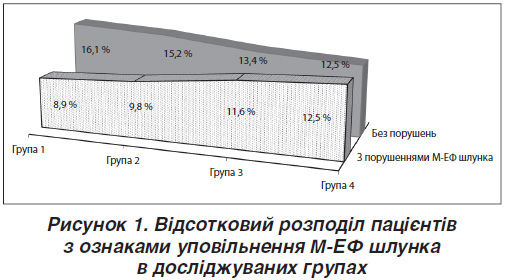
Слід зазначити, що більшу кількість хворих із симптомами брадигастрії, що підтверджені за результатами 13С-ОДТ, виявлено в третій і четвертій групах — 13 (11,6 %) та 14 (12,5 %) пацієнтів відповідно. Хворі цих груп частіше фіксували випадки низького цукру крові, що підтверджено результатами анкет-опитувальників HFS-Total: найвища сума балів — 22,00 ± 2,68 бала у хворих третьої групи і 21,61 ± 2,12 бала у пацієнтів четвертої групи. Зростання ризику виникнення епізодів гіпоглікемій спровоковано низкою факторів: безсимптомним перебігом уповільнення М-ЕФ шлунка, тривалістю ЦД 2-го типу понад 10 років, прогресуванням проявів полінейропатії (НДР), а також недотриманням принципів інсулінотерапії.
Наступний етап дослідження — розподіл хворих на ЦД 2-го типу на дві групи: І група (n = 64) — пацієнти без ознак дисмоторики шлунка, ІІ група (n = 48) — із симптомами ДГ.
Враховуючи результати метааналізу наукових досліджень [13, 28] і дані доказової медицини про відсутність дозозалежного ефекту метформіну на показник HbA1с, для запобігання розвитку небажаних явищ зі сторони шлунково-кишкового тракту хворим ІІ групи проведено титрування доз препаратів з групи бігуанідів, інгібіторів ДПП–4/аналогів ГПП–1 з максимального до терапевтично ефективного дозування.
Для статистичної обробки матеріалу на всіх етапах дослідження використовували cтворені бази даних у системах Microsoft Excel, статистичний розрахунок результатів описової статистики (відносні величини, їх похибки, t-тест), порівняння даних між групами виконували за допомогою програми SPSS, версія 23 для Windows. Якісні показники визначені у вигляді абсолютних частот і часток у групі у відсотках. Взаємозв’язок між показниками встановлювали за допомогою коефіцієнта кореляції за методом квадратів (метод Пірсона). Розбіжності між показниками вважали вірогідними при рівні р < 0,05.
Для всіх пацієнтів дотримано заходів щодо безпеки здоров’я, прав пацієнта, людської гідності та морально-етичних норм відповідно до принципів Гельсінкської декларації прав людини, Конвенції Ради Європи про права людини й біомедицину та відповідних законів України.
Результати
Серед хворих на ЦД 2-го типу у 42,9 % діагностовано уповільнення М-ЕФ шлунка, з них у 16 (14,3 %) пацієнтів спостерігалися легкі ознаки ДГ, у 21 (18,8 %) особи наявні прояви середнього ступеня тяжкості дисмоторики шлунка, і тільки в 11 (9,8 %) хворих — тяжкі симптоми брадигастрії.
Одним із основних факторів розвитку ДГ слід також вважати ступінь тяжкості НДР, наявний сильний прямий зв’язок (r = 0,54, p = 0,001) між результатами НДР і ступенем уповільнення М-ЕФ шлунка за висновками 13С-ОДТ. Отже, даний факт свідчить, що чим тяжчі прояви діабетичної полінейропатії, тим частіше виявляють тяжкі симптоми автономної нейропатії шлунка, що підтверджено в інших наукових працях [9, 14, 15]. Виявлено прямий кореляційний зв’язок між сумою балів шкал опитувальників PAGI-SYM і GCSI та результатами 13С-ОДТ (r = 0,67 і r = 0,63, p = 0,001 відповідно). Виявлено кореляційну залежність між сумою балів опитувальника HFS-Total і результатами 13С-ОДТ (r = 0,54, p = 0,001). Цей факт свідчить, що уповільнена М-ЕФ шлунка викликає розвиток симптомів «шлункової» постпрандіальної гіпоглікемії. Отже, даний патогенетичний механізм свідчить про безпосередній вплив брадигастрії на виникнення лабільного перебігу ЦД 2-го типу із частою зміною епізодів гіпо-/гіперглікемій.
Слід зазначити, що показники вуглеводного обміну, зокрема рівень HbA1с, глікемія натще, не впливають на ступінь уповільнення М-ЕФ шлунка у хворих на ЦД 2-го типу, а отримані результати заперечують висновки низки наукових праць [12, 19, 27]. Відомо, що основним показником стану компенсації вуглеводного обміну є рівень HbA1с, але він не відображає варіабельність глікемії протягом дня, тому найбільшу інформативність при уповільненні М-ЕФ шлунка мають показники глюкози крові в постпрандіальний період, а також частота виникнення й тяжкість симптомів гіпоглікемії.
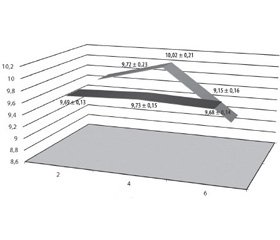
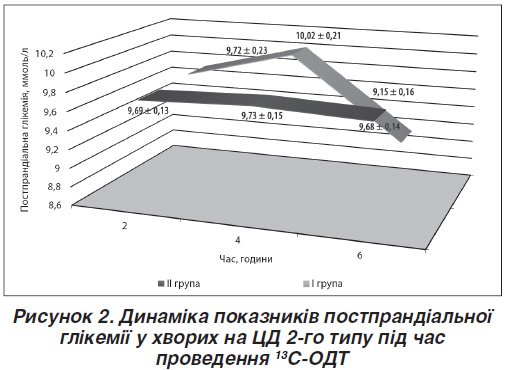
Під час виконання 13С-ОДТ досліджуваним хворим І і ІІ груп визначали кожні 2 години (2 год, 4 год, 6 год) показники постпрандіальної глікемії, дані відображені на рис. 2.
У досліджуваних ІІ групи спостерігається більш полога крива постпрандіальної глікемії, ніж у пацієнтів І групи, що, ймовірно, пов’язано з більш пізнім надходженням вуглеводів у кишечник внаслідок уповільнення М-ЕФ шлунка. Визначено частоту виникнення епізодів «шлункової» постпрандіальної гіпоглікемії під час виконання 13С-ОДТ: тільки в 4,5 % (5 осіб) хворих на ЦД 2-го типу з ознаками уповільнення М-ЕФ шлунка, які були розподілені до третьої і четвертої груп, діагностовано підтверджені лабораторно симптоми низького цукру крові. Епізоди гіпоглікемії корегували прийомом двох легкозасвоюваних хлібних одиниць, які не впливали на результат дихального тесту.
Обговорення
Ще у 1956 р. Stunkard зауважив, що при внутрішньовенному введенні глюкози здоровим особам припиняється «голодна» перистальтика шлунка. Вчені стверджують, що навіть гіперглікемія ~8 ммоль/л у хворих на ЦД знижує частоту антральних скорочень, викликає слабкі контрактури проксимального відділу шлунка, уповільнює антральні скорочення, що пригнічують активність міграційного рухового комплексу [6, 12]. У наукових працях P.-H.H.Tseng et al. і A.E. Bharucha et al. обґрунтований патогенетичний зв’язок між функціональною активністю шлунка і станом компенсації вуглеводного обміну, а внаслідок нормалізації метаболізму глюкози зменшується пошкодження нейронів і не прогресують симптоми ДГ [13, 27]. Відомо, що за результатами проспективного дослідження (UK Hypo Group, Великобританія, 2007 р.) із збільшенням тривалості ЦД зростає частота виникнення тяжких гіпоглікемій, які слід вважати провідними чинниками раптової кардіоваскулярної смерті, а також неврологічного й травматологічного ризику. Тому при застосуванні різноманітних схем цукрознижувальної терапії слід враховувати, що, зокрема, препарати ПСС та інсулін порівняно з метформіном спричиняють випадки гіпоглікемії у хворих на ЦД 2-го типу у 4 рази частіше. Це призводить до збільшення на 26 % кількості випадків серцево-судинної смерті в цієї групи пацієнтів [6, 17, 23, 24].
У пацієнтів з ознаками ДГ частіше фіксували випадки низького цукру крові, що підтверджено результатами анкет-опитувальників HFS-Total: найвища сума балів у хворих третьої групи — 33,33 ± 2,86 бала, у пацієнтів четвертої групи — 31,50 ± 2,32 бала, а також в обстежених першої групи — 31,00 ± 2,98 бала. Зростання ризику виникнення епізодів гіпоглікемій спровоковане багатьма факторами: безсимптомним перебігом уповільнення М-ЕФ шлунка, тривалістю ЦД 2-го типу понад 10 років, прогресуванням проявів полінейропатії (НДР), а також недотриманням принципів інсулінотерапії. Вірогідний позитивний результат в цих групах пацієнтів досягнуто тільки через 6 місяців.
Отже, у хворих із лабільним перебігом ЦД 2-го типу для уникнення епізодів гіпоглікемій і для забезпечення ефективного контролю вуглеводного обміну з метою ранньої діагностики безсимптомних проявів гастропарезу слід удосконалити діагностичний алгоритм обстежень: анкетування (PAGI-SYM, GCSI, HFS-Total) і 13С-ОДТ.
Висновки
1. Виявлено збільшення частоти «шлункових» постпрандіальних гіпоглікемій (HFS-Total) у хворих на ЦД 2-го типу з ознаками уповільнення М-ЕФ шлунка, які отримують інсулінотерапію.
2. З метою запобігання виникненню постпрандіальних гіпоглікемій хворим на ЦД 2-го типу для ранньої діагностики гастропарезу перед використанням інсулінотерапії слід визначити М-ЕФ шлунка за допомогою анкетування (PAGI-SYM, GCSI) і 13С-ОДТ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Ахмадуллина Г.И. Системные нарушения, коморбидная патология и функция желудка у больных сахарным диабетом 2 типа / Г.И. Ахмадуллина, И.А Курникова, Г.М. Нуруллина // Международный научно-исследовательский журнал — 2016. — № 5(47). — С. 125-132. doi: 10.18454/IRJ.2016.47.096.
2. Гарбузова М.А. Контроль гликемии — залог успешной профилактики осложнений при сахарном диабете / М.А. Гарбузова // Cons. Med. — 2014. — № 4. — С. 27-30.
3. Звягінцева T.Д. Функціональні захворювання органів травлення та їх поєднання у світлі сучасних уявлень: від патогенезу до лікування / T.Д. Звягінцева, А.І. Чернобай // Сучасна гастроентерологія. — 2015. — № 3(83). —
С. 61-72.
4. Исмаилов С.И. Роль опросников в оценке качества жизни пациентов с сахарным диабетом (обзор литературы) / С.И. Исмаилов, С.У. Муминова // Международный эндокринологический журнал. — 2016. — № 2(74). —
С. 152-157.
5. Кравчун Н.А. Диабетическая гастроэнтеропатия / Н.А. Кравчун // Здоров’я України. — 2011. — № 1(15). — С. 44.
6. Ляшук П.М. Гіпоглікемічний синдром / П.М. Ляшук, І.В. Сходницький, Р.П. Ляшук, Н.І. Станкова // Буковинський медичний вісник. — 2014. — № 1(69). — С. 159-163.
7. Таюпова Д.С. Функциональная диагностика гастроинтестинальной формы диабетической автономной нейропатии / Д.С. Таюпова, Ф.В. Валеева, Л.Р. Сафиуллина, Л.Т. Бареева // Инновационные технологии в медицине. — 2015. — № 4(89). — С. 136-138.
8. Ткач С.М. Функциональная диспепсия в свете Pимских критериев IV / С.М. Ткач // Гастроентерологія. — 2016. — № 4(62). — С. 65-71. doi: 10.22141/2308-2097.4.62.2016.81097.
9. Фадєєнко Г.Д. Ураження гастродуоденальної ділянки у хворих на цукровий діабет: клініко-популяційні аспекти / Г.Д. Фадєєнко, В.А. Чернешов // Ліки України. — 2011. — № 7(153). — С. 48-50.
10. Филиппов Ю.И. Гастроэнтерологические нарушения при диабетической нейропатии / Ю.И. Филиппов // Врач. — 2011. — № 4. — С. 96-101.
11. Цукровий діабет 2 типу: адаптована клінічна настанова, заснована на доказах: Наказ Міністерства охорони здоров’я України № 1118 від 21.12.2012. — 316 с.
12. Ang L. Glucose control and diabetic neuropathy: lessons from recent large clinical trials / L. Ang, M. Jaiswal, C. Martin, R. Pop-Busui // Curr. Diab. Rep. — 2014. — Vol. 14. —
P. 528-550. doi: 10.1007/s11892-014-0528-7.
13. Bharucha A.E. Delayed gastric emptying is associated with early and long-term hyperglycemia in type 1 diabetes mellitus / A.E. Bharucha, B. Batey-Schaefer, P.A. Cleary, [et al.] // Gastroenterology. — 2015. — Vol. 149. — P. 330-339. doi: http://dx.doi.org/10.1053/j.gastro.2015.05.007.
14. Boulton A.J. Whither pathogenetic treatments for diabetic polyneuropathy? / A.J. Boulton, P. Kempler, A. Ametov, D. Ziegler // Diabetes Metab. Res. Rev. — 2013. — Vol. 29. — P. 327-333. doi: 10.1002/dmrr.2397.
15. Dholakia S. Impact of Pancreas Transplant on Diabetic Complications: Retinoparhy, Gastroparesis and Automatic Dysregulation / S. Dholakia, E.J. Sharples, P.J. Friend // Curr. Transpl. Rep. — 2016. — Vol. 3. — P. 167-173. doi 10.1007/s40472-016-0101-1.
16. Friedenberg F.K. The influence of race on symptom severity and quality of life in gastroparesis / F.K. Friedenberg, M. Kowalczyk, H.P. Parkman // J. Clin. Gastroenterol. — 2013. — Vol. 47. — P. 757-761. doi: 10.1097/MCG.0b013e3182819aae.
17. Gonder-Frederick L.A. Psychometric Properties of the Hypoglycemia Fear Survey-II for Adults With Type 1 Diabetes / L.A. Gonder-Frederick, K.M. Schmidt, K.A. Vajda, M.L. Greear, H.Singh, J.A. Shepard, D.J. Cox // Diabetes Care. — 2011. — Vol. 34. — P. 801-806.
18. Halland M. Relationship Between Control of Glycemia and Gastric Emptying Disturbances in Diabetes Mellitus / M. Halland, A.E. Bharucha // Clin. Gastroenterol. Hepatol. — 2016. — Vol. 14(7). — P. 929-936. doi: 10.1016/j.cgh.2015.11.021.
19. Hasler W.L. Correlation of Fermentable Carbohydrate Consumption With Symptoms and Quality of Life in Patients With Diabetic and Idiopathic Gastroparesis / W.S. Hasler, P. Belt, L. Wilson, R.W. McCallum, H.P. Parkman, K.L. Koch, T.L. Abell, P.J. Pasricha [et al.] // Gastroenterology. — 2016. — Vol. 146(5). — P. 610. doi: http://dx.doi.org/10.1016/S0016-5085(16)32472-6.
20. International Diabetes Federation (IDF). Diabetes Atlas. — 7th ed. — Vancouver, Canada, 2015.
21. Janssen P. The relation between symptom improvement and gastric emptying in the treatment of diabetic and idiopathic gastroparesis / P. Janssen, M.S. Harris, M. Jones [et al.] // Am. J. Gastroenterol. — 2013. — Vol. 108. — P. 1382-1391. doi: 10.1038/ajg.2013.118.
22. Martin C.L. DCCT/ EDIC Research Group. Neuropathy and related findings in the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications study / C.L. Martin, J.W. Albers, R. Pop-Busui // Diabetes Care. — 2014. — Vol. 37. — P.31-38.
23. Olausson E.A. A small particle size diet reduces upper gastrointestinal symptoms in patients with diabetic gastroparesis: a randomized controlled trial / E.A. Olausson, S. Storsrud, H. Grundin, M. Isaksson, S. Attvall, M. Simren // Am. J. Gastroenterol. — 2014. — Vol. 109. — P. 375-385. doi: 10.1038/ajg.2013.453.
24. Sadiya A. Nutritional therapy for the management of diabetic gastroparesis: clinical review / A. Sadiya // Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. — 2012. — Vol. 5. — P. 329-335. doi: 10.2147/DMSO.S31962.
25. Tack J. Management of gastroparesis: beyond basics / J. Tack, C. Vanormelingen // Curr. Treat. Options. Gastroente–rol. — 2014. — Vol. 12. — P. 468-477. doi: 10.1007/s11938-014-0034-7.
26. Törnblom H. Treatment of gastrointestinal autonomic neuropathy / H. Törnblom // Diabetologia. — 2016. — Vol. 59. — P. 409-413. doi 10.1007/s00125-015-3828-9.
27. Tseng P.-H.H. Association of diabetes and HbA1c levels with gastrointestinal manifestations / P.-H.H. Tseng, Y.-C.C. Lee, H.-M.M. Chiu [et al.] // Diabetes Care. — 2012. — Vol. 35. —
P. 1053-1060. doi: 10.2337/dc11-1596.
28. William T.C. The Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study at 30 Years: The “Gift” That Keeps on Giving! / T.C. William, R.E. Ratner // Diabetes Care. — 2014. — Vol. 3. — P. 5-7. doi: 10.2337/dc13-2369.
29. Zilliox L.A. Clinical neuropathy scales in neuropathy associated with impaired glucose tolerance / L.A. Zilliox, S.K. Ruby, S. Singh, M. Zhan, J.W. Russell // J. Diabetes Complications. — 2015. — Vol. 29. — P. 372-377. doi: 10.1016/j.jdiacomp.2015.01.011.