Резюме
Актуальність. На сьогодні відсутні загальноприйнятні порогові значення інсулінорезистентності (ІР) при артеріальній гіпертензії (АГ), тому актуальним є встановлення її ступеня у кожному із окремих досліджень. Також є важливим вивчення взаємозв’язку із синдромом ІР ступеня уражень органів-мішеней. Мета дослідження — встановити ступінь ІР у хворих на АГ, визначити взаємозв’язки між параметрами даної моделі ІР, порушеннями діастолічної функції лівого шлуночка (ЛШ) та жорсткістю аорти. Матеріали та методи. Обстежено 229 осіб з АГ та цукровим діабетом (ЦД) типу 2, 108 хворих на ізольовану АГ. Використовувались клінічні, інструментальні (ультразвукове дослідження серця та судин), біохімічні (модель HOMA-2, показники HOMA-IR, %S), статистичні методи. Результати. Перебіг ізольованої АГ та АГ з ЦД типу 2 супроводжується розвитком ІР за моделлю HOMA-2. У хворих на коморбідну патологію чутливість периферичних тканин до інсуліну залежить від тяжкості перебігу АГ. Стан ІР за моделлю HOMA-IR у хворих на ізольовану АГ встановлено у 26,6 % випадків. Рівень інсуліну плазми істотно зростає, а чутливість тканин до інсуліну знижується при діастолічній дисфункції ІІІ типу. Коефіцієнти розтягнення аорти обернено корелюють з параметрами моделі НОМА-2, що вивчалися, — рівнем глюкози (р < 0,001), інсуліну (p < 0,05), НОМА-IR (p < 0,05) та прямо корелюють із ступенем чутливості периферичних тканин до інсуліну %S (p < 0,01). Висновки. Межу ІР за HOMA-IR у хворих на АГ встановлено на рівні 1,87; визначено взаємозв’язок між параметрами ІР, діастолічною дисфункцією ЛШ та аортальною жорсткістю.
Актуальность. На сегодняшний день отсутствуют общепринятые пороговые значения инсулинорезистентности (ИР) при артериальной гипертензии (АГ), поэтому актуальным является установление ее степени в каждом из отдельных исследований. Также важно изучение взаимосвязи с синдромом ИР степени поражения органов-мишеней. Цель исследования — установить степень ИР у больных АГ, определить взаимосвязи между параметрами данной модели ИР, нарушениями диастолической функции левого желудочка (ЛЖ) и жесткостью аорты. Материалы и методы. Обследовано 229 человек с АГ и сахарным диабетом (СД) 2 типа, 108 больных с изолированной АГ. Использовались клинические, инструментальные (ультразвуковое исследование сердца и сосудов), биохимические (модель HOMA-2, показатели HOMA-IR, %S), статистические методы. Результаты. Течение изолированной АГ и АГ с СД типа 2 сопровождается развитием ИР по модели HOMA-2. У больных с коморбидной патологией чувствительность периферических тканей к инсулину зависит от тяжести АГ. Состояние ИР по модели HOMA-IR у больных с изолированной АГ установлено в 26,6 % случаев. Уровень инсулина плазмы существенно возрастает, а чувствительность тканей к инсулину снижается при диастолической дисфункции III типа. Коэффициенты растяжения аорты обратно коррелируют с изучаемыми параметрами модели НОМА-2 — уровнем глюкозы (р < 0,001), инсулина (p < 0,05), НОМА-IR (p < 0,05) и прямо коррелируют со степенью чувствительности периферических тканей к инсулину %S (p < 0,01). Выводы. Порог ИР по HOMA-IR у больных с АГ установлен на уровне 1,87; определена взаимосвязь между параметрами ИР, диастолической дисфункцией ЛЖ и аортальной жесткостью.
Background. The accepted threshold of insulin resistance value in arterial hypertension (AH) is absent, thus it is relevant to determine its degree in patients with AH, and to determine the interaction between the insulin resistance (IR) syndrome and the target organs injury. The purpose of our study was to set the threshold of IR in patients with AH, to define association between the IR parameters, presence of diastolic dysfunction and the state of aorta elasticity. Materials and methods. Investigation included 229 patients with AH and type 2 diabetes mellitus (DM), as well as 108 patients with the isolated AH. There were used clinical, instrumental, biochemical (HOMA-2 model, HOMA-IR indices), statistical methods. Results. The course of the isolated AH and AH with concomitant type 2 DM is associated with IR development, that it is well-proven in the model of HOMA-2 (р < 0.001). In patients with comorbid pathology the sensitiveness of peripheral tissues to insulin depends on severity of AH (р < 0.001). Presence of IR in HOMA-IR model was revealed in patients with the isolated AH in 26.6 % of cases. The level of plasma insulin grows substantially, and the tissues sensitiveness to insulin declined at the third type of diastolic dysfunction (р < 0.05). The coefficients of aorta elasticity have a reverse correlation with all parameters of НОМА-2 model determined by the levels of glucose (р < 0.001), insulin (p < 0.05), coefficient НОМА-IR (p < 0.05) and direct association with the degree of peripheral tissues sensitivity to insulin (p < 0.01). Conclusions. The threshold of IR by HOMA-2 model in patients was set at the level of 1.87; the increase of aorta inflexibility and diastolic dysfunction severity depend on IR severity.
Вступ
Артеріальна гіпертензія (АГ) та цукровий діабет (ЦД) на сьогодні залишаються надзвичайно поширеними захворюваннями в світі. Слід зазначити, що ймовірність розвитку ЦД типу 2 на тлі АГ збільшується залежно від віку, етнічної приналежності пацієнта, наявності ожиріння та інших компонентів метаболічного синдрому [13]. Окрім того, ЦД та АГ — дві взаємозв’язані патології, коморбідність яких має потужну ушкоджуючу дію, зі швидким розвитком ускладнень, спрямованим відразу на декілька органів-мішеней — серце, судини, нирки, головний мозок [12, 15]. Серед хворих на артеріальну гіпертензію ЦД трапляється у 2–2,5 раза частіше, ніж серед осіб без підвищеного артеріального тиску [3].
Синдром інсулінорезистентності (ІР) — комплекс метаболічних, гормональних і клінічних по–рушень, які є чинниками ризику розвитку серцево-–судинних захворювань [11] з більш високою частотою (у 4,2 раза вище, ніж у популяції) у пацієнтів прогностично несприятливих наслідків. На сьогодні методика оцінки вмісту інсуліну плазми крові містить певні недоліки, оскільки для вивчення рівня базальної гіперінсулінемії відсутні загальноприйняті нормативні та порогові значення при поєднаному перебігу АГ та ЦД типу 2, а самі тести визначення базального інсуліну мають досить низьку відтворюваність [2, 8].
Тому актуальним є встановлення граничної межі ІР у хворих як із коморбідною патологією, так і за наявності ізольованої АГ, а також вивчення взаємозв’язку синдрому ІР та уражень органів-мішеней у цієї категорії пацієнтів.
Мета — встановити межу інсулінорезистентності у хворих на артеріальну гіпертензію та цукровий діабет типу 2, визначити взаємозв’язок між показниками моделі інсулінорезистентності HOMA-2, наявністю діастолічної дисфункції лівого шлуночка, аортальної жорсткості.
Матеріали та методи
Верифікацію діагнозу АГ та визначення її ступеня проводили з використанням критеріїв, рекомендованих Європейським товариством кардіологів [6]. Верифікацію діагнозу ЦД проводили на основі критеріїв Всесвітньої організації охорони здоров’я (1999 р.) та Європейської асоціації з вивчення цукрового діабету [5].
За результатами клінічного спостереження, характером перебігу, даними клініко-функціональних і лабораторних обстежень хворі були розподілені на наступні групи: з АГ ІІ та ЦД типу 2 — 60 осіб (17,8 %), АГ ІІІ та ЦД типу 2 — 104 (30,9 %), АГ ІІ без супутнього ЦД — 108 (32 %) та АГ ІІІ без супутнього ЦД — 65 (19,3 %), усього — 337 осіб. За вмістом інсуліну плазми та глюкози плазми натще вираховували індекс ІР за моделлю HOMA-IR [7, 10, 14] та %S — чутливість периферичних тканин до інсуліну як відсоток функції чутливості тканини від референтної популяції.
Для статистичного аналізу отриманих результатів використовували пакет програм обробки даних загального призначення Statistica for Windows версії 6.0 (Stat Soft inc., США). Вірогідність різниці визначали за допомогою F-критерію Фішера для параметричних даних і міжгрупових порівнянь у LSD-тесті. Для оцінки ступеня залежності між перемінними використовували кореляційний аналіз за Пірсоном. При р < 0,05 розбіжності вважали статистично вірогідними.
Результати
При дослідженні проявів ІР у хворих на ізольовану АГ та АГ із супутнім ЦД типу 2 були отримані наступні результати величин HOMA-IR (табл. 1, 2).
Індекс НОМА-ІR у хворих на АГ та супутній ЦД типу 2 виявився вірогідно більшим (р < 0,001) за аналогічний у практично здорових осіб і хворих на ізольовану АГ, що відповідало високим значенням вмісту у плазмі крові базального інсуліну та глюкози.
Для визначення реальної нижньої межі ІР (порогового значення) було проведено обчислення 75% процентилю індексу HOMA-IR в об’єднаній групі обстежуваних, у яких не встановлено діагноз ЦД типу 2. Середнє значення HOMA-IR в об’єднаній групі дорівнювало 1,55 ± 0,44; рівні квартилів (Q25–Q75) становили 1,22–1,87.
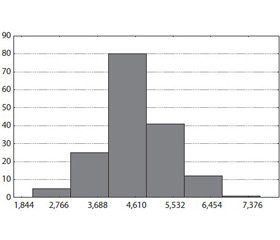
Таким чином, реальним нижнім порогом ІР за індексом моделі HOMA-IR у дослідженні можна вважати значення 1,87. З урахуванням порогового значення проведений частотний аналіз кількості хворих із різними рівнями індексів HOMA-IR відповідно у групі АГ із супутнім ЦД 2 та групі хворих на ізольовану АГ (рис. 1, 2).
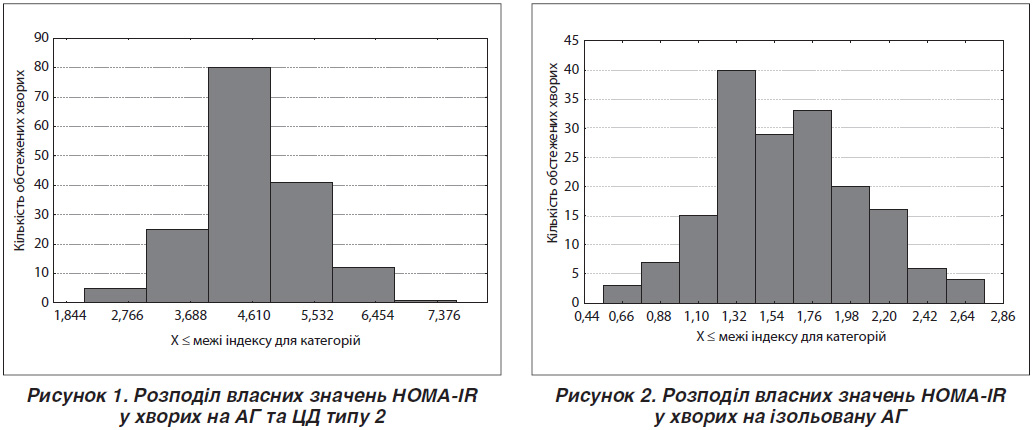
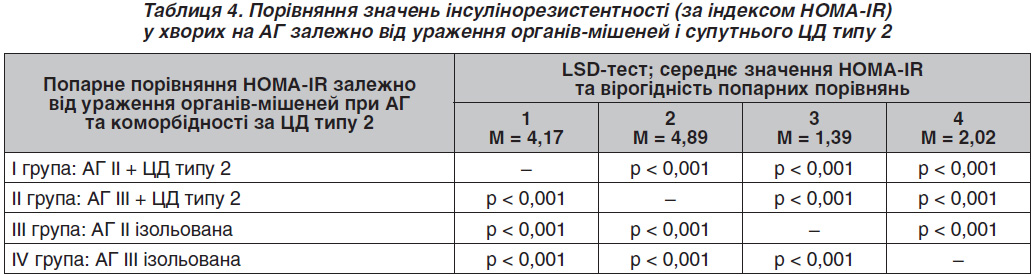
За результатами частотного аналізу встановлено, що у групі хворих на АГ із супутнім ЦД типу 2 лише у 2,44 % обстежених рівень індексу HOMA-IR був нижчим або дорівнював пороговому значенню ІР. Натомість у групі хворих на ізольовану АГ перевищення порогового значення індексу HOMA-IR встановлено у 26,59 % обстежених хворих. Таким чином, за наявності ізольованої АГ приблизно в 1/4 пацієнтів діагностується стан ІР за відсутності розвитку ЦД. Індекс ІР вірогідно залежить від глибини ураження органів-мішеней як за ізольованої АГ, так і при АГ, яка супроводжується ЦД типу 2 (табл. 3, 4). Так, за ІІ стадії АГ ступінь ІР є вірогідно нижчим (р < 0,001) порівняно з аналогічним показником АГ ІІІ стадії за умови наявності або відсутності ЦД типу 2. Звертає на себе увагу факт, що за умов ізольованої АГ ІІІ стадії середнє значення величини HOMA-IR перевищує порогове значення 75% процентиля ІР. Дійсно, при проведенні підрахунку відсотку пацієнтів із явною ІР (IR > 1,87) за ІІ стадії АГ визначається 8,57 % хворих із перевищенням порогу, а за ІІІ стадії — 54,41 %, що становить різницю в 6,3 раза (р < 0,001).
Ступінь ІР залежав від тривалості перебігу АГ. У хворих на ізольовану АГ значення індексів HOMA-IR поступово збільшувалися залежно від тривалості хвороби: вірогідну різницю (р < 0,05) зафіксовано у хворих з більше ніж 10-річним анамнезом АГ. У хворих із супутнім ЦД типу 2 індекси HOMA-IR зростали у хворих з менш як 5-річним коморбідним перебігом АГ та ЦД (р < 0,05), а при більшій тривалості не спостерігали тенденцій до збільшення їх власних значень.
Наступним завданням стало визначення можливих асоціацій між порушеннями вуглеводного та ліпідного обміну і станом діастолічної функції лівого шлуночка (ЛШ) (табл. 5).
Проведений post-hoc аналіз свідчить про вірогідність різниці показників ІР та змін чутливості тканин до інсуліну при третьому типі діастолічної дисфункції (ДД) порівняно із І і ІІ типом (р1–3 < 0,05; р2–3 < 0,05). І та ІІ типи ДД за ступенем ІР між собою не відрізняються (р > 0,05), проте спостерігається тенденція до зростання HOMA-IR ІІ типу ДД та зниження чутливості периферичних тканин до інсуліну при ньому ж.
На наступному етапі аналізувались відношення між порушеннями вуглеводного та ліпідного обміну і структурно-функціональними порушеннями судин. На рівні великих судин нами аналізувались відношення між вуглеводним та ліпідним обміном та здатністю аорти до розтягнення (табл. 6).
Отримані результати свідчать про наявність вірогідного (р < 0,05) негативного зв’язку середньої сили між змінами вуглеводного обміну (рівень глюкози та вміст інсуліну у плазмі крові) та здатністю аорти до розтягнення — із збільшенням рівня як глюкози, так і інсуліну зменшується здатність аорти до розтягнення. Із зниженням чутливості тканин до глюкози ступінь розтягнення великих судин також знижується. Таким чином, порушення вуглеводного обміну вірогідно зв’язані із змінами параметрів жорсткості на тільки міокарда ЛШ, але й артерій великого калібру.
Обговорення
На сьогодні запропоновано декілька непрямих моделей оцінки чутливості тканин за принципом визначення спеціально обчислюваних індексів [9]. У дослідженні обраною моделлю, що дозволяє комплексно оцінити стан взаємодії периферичних тканин і ступінь порушення вуглеводного обміну, є модель HOMA-2. У проведеному дослідженні встановлений пороговий рівень індексу ІР при поєднаному перебігу АГ та ЦД типу 2.
У роботах вітчизняних і зарубіжних авторів вказується, що за наявності АГ виникає стан ІР, що супроводжується порушенням ліпідного обміну, вірогідною кореляцією між рівнем інсуліну та масою міокарда ЛШ [1, 4]. У нашій роботі встановлено взаємозв’язок між ступенем ІР, розрахованим у моделі HOMA-2, та ймовірністю розвитку ДД ЛШ і розвитком макроангіопатій у вигляді зниження еластичності аорти у хворих за поєднаного перебігу АГ та ЦД типу 2, а також за наявності ізольованої АГ.
Висновки
Після аналізу ступеня інсулінорезистентності та його зв’язку із процесами ремоделювання серця та судин були отримані наступні результати.
1. Перебіг ізольованої артеріальної гіпертензії та артеріальної гіпертензії, коморбідної з цукровим діабетом типу 2, супроводжується розвитком інсулінорезистентності, що підтверджується результатами, отриманими з використанням моделі HOMA-2 (р < 0,001).
2. У хворих на артеріальну гіпертензію та супутній цукровий діабет типу 2 спостерігаються більш глибокі розлади чутливості периферичних тканин до інсуліну порівняно з хворими із монопатологією, а чутливість периферичних тканин до інсуліну залежить від тяжкості перебігу артеріальної гіпертензії (р < 0,001).
3. Стан інсулінорезистентності за моделлю HOMA-IR у хворих на ізольовану артеріальну гіпертензію встановлено у 26,6 % випадків, що пов’язано з глибиною ураження органів-мішеней (р < 0,001).
4. Рівень інсуліну плазми істотно зростає, а чутливість тканин до інсуліну знижується при діастолічній дисфункції ІІІ типу (р < 0,05).
5. Коефіцієнти розтягнення аорти мають обернений кореляційний зв’язок з усіма параметрами моделі НОМА-2 — глюкозою (r = –0,50 та –0,51; р < 0,001), інсуліном (r = –0,34 та –0,29; p < 0,05), НОМА-IR (r = –0,37 та –0,33; p < 0,05) та прямий зв’язок зі ступенем чутливості периферичних тканин до інсуліну %S (r = 0,36 та 0,40; p < 0,01).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Паньків В.І. Порушення вуглеводного обміну в клінічній практиці // Міжнародний ендокринологічний журнал. — 2017. — Т. 13. — С. 39-44. — doi: 10.22141/2224-0721.13.1.2017.96754.
2. Animal models of insulin resistance: A review / S.P. Sah, B. Singh, S. Choudhary [et al.] // Pharmacol. Rep. — 2016. — Vol. 68. — P. 1165-1177.
3. Arror A.R. Insulin resistance and heart failure: molecular mechanisms / A.R. Arror // Heart Fail. Clin. — 2012. — Vol. 8(4). — P. 3133-3140.
4. Cardiovascular Action of Insulin in Health and Disease: Endothelial L-Arginine Transport and Cardiac Voltage-Dependent Potassium Channels / S. Dubó, D. Gallegos, L. Cabrera [et al.] // Front. Physiol. — 2016. — Vol. 7. — P. 74.
5. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD / L. Ryden, P.J. Grant, S.D. Anker [et al.] // Eur. Heart Jour. — 2013. — Vol. 34. — P. 3035-3087.
6. ESH/ESC Guidelines for the management of arterial hypertension / G. Mancia, R. Fagard, Kr. Narkiewicz [et al.] // Eur. Heart Jour. — 2013. — Vol. 34. — P. 2159-2219.
7. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man / D.R. Matthews, J.P. Hosker, A.S. Rudenski [et al.] // Diabetologia. — 2016. — Vol. 28. — P. 412-419.
8. Impact of diabetes mellitus on risk of cardiovascular disease and all-cause mortality: Evidence on health outcomes and antidiabetic treatment in United States adults / L. Liu, B. Simon, J. Shi [et al.] // Diabetes. — 2016. — Vol. 7. — P. 449-461.
9. Increased Metabolic Disorders and Impaired Insulin Secretory Function in the First-Degree Relatives of Type 2 Diabe–tic Patients with Normal Glucose Tolerance / L. Deng, S. Liu, Y. Gong [et al.] // Metab. Syndr. Relat. Disord. — 2016. — Vol. 14. — P. 431-436.
10. Levy J.C. Correct homeostasis model assessment (HOMA) evaluation uses the computer program (Letter) / J.C. Levy, D.R. Matthews, M.P. Hermans // Diabetes Care. — 1998. — Vol. 21. — P. 2191-2192.
11. The renin angiotensin system, oxidative stress and mitochondrial function in obesity and insulin resistance / L. Ramalingam, K. Menikdiwela, M. LeMieux [et al.] // Biochim. Biophys. Acta. — 2016. — Vol. 16. — P. 30187-30189.
12. Vascular stiffness in insulin resistance and obesity / G. Jia, A.R. Aroor, V.G. De Marco [et al.] // Front. Physiol. — 2015. — Vol. 6. — P. 231.
13. Von Bibra H. Cardiometabolic Syndrome and Increased Risk of Heart Failure / H. von Bibra, W. Paulus, M. St. John Sutton // Curr. Heart Fail. Rep. — 2016. — Vol. 13. — P. 219-229.
14. Wallace T.M. Use and abuse of HOMA modeling / T.M. Wallace, J.C. Levy, D.R. Matthews // Diabetes Care. — 2004. — Vol. 27. — Р. 1487-1495.
15. Zheng R. The long-term prognosis of cardiovascular di–sease and all-cause mortality for metabolically healthy obesity: a systematic review and meta-analysis / R. Zheng, D. Zhou, Y. Zhu // J. Epidemiol. Community Health. — 2016. — Vol. 70. — P. 1024-1031.