Международный эндокринологический журнал Том 13, №6, 2017
Вернуться к номеру
Особливості порушень функціонального стану нирок у ранній період експериментального цукрового діабету
Авторы: Бойчук Т.М.(1), Оленович О.А.(1), Грицюк М.І.(1), Гоженко А.І.(2)
(1) — Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
(2) — ДП «Український науково-дослідний інститут медицини транспорту МОЗ України», м. Одеса, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Мета. Проведення порівняльного аналізу специфічності та вираженості ниркових дисфункцій у ранній період розвитку алоксанового та стрептозотоцинового цукрового діабету. Матеріали та методи. У статті наведені дані щодо особливостей порушень функціонального стану нирок на 11-ту добу після введення нелінійним статевозрілим самцям білих щурів діабетогенної дози стрептозотоцину (70 мг/кг) та алоксану (160 мг/кг). Результати. Встановлено спільні закономірності розвитку ренальних розладів у ранній період стрептозотоцин- та алоксан-індукованого діабету, що мають переважно функціональне походження за відсутності значущих структурних змін канальцевого апарату нирок. Висновки. У ранній період розвитку експериментального цукрового діабету обох типів порушення канальцевого відділу нефрона не відповідальні за зміни функції нирок.
Цель. Проведение сравнительного анализа специфичности и выраженности почечных дисфункций в ранний период развития аллоксанового и стрептозотоцинового сахарного диабета. Материалы и методы. Представлены данные относительно особенностей нарушений функционального состояния почек на 11-е сутки после введения нелинейным половозрелым самцам белых крыс диабетогенной дозы стрептозотоцина (70 мг/кг) и аллоксана (160 мг/кг). Результаты. Установлены общие закономерности развития ренальных нарушений в ранний период стрептозотоцин- и аллоксан-индуцированного диабета, имеющих, преимущественно, функциональное происхождение в отсутствие значительных структурных изменений канальцевого аппарата почек. Выводы. В ранний период развития экспериментального сахарного диабета обоих типов нарушения канальцевого отдела нефрона не ответственные за изменения функции почек.
Background. The purpose of our research was a comparative analysis of specificity and severity of kidney dysfunction in the early period of alloxan- and streptozotocin-induced diabetes mellitus. Materials and methods. The article presents data concerning the peculiarities of disturbances of the functional renal state on 11th day after the administration of diabetogenic dose of streptozotocin (70 mg/kg) and alloxan (160 mg/kg) in white non-linear matured male rats. Results. There were found common patterns in the development of renal disorders in the early period of streptozotocin- and alloxan-induced diabetes having, mainly, a functional origin in the absence of significant structural changes in the renal tubular apparatus. Conclusions. Disorders of nephron tubular system are not responsible for the changes in renal functions in the early period of experimental diabetes mellitus of both types.
експериментальний цукровий діабет; алоксан; стрептозотоцин; діабетична нефропатія; функціональний стан нирок
экспериментальный сахарный диабет; аллоксан; стрептозотоцин; диабетическая нефропатия; функциональное состояние почек
experimental diabetes mellitus; alloxan; streptozotocin; diabetic nephropathy; functional renal state
Вступ
Матеріали та методи
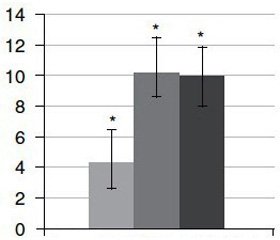
Результати
Обговорення
Висновки
- Bondar’ IA, Klimentov VV. A role of glomerular cell dysfunction in the development of diabetic nephropathy. Problemi endokrinologii. 2006;52(4):45-9. (in Russian).
- Galenova TI, Konopel’njuk VV, Savchuk OM, Ostapchenko LI. Reproduction of the streptozotocin-induced experimental model of type 2 diabetes mellitus in rats. Fizyka zhyvogo. 2010;18(3):50-4. (in Ukrainian).
- Loboda OM, Dudar IO, Aljeksjejeva VV. Mechanisms of the development and progression of diabetic nephropathy. Klinichna imunologija. Alergologija. Infektologija. 2010;9-10(38-39):46-50. (in Ukrainian).
- Majdannyk VG, Burlaka JeA. Molecular mechanisms of kidney damage in diabetes mellitus in children (literature review). Pediatrija, akusherstvo ta ginekologija. 2010;3:34-47. (in Ukrainian).
- Merets’kyj VM. Peculiarities of free-radical lipid oxidation and antioxidant protection in renal and liver tissue in the experimental diabetes mellitus. Zdobutky klinichnoi’ i eksperymental’noi’ medycyny. 2012;1:96-8. (in Ukrainian).
- Mozheyko LA. Experimental models for studying diabetes mellitus. Part 1. Alloxan diabetes. Journal of the Grodno State Medical University. 2013;3(43):26-9. (in Russian).
- Rebrov BA. Kidney damage in diabetes mellitus. Mezhdunarodnyi Endokrinologicheskii Zhurnal. 2011;2(34):51-5. (in Russian).
- Senatorova AS, Muratova EG. Features of renal function in children with diabetes mellitus in the kharkiv region. Medycyna s’ogodni i zavtra. 2012;2(55):76-80. (in Ukrainian).
- Skrobons’ka NA, Cymbal TS. Diabetic nephropathy: some nontraditional factors of pathogenesis, basic directions of diagnosis and treatment (literature review and own data). Simejna medycyna. 2011;4:18-22. (in Ukrainian).
- Khutorska LA. Prevalence, absolute and relative risk of diabetic nephropathy in patients with diabetes mellitus. Buk Med Herald. 2012;16(4):170-5. (in Ukrainian).
- Shulyarenko LV. Chronic diabetic renal disease: the contemporary view on the problem. Endokrynologia. 2013;18(1):73-82. (in Ukrainian).
- Dranovalli S, Duka I, Bakris GL. The pathogenesis of diabetic nephropathy. Nat Clin Pract Endocrinol Metab. 2008 Aug;4(8):444-52. doi: 10.1038/ncpendmet0894.
- Evans TC, Capell P. Diabetic nephropathy. Clin Diabetes 2000;18(1). Available from: http://journal.diabetes.org/clinicaldiabetes/v18n12000/Pg7.htm. Accessed: 22 May 2011.
- Forst T, Kunt T, Wilhelm B, Weber MM, Pfützner A. Role of C-Peptide in the regulation of microvascular blood flow. Exp Diabetes Res. 2008; 2008: 176245. doi: 10.1155/2008/176245.
- Zhang М, Feng L, Gu J, et al.The attenuation of moutan cortex on oxidative stress for renal injury in AGEs-induced mesangial cell dysfunction and streptozotocin-induced diabetic nephropathy rats. Oxidative medicine and cellular longevity. 2014;18:1-13. doi: 10.1155/2014/463815.

/464-1.jpg)
/465-1.jpg)