Вступ
На сьогодні цукровий діабет (ЦД) у дітей і підлітків залишається однією з головних науково-медичних, соціальних та економічних проблем у більшості країн світу. Відбувається стабільне зростання показників захворюваності та поширеності ЦД як 1-го, так і 2-го типу. Незважаючи на те, що ЦД 1-го типу займає лише 1,7 % у структурі ендокринних захворювань в дітей, ця патологія відноситься до найбільш значущих внаслідок тяжкого лабільного перебігу, високої частоти гострих і хронічних ускладнень. Діти та підлітки з ЦД 1-го типу потребують постійної значної уваги з боку медиків, батьків, родичів, вчителів [1]. У 2016 році в Україні ЦД 1-го типу було зареєстровано у 8847 дітей віком від 0 до 17 років, серед них вперше в 1298 дітей. Поширеність ЦД 1-го типу серед дітей України невпинно зростає та у 2016 році становила 11,62 на 10 000 дитячого населення (у 2013 р. — 10,80; у 2010 р. — 9,81 на 10 000 дитячого населення). У період 2002–2016 рр. поширеність ЦД 1-го типу серед дитячого населення зросла на 49,5 %. Звертають до себе увагу високі темпи зростання захворюваності на ЦД 1-го типу серед дітей віком 0–6 років [2–4].
Відомо, що діти та підлітки переважно хворіють на ЦД 1-го типу, на відміну від дорослих, які частіше мають ЦД 2-го типу. ЦД 1-го типу — це автоімунне захворювання, при якому селективне ураження β-клітин підшлункової залози з часом призводить до абсолютної інсулінової недостатності [5].
Останнім часом також відмічається значне зростання захворюваності на ЦД 2-го типу серед дітей і підлітків [6]. За даними багатьох клінічних досліджень, все частіше трапляється так званий гібридний, або подвійний, діабет, коли поряд з антитілами до β-клітин та їх ферментів, характерних для ЦД 1-го типу, є ознаки інсулінорезистентності [7, 8]. Також зросла частота моногенного ЦД, що перебуває в межах від 2,5 до 10 % серед усіх випадків діабету в дітей [9].
Перебіг ЦД 1-го типу у дітей молодшого віку завжди вважався найтяжчим, що пов’язано з багатьма як ендогенними (незрілість і лабільність майже всіх систем організму, особливо імунної та нервової), так і екзогенними чинниками (страх перед ін’єкцією, непередбачена відмова від їжі, труднощі у дотриманні необхідного режиму харчування тощо) [10]. Усе це призводить до того, що значна частина дітей молодшого віку має стан вуглеводного обміну із загрозою для життя. Це стосується також і підлітків. Відомо, що в період статевого формування на тлі підвищення рівня контрінсулярних гормонів, зокрема соматотропного та статевих, збільшується резистентність периферичних тканин до інсуліну [11]. Саме у цей віковий період для компенсації ЦД підлітки потребують більшої дози інсуліну на кілограм маси тіла, ніж діти молодшого віку, і не завжди ця умова виконується [12]. Це обумовлює погіршення метаболічного контролю захворювання, довготривалої декомпенсації і ранньої появи діабетичних ускладнень [13, 14].
З метою запобігання раннім і віддаленим ускладненням необхідно підтримувати контроль глікемії як можна ближче до нормальних вуглеводних показників. За останніми рекомендаціями International Society for Pediatric and Adolescent Diabetes (ISPAD, 2014), показники вуглеводного контролю є однаковими для всіх вікових категорій серед дітей, хворих на ЦД 1-го типу (табл. 1).
Для максимального наближення до цільових показників вуглеводного обміну необхідно дотримуватись багатьох аспектів лікування й ефективного контролю глікемії. Перш за все це зміна способу життя із зменшенням застосування продуктів із високим глікемічним індексом і збільшенням фізичної активності. Основними проблемами у досягненні оптимального контролю ЦД серед дітей і підлітків є схильність до гіпоглікемій, особливо нічних, і висока варіабельність щоденних профілів дії інсуліну [15]. Тому дуже важливо підтримуватись такої базисно-болюсної схеми інсулінотерапії, що максимально відповідає фізіологічному профілю дії інсуліну.
На сьогодні найбільш оптимальною схемою базисно-болюсної терапії є застосування безпікових аналогів інсуліну пролонгованої дії в комбінації з аналогами інсуліну ультракороткої дії (глюлізин, аспарт, лізпро) [16, 17]. Така схема введення інсуліну максимально наближається до його фізіологічної секреції в організмі дитини та забезпечує мінімальний ризик виникнення гіпоглікемій. Поряд із цим найбільш фізіологічним введенням інсуліну вважають режим безперервного підшкірного введення з урахуванням конкретних індивідуальних потреб кожного пацієнта за допомогою інсулінової помпи (ІП) [18, 19].
Інсулінова помпа максимально імітує роботу підшлункової залози здорової людини. Це означає, що вона вводить інсулін в двох режимах: базальному і болюсному. Сучасні ІП дозволяють запрограмувати швидкість введення базального інсуліну, вона може змінюватися за необхідністю кожні півгодини. ІП подає інсулін в безперервному індивідуально запрограмованому режимі, і в цьому її основна перевага перед традиційними ін’єкціями інсуліну [20].
В ІП застосовується тільки аналог інсуліну ультракороткої дії. Інсулін подається дуже маленькими дозами по 0,025–0,100 ОД кожні кілька хвилин, завдяки цьому інсулін подається з високою точністю дозування і всмоктується практично моментально, не призводить до різких гіпоглікемічних станів за відсутності депо інсуліну в жировій тканині [21].
Окрім бажання самого пацієнта, виділяють такі показання для переходу на помпову інсулінотерапію:
1. Рівень контролю ЦД з високим ризиком для життя.
2. Рівень глюкози в крові пацієнта часто і суттєво коливається (лабільний перебіг).
3. Відзначаються часті епізоди гіпоглікемії, зокрема тяжкі, а також вночі.
4. Феномен «ранкової зорі».
5. Планування вагітності, під час вагітності та пологів, у післяпологовий період.
6. Схильність до ліподистрофій.
7. Дитячий вік (у США близько 80 % дітей, хворих на ЦД, використовують інсулінові помпи, в Європі — близько 70 %) [22–24].
Мета дослідження полягає в проведенні ретроспективного порівняльного аналізу використання аналогів інсуліну пролонгованої та ультракороткої дії і людських генно-інженерних інсулінів середньої і короткої дії у дітей і підлітків, хворих на цукровий діабет 1-го типу.
Матеріали та методи
В Україні всі діти та підлітки безкоштовно забезпечуються сучасними якісними генно-інженерними інсулінами. Більшість дітей і підлітків знаходиться на комбінації людських інсулінів середньої та короткої дії. У відділі дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» протягом багатьох років поряд із використанням людських генно-інженерних інсулінів середньої і короткої дії застосовується базисно-болюсна схема інсулінотерапії з використанням аналогів інсуліну пролонгованої та ультракороткої дії.
Нами проведений ретроспективний порівняльний аналіз застосування вищевказаних інсулінів та їх аналогів у групі дітей і підлітків, хворих на ЦД 1-го типу. Обстежено 100 пацієнтів віком від 2 до 15 років, які спочатку знаходились на комбінації людських інсулінів середньої (2 ін’єкції на добу) і короткої дії (3 ін’єкції на добу). Тривалість захворювання на ЦД 1-го типу становила від 3 до 10 років. За показаннями пацієнти були переведені на аналоги інсулінів пролонгованої та ультракороткої дії. Пацієнти під час зміни схеми інсулінотерапії перебували у стані субоптимального контролю ЦД 1-го типу або у стані високого ризику для життя. Стан контролю захворювання оцінювався за критеріями, рекомендованими ISPAD 2014 року (табл. 1), згідно з якими у стані оптимального контролю ЦД не повинно бути тяжких гіпоглікемій; добовий діапазон зміни глікемії повинен становити ≤ 6,0 ммоль/л [25].
/28-1.jpg)
Враховуючи вищу активність і більш швидку дію ультракороткого інсуліну [26, 27], доза його спочатку становила 2/3 від дози попереднього інсуліну короткої дії. Ін’єкції проводили 3–5 разів на добу безпосередньо перед їжею, залежно від потреб пацієнта. У подальшому дозу коригували під контролем післяпрандіальної глікемії.
Під час перебування у стаціонарі всім дітям кілька разів на добу перевіряли рівень глюкози крові (натще, препрандіальний, післяпрандіальний, перед сном і нічний рівні), досліджували наявність глюкози та кетонових тіл у сечі. За компенсації вуглеводного обміну припустимо наявність 0,2–0,5 % цукру у добовій сечі, ацетонурія повинна бути відсутньою [25].
Рівень фракції НbА1с визначали імунологічним методом під час госпіталізації пацієнтів у клініку на тлі застосування продовженого та короткого типів інсуліну, а також після 6 і більше місяців лікування комбінацією продовженого та ультракороткого аналогів інсулінів.
Окрім того, для проведення порівняльного аналізу критеріїв компенсації у дітей при постійному підшкірному введенні тільки інсуліну ультракороткої дії була відібрана група дітей, що застосовувала ІП. У відділі дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» на обліку знаходиться більше ніж 100 дітей, хворих на ЦД 1-го типу, віком від 6 до 17 років, які користуються ІП. Усім пацієнтам помповий насос був встановлений за добровільною згодою.
Результати
При переведенні пацієнтів на базисно-болюсну схему лікування із застосуванням аналогів інсуліну ультракороткої дії більшість хворих та їх батьків (78 родин) суб’єктивно відзначали значне поліпшення загального стану дитини: зникав головний біль, нормалізувався апетит та покращився настрій, маленькі діти ставали спокійнішими. Серед переваг необхідно вказати, що аналог інсуліну ультракороткої дії можна вводити безпосередньо перед їжею або навіть відразу після неї, він не потребує обов’язкових перекусів між основними прийомами їжі, що є важливим та зручним, особливо для школярів. Тільки 8 хворих не відзначали суттєвого впливу зміни виду інсуліну на свій режим дня. Негативних побічних ефектів, алергічних реакцій не спостерігалося. Також діти та їх батьки вказували на значно меншу кількість денних і нічних гіпоглікемій різного ступеня тяжкості.
Аналізуючи показники глікемії та глюкозурії у дітей і підлітків, хворих на ЦД 1-го типу, через 2 тижні від початку застосування аналогів ультракороткої дії порівняно з попередньою комбінацією відзначалася позитивна динаміка (табл. 2).
При застосуванні аналогів ультракороткого та пролонгованого терміну дії глікемія натще та післяпрандіальна мали тенденцію до зниження, а рівень препрандільної глікемії був вірогідно зниженим. Коливання рівня глюкози крові протягом доби мали менший діапазон. Добова глюкозурія вірогідно знизилась, а при індивідуальному аналізі у 39 дітей цукор у сечі був відсутній протягом тижня (до виписки з клініки) або значно знизився порівняно з періодом до переведення на аналоги інсуліну. У всіх хворих після застосування аналогів інсуліну ультракороткої дії кетонурія була відсутня.
Рівень НbА1с на терапії людськими інсулінами становив 10,4 ± 0,9 %, а після застосування аналогів інсуліну пролонгованої та ультракороткої дії протягом 6 місяців рівень НbА1с зменшився до 7,9 ± 1,3 %.
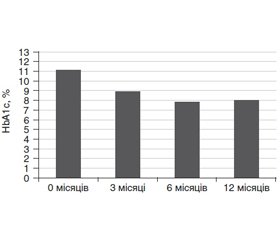
Аналізуючи результати щодо стану компенсації ЦД 1-го типу і самопочуття хворих, яких було переведено на ІП, також відзначалося значне покращення рівня НbА1с: з 11,2 ± 1,1 % на класичній інсулінотерапії (КІТ) до 8,9 ± 1,4 %, 6,8 ± 0,7 %, 8,0 ± 1,6 % відповідно через 3, 6 і 12 місяців після застосування ІП (рис. 1).
Введення ультракороткого аналогу інсуліну за допомогою помпи сприяло значному зменшенню кількості епізодів гіпоглікемій, особливо нічних. Кількість гіпоглікемічних епізодів знизилась головним чином за рахунок легких (глюкоза крові 3–4 ммоль/л) і тяжких (глюкоза крові нижче 2 ммоль/л з проявами запаморочення і втратою свідомості) гіпоглікемій відповідно на 85,8 і 85 % порівняно із середніми (глюкоза крові 2–3 ммоль/л) гіпоглікемічними станами, кількість випадків яких на рік зменшилась на 55 % (рис. 2).
Таким чином, головною метою лікування ЦД повинна бути максимальна нормалізація вуглеводного обміну за допомогою в першу чергу дієти та адекватної інсулінотерапії, з урахуванням характерологічних особливостей і режиму діяльності кожної окремої дитини, а також за рахунок використання профілактичних засобів щодо специфічних ускладнень ЦД [12, 28]. Адекватний клінічний і метаболічний контроль ЦД 1-го типу може бути досягнутий за допомогою аналогів інсуліну різного терміну дії.
Обговорення
Метаболічна компенсація ЦД 1-го типу у дітей і підлітків є запорукою гальмування розвитку діабетичних ускладнень, сприяє нормальній психологічній і соціальній адаптації дитини у суспільстві, відповідно, підвищенню якості та тривалості життя пацієнтів [18]. Найбільш ефективним сучасним шляхом досягнення оптимального рівня клінічного і метаболічного контролю є застосування аналогів інсуліну ультракороткого та тривалого терміну дії, які рекомендовані для лікування пацієнтів різного віку. Так, аналог інсуліну ультракороткої дії глюлізин рекомендований для застосування у дітей з 6-річного віку [29]. Кілька досліджень показало ідентичну ефективність, безпеку аналогів інсуліну глюлізину та лізпро при застосуванні в межах базисно-болюсної схеми терапії. Глюлізин вважають ефективним засобом для проведення інсулінотерапії у дітей і підлітків.
S. Garg та співавт. (2010) на підставі аналізу сучасної літератури (MEDLINE та матеріали конгресів) встановили, що із 28 рандомізованих міжнародних досліджень щодо аналогів інсуліну короткої дії 4 було присвячено інсуліну гларгіну, 7 — інсуліну аспарт, 17 — лізпро; 3 дослідження були присвячені порівнянню швидкодіючих аналогів інсуліну зі звичайними людськими інсулінами короткої дії та ще 3 дослідження — порівнянню двох аналогів короткої дії.
Згідно з даними літератури, базально-болюсний режим інсулінотерапії із застосуванням прандіального швидкодіючого аналога інсуліну забезпечує аналогічний або навіть кращий глікемічний конт–роль порівняно з регулярними людськими інсулінами короткої дії, а також зниження епізодів гіпоглікемії в аналогічних дозах [30]. На сьогодні для лікування дітей доступні 6 аналогів інсуліну (три з них — швидкодіючі, три — з пролонгованою дією) [27]. У всіх дослідженнях у дітей з ЦД 1-го типу аналоги інсуліну внаслідок особливостей їх структури дозволяють мати більшу свободу дії і режиму дня, знижують кількість епізодів нічних гіпоглікемій, післяпрандіальну гіперглікемію, що в підсумку покращує якість життя дітей та їх родин. Рівень HbA1c не відрізнявся від аналогічного показника при застосуванні регулярних людських інсулінів. Доказова база свідчить про безпеку та ефективність аналогів інсуліну, деякі з них (лантус, левемір) вже дозволені для дітей із двох років [31].
У відділі дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України» з 2005 року накопичений значний досвід роботи з аналогами інсуліну швидкого та тривалого терміну дії [32, 33], що свідчить про високу ефективність та безпеку застосування аналогів інсуліну у дітей різних вікових груп. Наші дані збігаються з даними міжнародних досліджень у дітей з ЦД 1-го типу віком 6–12 років при застосуванні інсуліну глюлізину [34]. Аналоги інсуліну також можуть бути рекомендовані для лікування пацієнтів і з ЦД 2-го типу.
Аналоги інсуліну ультракороткої дії є препаратами вибору для безперервного підшкірного введення при застосуванні в ІП [24, 36]. Вважають, що використання аналогів інсуліну в ІП на високому рівні гарантує адекватний глікемічний контроль, низьку потребу в інсуліні, краще самопочуття пацієнта [37]. У 25 міжнародних мультицентрових рандомізованих дослідженнях показана безпека застосування аналогів інсуліну глюлізин та аспарт у помповій терапії і у дітей, і у дорослих [38]. Встановлено суттєве зниження рівня HbA1c та кількості епізодів нічних гіпоглікемій [39].
У деяких випадках навіть при використанні найсучасніших моделей ІП виникає порушення надходження інсуліну внаслідок оклюзії катетера, яку пов’язують з перевищенням терміну використання катетера, поломки помпи/інфузійного пристрою, закупорки інфузійного пристрою, стабільністю інсуліну, помилкою користувача або комбінацією всіх факторів. Відмова від застосування ІП фіксується приблизно в 1–4 % випадків; частіше у підлітків і молодих дорослих (4 %). Серед причин відмови від помпи вказують на проблеми з одягом (57 %), відчуття тривоги та несприйняття помпи (44 %), проблеми з глікемічним контролем (30 %).
Подальше вивчення особливостей застосування аналогів інсуліну ультракороткої дії у дітей і підлітків із ЦД 1-го типу є актуальним і важливим для клінічної дитячої ендокринології.
Висновки
Аналоги інсуліну, особливо ультракороткої дії, є високоефективними та доступними препаратами вибору при застосуванні базисно-болюсної схеми інсулінотерапії у дітей і підлітків. Аналоги інсуліну ультракороткої дії у комбінації з аналогами інсулінів пролонгованої дії найкраще імітують фізіологічну секрецію інсуліну підшлунковою залозою. Великою перевагою є можливість введення аналогів інсуліну ультракороткого терміну дії безпосередньо перед їжею/відразу після їжі. Застосування аналогів інсуліну ультракороткого терміну дії знижує ризик виникнення як легких, так і тяжких гіпоглікемій, особливо у нічний період, забезпечує поліпшення післяпрандіальної глікемії; запобігає значному та різкому коливанню рівнів глікемії протягом доби, що позначається на зниженні рівня НbА1с. Наявні переваги аналогів інсулінів ультракороткої дії можуть сприяти зменшенню ризику виникнення ранніх і пізніх ускладнень ЦД та поліпшенню якості життя пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Williams G. Diabetes in children. Adjusting to normal life as a diabetic / G. Williams, S.P. Paul, S. Hicks // J. Fam. Health Care. — 2012. — Vol. 22, № 6. — P. 16-22.
2. Статистично-аналітичний довідник дитячого ендокринолога за 2009 рік. — К., 2010. — 101 с.
3. Статистично-аналітичний довідник дитячого ендокринолога за 2013 рік. — К., 2014. — 100 с.
4. Статистично-аналітичний довідник дитячого ендокринолога за 2016 рік. — К., 2017. — 102 с.
5. Understanding type 1 diabetes: etiology and models / S. Acharjee, B. Ghosh, B.E. Al-Dhubiab, A.B. Nair // Can. J. Diabetes. — 2013. — Vol. 37, № 4. — P. 269-276.
6. Tillotson C.V., Boktor S.W. Diabetes mellitus, type 2, pediatric. Stat Pearls [Internet]. — Treasure Island (FL): Stat Pearls Publishing; 2017–2017 May 18.
7. Зак К.П., Попова В.В. Предсказание развития сахарного диабета 1-го типа и диагностика его асимптомной фазы с помощью антител к островкам Лангерганса поджелудочной железы у человека задолго до возникновения у него заболевания // Международный эндокринологический журнал. — 2016. — № 7(9). — С. 11-21. — DOI: 10.22141/2224-0721.7.79.2016.86414.
8. Danne Т. Paediatric diabetes: achieving practical, effective insulin therapy in type 1 and type 2 diabetes / Т. Danne, D. Bec–ker // Acta Paediatr. — 2007. — Vol. 96, № 11. — P. 1560-1570.
9. Körner A. Diabetes mellitus in children / A. Körner // Orv. Hetil. — 2005. — Vol. 146, № 25. — P. 1335-1343.
10. Levesque C. Management of diabetes in children and ado–lescents / C. Levesque // Nurs. Clin. North. Am. — 2017. — Vol. 52, № 4. — P. 589-603.
11. Children and young people with diabetes: recognition and management / H. Hamilton, G. Knudsen et al. // Br. J. Nurs. — 2017. — Vol. 26, № 6. — P. 340-347.
12. Skeletal growth and bone mineral acquisition in type 1 diabetic children; abnormalities of the GH/IGF-1 axis / M. Raisingani, B. Preneet, B. Kohn, S. Yakar // Growth Horm. IGF Res. — 2017. — Vol. 34. — P. 13-21.
13. Malik F.S. Insulin therapy in children and adolescents with type 1 diabetes / F.S. Malik, C.E. Taplin // Paediatr Drugs. — 2014. — P. 16, № 2. — P. 141-150.
14. Choby B. Diabetes update: Primary care of patients with type 1 diabetes / B. Choby // FPEssent. — 2017. — Vol. 456. — P. 11-19.
15. Большова О.В. Гіпоглікемічні стани у дітей і підлітків / О.В. Большова // Клінічна ендокринологія та ендокринна хірургія. — 2011. — № 3. — С. 3-14.
16. Большова О.В. Досвід тривалого використання аналогів інсуліну «Епайдра» та «Лантус» у дітей та підлітків, хворих на цукровий діабет 1 типу / О.В. Большова, О.Я. Самсон // Український журнал дитячої ендокринології. — 2011. — № 1. — С. 14-18.
17. Tibaldi J.M. Evolution of insulin: from human to analog / J.M. Tibaldi // Am. J. Med. — 2014. — Vol. 127, № 10. — P. 25-38.
18. Shalitin S. Diabetes technology and treatments in the paediatric age group / S. Shalitin, H. Peter Chase // Int. J. Clin. Pract. Suppl. — 2011. — Vol. 170. — P. 76-82.
19. Спринчук Н.А. Сучасні технології лікування цукрового діабету 1 типу у дітей / Н.А. Спринчук, О.В. Большова // Ендокринологія. — 2013. — Т. 18, № 43. — С. 81-84.
20. Association of insulin pump therapy vs insulin injection therapy with severe hypoglycemia, ketoacidosis, and glycemic control among children, adolescents, and young adults with type 1 diabetes / B. Karges, A. Schwandt, B. Heidtmann, O. Kordonouri, E. Binder, U. Schierloh et al. // JAMA. — 2017. — Vol. 318, № 14. — P. 1358-1366.
21. Continuous subcutaneous insulin infusion in diabetes: patient populations, safety, efficacy, and pharmacoeconomics / P. Pozzilli, T. Battelino, T. Danne et al. // Diabetes Metab. Res. Rev. — 2016. — Vol. 32, № 1. — P. 21-39.
22. Is there a place for insulin pumps therapy in your practice? / J.S. Skyler, S. Ponder, D.F. Kruger et al. // Clin. Diabetes. — 2007. — Vol. 25, № 2. — P. 50-56.
23. Golden S. Methods for insulin delivery and glucose monitoring in diabetes: summary of a comparative effectiveness review / S.H. Golden, T. Sapir // J. Manag. Care Pharm. — 2012. — Vol. 18, № 6. — P. 1-17.
24. The impact of continuous subcutaneous insulin infusion therapy on efficacy and safety in a cohort of type 1 diabetes patients: a 3-year prospective study / A. Melidonis, A. Kamaratos, A. Angelidi et al. // Diabetes Technol. Ther. — 2016. — Vol. 18, № 3. — P. 159-163.
25. ISPAD Clinical Practice Consensus Guidelines 2014. Insulin treatment in children and adolescents with diabetes / T. Danne, H.J. Bangstad, L. Deeb et al. // Pediatr. Diabetes. — 2014. — Vol. 15. — P. 115-134.
26. Galli-Tsinopoulou A. Insulin analogues for type 1 diabetes in children and adolescents / A. Galli-Tsinopoulou, D. Stergidou // Drugs. Today (Barc.). — 2012. — Vol. 48, № 12. — P. 795-809.
27. The role of insulin glulisine to improve glycemic control in children with diabetes mellitus / A. Lih, E. Hibbert, T. Wong [et al.] // Diabetes Metab. Syndr. Obes. — 2010. — Vol. 26, № 3. — P. 403-412.
28. Garg S. Rapid-acting insulin analogues in Basal-bolus regimens in type 1 diabetes mellitus / S. Garg, F.J. Ampudia-Blasco, M. Pfohl // Endocr. Pract. — 2010. — Vol. 16, № 3. — P. 486-505.
29. Уніфікований клінічний протокол «Цукровий діабет 1 типу у дітей». Частина 2 // Український журнал дитячої ендокринології. — 2016. — Т. 4, № 20. — С. 34-86.
30. Большова О.В. Применение аналога инсулина Лантус в терапии сахарного диабета у детей и подростков / О.В. Большова, О.Я. Самсон // Проблеми ендокринної патології. — 2005. — № 3. — С. 9-14.
31. Большова О.В., Самсон О.Я. 10 років препарату Лантус в Україні: вітчизняний та зарубіжний досвід застосування інсуліну гларгіну при лікуванні цукрового діабету / О.В. Большова, О.Я. Самсон // Укр. мед. часопис. — 2014. — № 2. — С. 49-52.
32. Safety results from OCAPI: a European Observational Cohort Study of insulin glulisine-treated children aged 6-12 years with type 1 diabetes / M. Konstantinova, V. Loizeau, V. Pilorget et al. // Exp. Clin. Endocrinol. Diabetes. — 2014. — Vol. 122, № 9. — P. 523-527.
33. Garnock-Jones K.P. Insulin glulisine: a review of its use in the management of diabetes mellitus / K.P. Garnock-Jones, G.L. Plosker // Drugs. — 2009. — Vol. 69, № 8. — P. 1035-1057.
34. Evaluation of pump discontinuation and associated factors in the T1D exchange clinic registry / J.C. Wong, C. Boyle, L.A. DiMeglio et al. // J. Diabetes Sci. Technol. — 2017. — Vol. 11, № 2. — P. 224-232.
35. Continuous subcutaneous insulin infusion in diabetes: patient populations, safety, efficacy, and pharmacoeconomics / P. Pozzilli, T. Battelino, T. Danne et al. // Diabetes Metab. Res. Rev. — 2016. — Vol. 32, № 1. — P. 21-39.
36. Continuous subcutaneous insulin infusion versus multiple daily injections in individuals with type 1 diabetes: a systematic review and meta-analysis / K. Benkhadra, F. Alahdab, S.U. Tamhane et al. // Endocrine. — 2017. — Vol. 55, № 1. — P. 77-84.
37. Insulin glulisine for continuous subcutaneous insulin infusion in pediatric type 1 diabetes / T. Urakami, Y. Mine, M. Aoki et al. // Pediatr. Int. — 2017. — Vol. 59, № 5. — P. 647-649.
38. Influence of local skin temperature and choice of insulin analog on catheter occlusion rates during continuous insulin infusion: an exploratory study / S. Naik, D. Kerr, J. Begley, J. Morton // Diabetes Techn. ol. Ther. — 2012. — Vol. 14, № 11. — P. 1018-1022.
39. Insulin pump risks and benefits: a clinical appraisal of pump safety standards, adverse event reporting and research needs. A joint statement of the European Association for the Study of Diabetes and the American Diabetes Association Diabetes Technology Working Group / L. Heinemann, G.A. Fleming, J.R. Petrie et al. // Diabetologia. — 2015. — Vol. 58, № 5. — P. 862-870.

/28-1.jpg)
/29-1.jpg)
/30-1.jpg)