Вступ
Цукровий діабет (ЦД) — поширене не лише в Україні, а й у світі неінфекційне захворювання, що характеризується поступовим розвитком мікро- та макросудинних ускладнень. Одним із таких ускладнень є діабетична нефропатія (ДН). Доклінічною ознакою розвитку нефропатії є мікроальбумінурія — екскреція альбуміну із сечею — від 30 до 300 мг/добу. Клінічні ознаки ДН проявляються при загибелі великої кількості нефронів і склерозі 20–25 % клубочків та починаються з розвитку систоло-діастолічної гіпертензії, що переважно має ренін-залежний механізм [1–3]. Патоморфологічною основою змін у нирках є тубулоінтерстиційний фіброз, ознаками якого є зміни в інтерстиції та канальцях нирок у вигляді клітинної інфільтрації, накопичення компонентів екстрацелюлярного матриксу (колагену, фібронектину, ламініну), розростання та склероз інтерстицію, гіаліново-гідропічної дистрофії канальцевого епітелію, що в подальшому призводить до апоптозу тубулярних клітин, атрофії канальців і втрати перитубулярних капілярів [1, 4].
Важлива роль у патогенезі ушкодження нирок належить ураженню подоцитів, мезангіальних клітин, ендотелію мікросудин [5–7]. Це пов’язане з тим, що нирки більше, ніж інші органи, залежать від функціонального стану ендотелію внаслідок наявності в них великого пулу ендотеліальних клітин, які є інсулінонезалежними. Тому в умовах гіперглікемії глюкоза безперешкодно потрапляє в них, спричинюючи порушення їх функцій через патологічні метаболічні зміни [8, 9].
Окрім того, розлади нормального функціонування нирок відбуваються також через порушення процесів глікозилювання білків. Останні зв’язуються з вільними амінами білків, ліпідів і нуклеїнових кислот, змінюючи їх якість. Цей процес супроводжується вторинною експресією цитокінів, які залучають макрофаги та моноцити, і призводить до розвитку локальної запальної реакції, накопичення в матриксі глікозильованого альбуміну, імуноглобулінів та імунних комплексів. Останні, в свою чергу, стимулюють імунокомпетентні клітини і секрецію цитокінів, що впливає на проліферацію матриксу судинної стінки, порушення її проникності [2, 10].
Для вивчення процесів, які супроводжують ЦД, застосовують різноманітні експериментальні моделі, що його відтворюють. Однією з поширених методик є застосування антибіотика з онкостатичною дією — стрептозотоцину [11, 12].
Мета роботи: дослідити зміни структур звивистих канальців нирок у динаміці стрептозотоцин-індукованого ЦД при введенні нікотинамідаденіндинуклеотидфосфату (НАДФ).
Матеріали та методи
Експеримент проведено на 54 статевозрілих нелінійних самцях білих щурів масою 0,17–0,20 кг. Тварин розподіляли на групи. Перша (1-ша) — контрольна група, тварини якої перебували на стандартному режимі годування, освітлення та утримання. Дослідним групам тварин (2, 3 та 4-й) одноразово внутрішньоочеревинно вводили стрептозотоцин (Sigma, США) у дозі 70 мг/кг [11, 12].
Виведення тварин з експерименту та відповідні дослідження проводили на 11, 21 та 31-шу добу після введення стрептозотоцину. До експерименту залучали тварин, рівень глікемії яких перевищував 10 ммоль/л. Для вимірювання рівня глюкози використовували стандартний глюкометр HealthPro (Південна Корея).
У наступній серії експериментів показники контрольної групи тварин порівнювали з такими в дослідних групах із модельованим стрептозотоциновим ЦД в ті самі часові проміжки при введенні щурам інтраперитонеально розчину НАДФ у дозі 30 мг/кг маси тіла тварини на ізотонічному розчині хлориду натрію.
Тварин виводили з експерименту під легким ефірним знеболюванням, дотримуючись положень Директиви ЄЕС № 609 (1986) та наказу МОЗ України № 690 від 23.09.2009 р. «Про заходи щодо подальшого удосконалення організаційних норм роботи з використанням експериментальних тварин».
Кількісну оцінку стану білків у гістохімічних препаратах, забарвлених бромфеноловим синім за Mikel Calvo, здійснювали методом комп’ютерної мікроспектрофотометрії на основі коефіцієнта R/B [13, 14].
Величину коефіцієнта R/B тлумачили так: якщо вона більше за одицицю, то в білках переважали карбоксильні групи над аміногрупами, причому, якщо ця величина більша, то більше і суттєве переважання. Якщо величина коефіцієнта R/B менша за одицицю, то в білках переважали аміногрупи над карбоксильними групами. Вірогідність різниці показників визначали з використанням t-критеріїв Стьюдента. У таблицях значення вірогідності (р) наведені лише для вірогідних (р ≤ 0,05) різниць показників, що вивчалися.
Результати
Перелік досліджуваних структур нирки був обраний з урахуванням змін, які були виявлені при експериментальному ЦД без уведення НАДФ. Таким чином вивчали базальні мембрани звивистих канальців, епітелій звивистих канальців, субендотеліальні базальні мембрани інтерстицію, сполучно–тканинні волокна інтерстицію.
Дані щодо коефіцієнта R/B у базальних мембранах звивистих канальців разом з ендотеліоцитами при введенні НАДФ на тлі стрептозотоцин-індукованого ЦД в різні терміни експерименту подані у табл. 1. Забарвлення мало переважно дифузний характер, було доволі інтенсивним, але відзначалося різними спектральними характеристиками.
Згідно з даними табл. 1, корекція уражень аміногруп білків субепітеліальних мембран вперше стала ефективною на 21-шу добу, причому особливо виражені зрушення встановлені на 31-шу добу експерименту.
Позитивний ефект від застосування НАДФ на епітеліоцити звивистих канальців досягнутий на 31-шу добу експерименту (табл. 2).
Отже, для звивистих канальців нирки, як і для ниркових клубочків, спостерігається ефект від корегувальних заходів тільки тоді, коли мають місце ураження аміногруп білків, а стан структур з нормальними показниками аміногруп білків не змінюється.
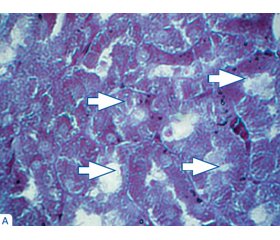
Описані зміни у звивистих канальцях нирки ілюструються за допомогою мікрофотознімків кіркової речовини нирки (рис. 1). Досліджено ефекти корегувальних заходів і на субендотеліальні базальні мембрани кровоносних судин інтерстицію кіркової та мозкової речовини і сосочка нирки. Цифрові дані щодо коефіцієнта R/B у зазначених структурах подані в табл. 3, згідно з якими ефекти від уведення НАДФ були присутніми на 21-шу та 31-шу добу експерименту.
Аналогічно реагували й ендотеліоцити кровоносних судин інтерстицію кіркової та мозкової речовини і сосочка нирки.
Кровоносні судини мозкової речовини нирки в експериментальних тварин різних груп дослідження визначено на рис. 2.
Обговорення
При виконанні наших досліджень для виявлення змін ниркових структур спочатку був застосований класичний гістологічний метод за допомогою забарвлення гістологічних зрізів гематоксиліном та еозином і вивчення їх у світлооптичному мікроскопі при різному оптичному збільшенні. Як описовий метод, так і застосування морфометричних підходів не виявили жодних змін ані в ниркових клубочках, ані в звивистих канальцях, ані в стромі (у тому числі судинах кіркової речовини), ані в збірних трубочках та інтерстиції мозкової речовини і сосочка нирки. Зокрема, у звивистих канальцях не виявлено альтеративних процесів (будь-яких проявів дегенерації чи посиленої загибелі клітин — некрозу або апоптозу) та потовщення чи змін оптичної щільності субепітеліальних базальних мембран, що зазвичай трапляється при вираженому ЦД. У збірних трубочках мозкової речовини та сосочка нирки також не виявлено ніяких морфологічних змін, так само і в інтерстиції цих ділянок нирки, включно з кровоносними судинами інтерстицію, сполучнотканинними волокнами й основною речовиною. Однак при застосуванні НАДФ з метою ймовірної корекції ЦД, так само, як і без корекції ЦД, ранні зміни в різних структурах нирки були виявлені за допомогою гістохімічного методу на основі забарвлення гістологічних зрізів бромфеноловим синім за методом Mikel Calvo. Саме ця методика була застосована як основна для виявлення можливих ефектів використання НАДФ при експериментальному ЦД.
Визначення коефіцієнта R/B у проведених дослідженнях показало ефективність застосованої методики. Цінність цього показника полягає у тому, що при ЦД від самого початку захворювання активізуються процеси окиснення та глікозилювання аміногруп білків, що призводить до змін у співвідношенні між карбоксильними групами та аміногрупами в білках. Отже, метод дозволяє оцінити найперші зміни диференційовано в різних мікроскопічних структурах (різних клітинах ниркових клубочків, ендотеліоцитах кровоносних судин, епітелії ниркових канальців, базальних мембранах тощо).
Відомо, що гіперглікемія може сприяти внутрішньоклітинним змінам окисно-відновного стану з активацією протеїнкінази С, що призводить до виснаження клітинного пулу НАДФ, який, у свою чергу, необхідний для генерації NO.
При використанні жирних кислот як альтернативного джерела енергії в організмі накопичуються кетонові тіла: ацетон, ацетоцтова кислота, β-оксимасляна кислота. Це пояснюється тим, що ацетил-КоА (кофермент А), що утворюється внаслідок окиснення, не може повністю вступити в цикл Кребса через недостатність останнього [5, 6]. Також через недостатність пентозофосфатного циклу знижується утворення відновленого НАДФ, який необхідний для альтернативного шляху перетворення ацетил-КоА знову на жирні кислоти. Таким чином, для ацетил-КоА залишається лише один шлях перетворень — на кетонові тіла. При ЦД 1-го типу, який характеризується інсуліновою недостатністю, швидкість утворення кетонових тіл значно перевищує швидкість їх розпаду й екскреції з сечею. При накопиченні кетонових тіл порушується кислотно-основна рівновага, розвивається метаболічний ацидоз [3, 9].
При застосуванні НАДФ ми отримали деяке покращення показників морфологічного стану окремих ниркових структур. Швидше за все, дія НАДФ відбувається не на рівні впливу на функціонування нефронів, а, ймовірно, на рівні обміну речовин, при якому спостерігається загальне зменшення виділення активних іонів водню.
Загалом структури нирок виявляють позитивну реакцію на введення НАДФ, що може бути пов’язане зі зниженням прямого ушкоджувального впливу гіперглікемії (можливо, за рахунок зменшення кількості глікозильованих білків) або внаслідок його прямого безпосереднього позитивного впливу на стан ендотеліоцитів.
Висновок
На підставі проведених гістохімічних досліджень можна констатувати, що застосовані методи корекції шляхом уведення НАДФ уражень аміногруп білків є частково ефективними щодо всіх структур нирок експериментальних тварин, де були виявлені зміни. Частковість ефекту полягає в тому, що стан аміногруп білків хоч і покращувався, але в основному не досягав рівня нормальних величин.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Скробонська Н.А. Діабетична нефропатія: деякі нетрадиційні фактори патогенезу, основні напрямки діагностики та лікування (огляд літератури та власні дані) / Н.А. Скробонська, Т.С. Цимбал // Сімейна медицина. — 2011. — № 4. — С. 18-22.
2. Alicic R.Z. Diabetic Kidney Disease: Challenges, Progress, and Possibilities / R.Z. Alicic, M.T. Rooney, K.R. Tuttle // Clinical journal of the American Society of Nephrology: CJASN. — 2017. doi: 10.2215/CJN.11491116.
3. Urushihara M. Role of the intrarenal renin-angiotensin system in the progression of renal disease / M. Urushihara, S. Kagami // Pediatric nephrology. — 2017. — Vol. 9. — P. 1471-1479. doi: 10.1007/s00467-016-3449-7.
4. Єфімов А.С. Патогенетичні маркери у розвитку діабетичної нефропатії у хворих на цукровий діабет типу 1, їх значення у ранній діагностиці та оптимізації лікування / А.С. Єфімов, Н.А. Скробонська, Т.С. Цимбал // Ендокринологія. — 2014. — № 19(4). — С. 295-296.
5. Mora-Fernández C. Diabetic kidney disease: from physio–logy to therapeutics / C. Mora-Fernández, V. Domínguez-Pimentel, M.M. de Fuentes, J.L. Górriz [et al.] // J. Physiol. — 2014. — Vol. 592(18). — Р. 3997-4012. doi: 10.1113/jphysiol.2014.272328.
6. Yang G.K. Renal hyperfiltration and systemic blood pressure in patients with uncomplicated type 1 diabetes mellitus / G.K. Yang, D.M. Maahs, B.A. Perkins, D.Z. Cherney // PLoS One. — 2013. — Vol. 7. — e68908. doi: 10.1371/journal.pone.0068908.
7. Zeni L. A more tubulocentric view of diabetic kidney di–sease / L. Zeni, A.G.W. Norden, G. Cancarini, R.J. Unwin // Journal of Nephrology. — 2017. doi: 10.1007/s40620-017-0423-9.
8. Srivastava T. Role of biomechanical forces in hyperfiltration-mediated glomerular injury in congenital anomalies of the kidney and urinary tract / T. Srivastava, G. Thiagarajan, U.S. Alon, R. Sharma [et al.] // Nephrology dialysis transplantation. — 2017. — Vol. 5. — P. 759-765. doi: 10.1093/ndt/gfw430.
9. Zhang C. Injury to the endothelial surface layer induces glomerular hyperfiltration rats with early-stage diabetes / C. Zhang, Y. Meng, Q. Liu, M. Xuan, L. Zhang [et al.] // J. Diabetes Res. — 2014. — 953740. doi: 10.1155/2014/953740.8.
10. Оліник О.Ю. Стан оксидантно-протиоксидантного гомеостазу та окислювальна модифікація білків у хворих на виразкову хворобу шлунка й дванадцятипалої кишки, поєднану з цукровим діабетом, у динаміці лікування / О.Ю. Оліник, О.І. Федів, І.С. Давиденко, О.В. Ушаков // Патологія. — 2010. — Т. 7, № 3. — С. 87-90.
11. Bequer L. Streptozotocin diabetogenic action in an experimental neonatal induction model / L. Bequer, T. Gómez, J.L. Molina // Biomedica. — 2016. — Vol. 36(2). — Р. 230-238.
12. Kolesnyk Yu.M. Current methods of the modeling of experimental diabetes mellitus type 2: a literature review / Yu.M. Kolesnyk, T.V. Ivanenko, A.V. Abramov, N.V. Kuzo // Pathologia. — 2016. — Vol. 36. — P. 10-14. doi: 10.14739/2310-1237.2016.1.72365.
13. Давиденко І.С. Гістохімічні особливості окиснювальної модифікації білків у клітинах ниркового клубочка при гострому післяінфекційному гломерулонефриті / І.С. Давиденко, О.М. Давиденко // Буковинський медичний вісник. — 2012. — Т. 16, № 3. — С. 106-108.
14. Давиденко І.С. Заходи стандартизації гістохімічної методики на окиснювальну модифікацію білків / І.С. Давиденко // Український медичний альманах. — 2013. — Т. 16, № 3. — С. 180-181.

/135-1.jpg)
/136-1.jpg)