Неуклонный рост распространенности сахарного диабета (СД) определяет актуальность ранней диагностики нарушений углеводного обмена. Общая структура нарушений углеводного обмена представлена СД 1-го типа, доля которого составляет 10–12 %, СД 2-го типа — 85–90 %, другими специфическими типами СД — менее 1 % [1, 2]. Распространенность гестационного диабета среди беременных женщин разных стран варьирует от 1 до 14 %, в среднем составляя 7 % [3]. Кроме диагностики СД важно выявление состояний, предшествующих СД 2-го типа (гипергликемия натощак, нарушение толерантности к глюкозе, эугликемическая резистентность к инсулину), своевременная коррекция которых позволяет отсрочить развитие СД и его осложнений.
В настоящее время большое внимание уделяется диагностике СД 2-го типа у детей. Скрининг СД 2-го типа у детей и подростков, согласно рекомендациям Американской диабетической ассоциации (ADA) 2018 г., должен быть выполнен детям старше 10 лет (при появлении признаков пубертата — в более раннем возрасте) с ожирением (ИМТ выше 95-го процентиля) или избыточной массой тела (ИМТ выше 85-го процентиля) при наличии как минимум одного дополнительного фактора риска СД. Этими факторами являются: гестационный диабет у матери, СД 2-го типа в семейном анамнезе, признаки инсулинорезистентности (дислипидемия, артериальная гипертензия, синдром поликистозных яичников). Скрининг повторяют 1 раз в 3 года, при увеличении массы тела — чаще.
С целью диагностики нарушений углеводного обмена используют следующие лабораторные показатели: гликемия натощак, пероральный глюкозотолерантный тест (ПГТТ), случайное определение гликемии, гликированный гемоглобин (HbA1с).
Натощак — это определение уровня гликемии утром после ночного голодания в течение 8–14 часов. Случайным считается определение гликемии в любое время суток вне зависимости от приема пищи.
Исследование уровня гликемии имеет ряд ограничений:
— значительные колебания уровня глюкозы в течение дня;
— слабая корреляция между единичным определенным уровнем глюкозы и реальным уровнем гликемии;
— влияние приема пищи, физической нагрузки, психоэмоционального состояния, приема лекарственных препаратов, заболеваний;
— необходимость регулярных и многократных измерений для адекватной оценки уровня гли–кемии;
— короткий период анализа; результат позволяет определить уровень глюкозы в крови «здесь и сейчас», но не дает возможности оценить колебания гликемии за длительный промежуток времени.
ПГТТ рекомендуется беременным, а также для уточнения диагноза при сомнительных значениях гликемии. Необходимо учитывать, что при скрининге воспроизводимость этого теста около 50 % [4]. Исследование проводится утром натощак на фоне не менее чем 3-дневного неограниченного питания (более 150 г углеводов в сутки) и обычной физической активности. Тесту должен предшествовать период ночного голодания 8–14 часов (пить воду разрешается). В последний вечерний прием пищи необходимо употребить 30–50 г углеводов. В период проведения теста не разрешается курение. Необходимо учитывать прием пациентом препаратов, повышающих уровень гликемии (глюкокортикоиды, тиреоидные гормоны, β-адреноблокаторы, тиазидные диуретики и др.), и по возможности сместить их прием на время после окончания ПГТТ. Временными противопоказаниями к проведению ПГТТ являются острые воспалительные или инфекционные заболевания, необходимость соблюдения строгого постельного режима, у беременных — ранний токсикоз. Абсолютными противопоказаниями к проведению ПГТТ являются манифестный СД, индивидуальная непереносимость глюкозы, заболевания желудочно-кишечного тракта, сопровождающиеся нарушением всасывания глюкозы (например, –обострение хронического панкреатита).
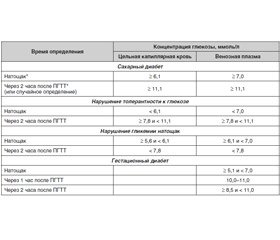
В норме уровень гликемии натощак в цельной капиллярной крови ниже 5,6 ммоль/л, в венозной плазме — ниже 6,1 ммоль/л; через 2 часа после ПГТТ и в цельной капиллярной крови, и в венозной плазме — ниже 7,8 ммоль/л.
Диагностические критерии СД и других нарушений углеводного обмена (ВОЗ, 1999–2013) представлены в табл. 1.
Интегрированное представление об уровне гликемии на протяжении длительного промежутка времени дает гликированный гемоглобин. Уровень HbA1c прямо пропорционален средней концентрации глюкозы в крови, эту взаимосвязь подтверждают многие исследования [5]. Зависимость между значениями HbA1с и уровнем гликемии (пре- и –постпрандиальным) представлена в табл. 2.
/61-1.jpg)
HbA1c позволяет оценить уровень гликемии у больного сахарным диабетом за 60–90 дней, предшествующих исследованию [6]. Использование HbA1c для диагностики СД было предложено ADA в 2010 г. и рекомендовано ВОЗ с 2011 г. Уровень HbA1c ≥ 6,5 % является диагностическим критерием СД, но уровень HbA1c 6,0–6,4 % не исключает диагноз СД при гипергликемии. При этом на этапе установления диагноза определение данного показателя обязательно, так как на основании уровня HbA1c принимается решение о характере и объеме сахароснижающей терапии. Диапазон значений гликированного гемоглобина от 5,5 до 6,4 %, согласно рекомендациям AACE/ACE, может быть использован для скрининга предиабета [7].
Определение HbA1c обладает рядом преимуществ в сравнении с определением уровня гликемии и ПГТТ: низкой биологической вариабельностью показателя, возможностью определения в любое время независимо от приема пищи, физического и психоэмоционального состояния пациента.
Важно также, что в образце крови, взятом для анализа, уровень HbA1c относительно стабилен [8]. Вариабельность этого показателя при повторном заборе составляет менее 2 %, а для глюкозы плазмы натощак — 12–15 % [9, 10].
Показания для исследования уровня HbA1c: скрининг и диагностика СД, мониторинг течения СД и лечения больных, определение степени компенсации СД, скрининг гестационного диабета, диагностика предиабета. ADA установила диагностические критерии предиабета — уровень HbA1c 5,7–6,4 % [11].
У взрослых, не страдающих СД и не имеющих симптомов гипергликемии, показаниями для исследования уровня HbA1c являются:
— избыточная масса тела (ИМТ > 25 кг/м2) при наличии дополнительных факторов риска (артериальная гипертензия, дислипидемия и др.);
— возраст старше 45 лет. При нормальном результате анализа повторное тестирование следует проводить с интервалом не более 3 лет;
— эндокринопатии (болезнь и синдром Кушинга, акромегалия, феохромоцитома и др.), сопровождающиеся патологической гиперпродукцией контринсулярных гормонов.
Контринсулярными гормонами являются: глюкагон, адреналин, соматотропный гормон, глюкокортикоиды (ГК), тиреоидные гормоны. Патогенез нарушений углеводного обмена при избыточной продукции контринсулярных гормонов обусловлен инсулинорезистентностью периферических тканей, снижением секреции инсулина, усилением глюконеогенеза и гликогенолиза в печени и повышением абсорбции глюкозы в кишечнике. При этом инсулин является единственным гормоном, снижающим глюкозу в крови.
При гиперкортицизме, сопровождающемся ги–пер–продукцией глюкокортикоидов, нарушения углеводного обмена (до 80 %) связаны со стимулирующим действием ГК на глюконеогенез и формированием инсулинорезистентности. Наиболее частыми нарушениями углеводного обмена при данной патологии являются нарушенная толерантность к глюкозе или нарушенная гликемия натощак [12]. Симптоматический (стероидный) сахарный диабет развивается у 10–20 % больных. Его течение характеризуется инсулинорезистент–ностью, сопровождающейся гиперинсулинемией, и отсутствием склонности к кетоацидозу. Эффективное лечение гиперкортицизма приводит к снижению уровня гликемии при стероидном диабете. Развитие стероидного диабета возможно и при экзогенном поступлении ГК (лечение бронхиальной астмы, аутоиммунных заболеваний и др.), при этом он проявляется в легкой форме и исчезает после –отмены ГК.
Транзиторной гипергликемией (иногда с глюкозурией) может сопровождаться феохромоцитома. Причина нарушения углеводного обмена при данной патологии — гиперпродукция катехоламинов, которые подавляют выработку инсулина и стимулируют синтез глюкагона, усиливают гликолиз, распад гликогена, в мышцах усиливают анаэробный глюконеогенез. Хотя серьезного влияния изменение гликемического статуса на прогноз для пациента не оказывает.
Акромегалия — нейроэндокринное заболевание, обусловленное гиперпродукцией соматотропного гормона у людей с закончившимся физиологическим ростом. Патогенез гипергликемии при акромегалии обусловлен комплексом изменений, связанных, с одной стороны, с развитием инсулинорезистентности (печеночной и периферической) [13], с другой — с гиперинсулинемией [14]. Разные патогенетические механизмы обеспечивают различие в клинических проявлениях и течении сахарного диабета при акромегалии, соответственно, и в прогнозе. Частота нарушений углеводного обмена при акромегалии, в том числе и вторичный СД, по данным различных исследований, составляет 10–68 % [15, 16]. С увеличением длительности течения акромегалии возрастает заболеваемость СД (менее 8 лет — 40,6 % больных, 9–15 лет — 52,2 %, более 15 лет — 60,5 %) [17].
При гипертиреозе ускоряется распад гликогена и поступление глюкозы в кровоток, при этом продукты гликолиза окисляются хорошо и кетоз, как правило, отсутствует. Гипергликемия носит транзиторный характер, в связи с чем не оказывает влияния на прогноз для пациента и чаще всего не требует специальной коррекции. Важно помнить, что тиреотоксикоз у пациентов с СД, предшествовавшим повышению функции щитовидной железы, имеет более легкое течение за счет ложного снижения уровней свободного тироксина и свободного трийодтиронина.
Нарушение метаболизма глюкозы выявляется при всех формах гиперпаратиреоза [18]. Избыток паратгормона как при первичном, так и при вторичном гиперпаратиреозе может привести к инсулинорезистентности и нарушению секреции инсулина. При ПГПТ, согласно имеющимся в настоящее время данным, это проявляется большей частотой развития СД 2-го типа и НТГ.
Таким образом, наличие эндокринного заболевания (гиперкортицизм, акромегалия, фео–хромоцитома, гиперпаратиреоз, гипертиреоз), сопровождающегося избыточной продукцией контринсулярных гормонов, предполагает необходимость диагностики вторичного СД. С другой стороны, при сахарном диабете, особенно с плохим гликемическим контролем или при наличии сопутствующих клинических симптомов, характерных для вышеуказанных заболеваний, проведение целенаправленных скрининговых тестов (используемых для выявления эндокринопатий) даст возможность заподозрить вероятную вторичную этиологию гипергликемии. При правильном диагностическом подходе у 2–5 % пациентов с ожирением и СД 2-го типа с плохим контролем гликемии выявляется субклинический гиперкортицизм [19]. А при проведении скрининга для выявления гиперсоматотропинемии субклиническая акромегалия составляет 1,3 случая на 1000 пациентов с СД 2-го типа [20].
Для ранней диагностики эндокринопатий в настоящее время разработаны скрининговые тесты, которые обладают достаточно высокой чувствительностью и специфичностью. Для диагностики гиперкортицизма скрининговыми тестами являются: дексаметазоновый (1 мг) супрессивный тест, определение суточной экскреции кортизола с мочой, ночное определение кортизола в слюне [21, 22]. С учетом высокой вариабельности секреции кортизола и определенных ограничений лабораторных тестов в настоящее время с целью выявления синдрома Кушинга рекомендуется использование как минимум двух тестов. Распространенность субклинических форм гиперкортицизма — около 8 случаев на 10 000 населения — не дает возможности ориентироваться на клинические проявления данного заболевания [23].
Оптимальным тестом для скрининга акромегалии считается инсулиноподобный ростовой фактор (ИРФ-1), который отражает секрецию гормона роста за предшествующий день и не подвержен значительным колебаниям. Для подтверждения гиперсоматотропинемии достаточно однократного выявления повышенного уровня ИРФ-1 по отношению к референтным значениям для данного пола и возраста. Определение уровня соматотропного гормона не всегда достоверно. Примерно у 17 % пациентов уровень гормона роста в сыворотке крови натощак остается в пределах референтных значений [24].
В качестве скринингового теста для диагностики тиреотоксикоза рекомендуется тиреотропный гормон (ТТГ). При выборе данного теста врач должен учитывать показатель аналитической чувствительности тест-системы для определения ТТГ. В некоторых анализаторах аналитическая чувствительность тест-системы достигает 0,002 МЕ/л, при этом функциональная чувствительность составляет 0,01 МЕ/л [25]. Такая чувствительность дает возможность практически во всех случаях диагностировать начальные стадии тиреоидной дисфункции.
Скрининг гиперпаратиреоза — определение уровня ионизированного кальция крови. Если учесть наличие нормокальциемического варианта гиперпаратиреоза, то в качестве первичной диагностики оптимальным является сочетанное определение ионизированного кальция крови с паратгормоном. Особенно актуально проведение данного исследования у пациентов группы риска по первичному гиперпаратиреозу — больных с желчнокаменной болезнью, уролитиазом, язвенной болезнью желудка и/или двенадцатиперстной кишки, гипертонической болезнью и др.
Свободные метанефрины плазмы крови и –конъюгированные метанефрины мочи — скрининговые тесты для диагностики феохромоцитомы [26]. Уровень метилированных производных катехоламинов (метанефрины, норметанефрины) отражает суточную опухолевую активность феохромоцитомы. Диагностическая значимость данного лабораторного теста в том, что уровень метанефринов и норметанефринов не зависит от активности клинических проявлений феохромоцитомы, что дает возможность выявлять «немые» и малосимптомные катехоламинпродуцирующие опухоли.
Таким образом, гликемический скрининг и скрининг эндокринопатий, сопровождающихся гиперсекрецией контринсулярных гормонов, должны сопутствовать друг другу. Это позволит выявить вторичные формы сахарного диабета и максимально компенсировать гликемический статус пациента.
Конфликт интересов. Не заявлен.
Список литературы
1. Тронько Н.Д. Государственная программа «Сахарный диабет» / Н.Д. Тронько, Б.Н. Маньковский // Лікування та діагностика. — 2009. — № 1. — С. 58-59.
2. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. — М., 2000. — 631 c.
3. Tracy L. Gestational Diabetes Mellitus / L. Tracy, А. Setji, J. Brown [et al.] // Clin. Diabetes. — 2005. — Vol. 23, № 1. — Р. 17-24.
4. McDonald G.W. Reproducibility of the oral glucose tole–rance test / G.W. McDonald, G.F. Fisher, C. Burnham // Diabetes. — 1965. — Vol. 14. — Р. 473-480.
5. Гнуди Л. Результаты и влияние исследований ACCORD и ADVANCE / Л. Гнуди // Diabetes Voice. — 2009. — Vol. 54, № 1. — С. 29-32.
6. Лихоносова А.П. Гликозилированный гемоглобин в диагностике осложнений сахарного диабета / А.П. Лихоносова, Н.П. Лихоносов, О.Г. Кузнецова // Новости медицины и фармации. — 2010. — № 9 (325). — С. 128-130.
7. American Association of Clinical Endocrinologists and American College of Endocrinology — clinical practice guidelines for developing a diabetes mellitus comprehensive care plan — 2015 // Endocr. Pract. — 2015. — Vol. 21 (Suppl. 1). — P. 1-87. https://doi.org/10.4158/EP15672.GL.
8. Little R.R. Effects of sample storage conditions on glycated hemoglobin measurement: evaluation of five different high performance liquid chromatography methods / R.R. Little, C.L. Rohl–fing, A.L. Tennill [et al.] // Diabetes Technologies & Therapeutics. — 2007. — Vol. 9, № 1. — P. 36-42.
9. Ollerton R.L. Day-to-day variability of fasting plasma glucose in newly diagnosed type 2 diabetic subjects / R.L. Ollerton, R. Playle, K. Ahmed // Diabetes Care. — 1999. — Vol. 22, № 3. — P. 394-398.
10. Petersen P.H. Consequences of bias and imprecision in measurements of glucose and hba1c for the diagnosis and prognosis of diabetes mellitus / P.H. Petersen, L.G. Jоrgensen, I. Brandslund // Scandinavian Journal of Clinical and Laboratory Investigation. — 2005. — Vol. 240. — P. 51-60.
11. Lenters-Westra E. Six of eight hemoglobin A1c point-of-care instruments do not meet the general accepted analytical performance criteria / Е. Lenters-Westra, R.J. Slingerland // Clinical Chemistry. — 2010. — Vol. 56, № 1. — P. 44-52.
12. Кирилюк М.Л. Диагностика и лечение гипофизарного синдрома Кушинга // Міжнародний ендокринологічний журнал. — 2014. — № 6 (62). — С. 182-193.
13. Coculescu M. Insulin resistance and insulin secretion in non-diabetic acromegalic patients / М. Coculescu, D. Niculescu, R. Lichiardopol [et al.] // Exp. Clin. Endocrinol. Diabetes. — 2007. — Vol. 115, № 5. — P. 308-316.
14. Roelfsema F. Therapeutic options in the management of acromegaly: focus on lanreotide / Roelfsema F., Biermasz N., Pereira A. [et al.] // Biologics. — 2008. — Vol. 2 (3). — Р. 463-479.
15. Colao A. Systemic complications of acromegaly: epidemiology, pathogenesis, and management / А. Colao, D. Ferone, P. Marzullo [et al.] // Endocr. Rev. — 2004. — Vol. 25, № 1. — P. 102-152.
16. Biering H. Prevalence of diabetes in acromegaly and Cushing syndrome / H. Biering, G. Knappe, H. Gerl [et al.] // Acta Med. Austriaca. — 2000. — Vol. 27, № 1. — P. 27-31.
17. Nabarro J. Acromegaly / J. Nabarro // Clin. Endocrinol. (Oxf). — 1987. — Vol. 26, № 4. — P. 481-512.
18. Procopio M. Derangement of glucose metabolism in hyperparathyroidism / М. Procopio, G. Boretta // J. Endocrinol. Invest. — 2003. — Vol. 26, № 1. — Р. 1136-1142.
19. Catargi B. Occult Cushing’s syndrome in type-2 diabetes / В. Catargi, V. Rigalleau, A. Poussin [et al.] // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88, № 12. — Р. 5808-5813.
20. Rosario P. Frequency of acromegaly in adults with diabetes or glucose intolerance and estimated prevalence in the general population / Р. Rosario // Pituitary. — 2011. — Vol. 14, № 3. — Р. 217-221.
21. The Diagnosis of Cushing’s syndrome: аn Endocrine Society clinical practice guideline / L.K. Nieman [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, № 5. — P. 1526-1540.
22. Автоматизированный электрохемилюминесцент–ный метод определения кортизола в слюне для диагностики эндогенного гиперкортицизма среди пациентов с ожирением / Е.Ж. Белая [и др.] // Ожирение и метаболизм. — 2011. — № 27 (2). — С. 56-63.
23. Распространенность субклинического гиперкортицизма среди больных с сахарным диабетом 2-го типа и алиментарным ожирением / А.В. Древаль [и др.] // Проблемы эндокринологии. — 2014. — № 1. — С. 9-17.
24. Акромегалия и гигантизм / Караченцев Ю.И. [и др.]. — К.: Старт-98, 2010. — 132 с.
25. Jonklaas J. Correlations of Free Thyroid Hormones Measured by Tandem Mass Spectrometry and Immunoassay with Thyroid-Stimulating Hormone across 4 Patient Populations / J. Jonklaas, N. Kahric-Janicic, O. Soldin [et al.] // Clin. Chem. — 2009. — Vol. 55, № 7. — Р. 1380-1388.
26. Pheochromocytoma and Paraganglioma: An Endocrine Society Clinical Practice Guideline / J. Lenders [et al.] // J. Clin. Endocr. Metab. — 2014. — Vol. 99, № 6. — Р. 1915-1942.

/60-1.jpg)
/61-1.jpg)