Резюме
Наведено опис клінічного випадку ектопічного синдрому Кушинга у чоловіка 39 років. Характерні ознаки гіперкортицизму (ожиріння, артеріальна гіпертензія, стрії, витончення кінцівок, міастенія, цукровий діабет, гіпокаліємія) розвивалися протягом 1,5 року. Однак діагноз синдрому Кушинга був виставлений після госпіталізації з приводу артеріальної гіпертензії. Гормони: адренокортикотропний гормон (АКТГ) — 110 пг/мл (норма — 7–69), добова екскреція кортизолу з сечею — 3400 мкг/добу (норма — 28,5–213,7). Магнітно-резонансна томографія гіпофіза, мультизрізова спіральна комп’ютерна томографія (МСКТ) органів черевної порожнини і сканування з 111In-октреотидом пухлини не виявили. Тільки після МСКТ органів грудної клітки був виявлений карциноїд лівої легені. Хворий був прооперований, після чого протягом двох місяців практично видужав. Патогістологічний висновок: високодиференційована нейроендокринна пухлина. Рівень експресії в клітинах цитоплазматичних маркерів нейроендокринного диференціювання: синаптофізин (+), хромогранін А (+), СD56 (–), CD68 (–). Індекс проліферації Ki 67 становив 1 %. Гормони: АКТГ крові — 34 пг/мл, кортизол крові — 13,69 мкг/дл (норма — 6,2–19).
Представлено описание клинического случая эктопического синдрома Кушинга у мужчины 39 лет. Характерные признаки гиперкортицизма (ожирение, артериальная гипертензия, стрии, истончение конечностей, миастения, сахарный диабет, гипокалиемия) развивались на протяжении 1,5 года. Однако диагноз синдрома Кушинга был выставлен после госпитализации по поводу артериальной гипертензии. Гормоны: адренокортикотропный гормон (АКТГ) — 110 пг/мл (норма — 7–69), суточная экскреция кортизола с мочой — 3400 мкг/сут (норма — 28,5–213,7). Магнитно-резонансная томография гипофиза, мультиспиральная компьютерная томография (МСКТ) органов брюшной полости и сканирование с 111In-октреотидом опухоли не выявили. Только после МСКТ органов грудной клетки был обнаружен карциноид левого легкого. Больной был прооперирован, после чего на протяжении двух месяцев практически выздоровел. Патогистологическое заключение: высокодифференцированная нейроэндокринная опухоль. Уровень экспрессии в клетках цитоплазматических маркеров нейроэндокринной дифференцировки: синаптофизин (+), хромогранин А (+), СD56 (–), CD68 (–). Индекс пролиферации Ki 67 составил 1 %. Гормоны: АКТГ крови — 34 пг/мл, кортизол крови — 13,69 мкг/дл (норма — 6,2–19).
The article describes a clinical case of ectopic Cushing’s syndrome in a man aged 39 years. Characteristic signs of hypercorticism (obesity, arterial hypertension, striae, thinning of the extremities, myasthenia, diabetes mellitus, hypokalemia) developed over a period of 1.5 years. However, the diagnosis of Cushing’s syndrome was established after hospitalization for arterial hypertension. Hormones: adrenocorticotropic hormone (ACTH) — 110 pg/ml (7–69), daily urinary cortisol excretion — 3,400 μg/24 h (28.5–213.7). Magnetic resonance imaging of the pituitary gland, multislice helical computed tomography (MHCT) of the abdominal cavity organs and [111In-DTPA-D-Phe1]-octreotide scintigraphy have not revealed a tumor. Only after the MHCT of the thoracic organs, carcinoid of the left lung was found. The patient was operated, and then during 2 months he almost recovered. Pathohistological conclusion: well-differentiated neuroendocrine tumor. Level of cell expression of cytoplasmic markers of neuroendocrine differentiation: synaptophysin (+), chromogranin A (+), CD56 (–), CD68 (–). The proliferation index Ki 67 was 1 %. Hormones: ACTH — 34 pg/ml, serum cortisol — 13.69 μg/dl (6.2–19).
Введение
«Синдром Кушинга» (СК) — термин, которым обозначают состояние избытка глюкокортикоидов любого происхождения. Существуют четыре главные причины синдрома Кушинга: экзогенный (ятрогенный), гипофизарный (АКТГ-зависимый) (68–70 %), надпочечниковый (АКТГ-независимый) (17 %) и эктопический (10–15 %) [1].
Если 80 % больных с гипофизарным СК — лица женского пола, то эктопический СК чаще встречается у мужчин. Гипофизарный СК чаще развивается в возрасте 20–40 лет, в то время как эктопический — в 40–60 лет. Таким образом, у мужчин с СК существует определенный риск наличия экстрагипофизарных нейроэндокринных опухолей, особенно в среднем и старшем возрасте.
Из вариантов эктопической продукции АКТГ один обусловлен злокачественными опухолями, чаще легких. У таких больных имеются явные признаки метастазирующей опухоли: потеря массы тела, гипертензия, гипокалиемия и гиперпигментация. Другая разновидность обусловлена более медленно растущими нейроэндокринными опухолями, обозначаемыми как карциноиды (бронхов, тимуса, поджелудочной железы). Больные с карциноидными опухолями, продуцирующими АКТГ, могут иметь такие же клинические проявления и биохимические сдвиги, что и у больных с гипофизарным СК [2].
Таким образом, дифференциальная диагностика между гипофизарным СК и карциноидной опухолью в определенной степени затруднена. Смертность среди пациентов с СК значительно повышена, что обычно связано с сердечно-сосудистыми заболеваниями или инфекциями, и до 50 % больных умирают в первые 5 лет от манифестации заболевания. В связи с изложенным представляется актуальным вопрос правильной диагностики и своевременного оперативного лечения эктопического СК.
Описание случая
Представляем анализ клинического случая АКТГ-продуцирующего карциноида легкого у мужчины. Пациент Л., 39 лет, поступил в отделение общей эндокринной патологии Украинского научно-практического центра эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины 28.08.2014 с жалобами на общую слабость, утомляемость, выраженную мышечную слабость, отечность конечностей, изменения внешности, прибавку в весе, появление растяжек на животе, артериальную гипертензию.
Анамнез заболевания. Состояние больного ухудшалось постепенно в течение последних 1,5 года с момента появления вышеописанных жалоб. В августе 2014 г. лечился по месту жительства по поводу гипертонической болезни, где впервые и был выставлен диагноз СК и вторичного (стероидного) сахарного диабета. Проведенная там ночная дексаметазоновая проба (1 мг) показала отрицательный результат: кортизол крови до пробы составлял 39,1 мкг/дл (норма — 6,02–19,4), после пробы — 41,1 мкг/дл. С 22.08.2014 по 26.08.2014 находился в отделении анестезиологии в палате интенсивной терапии в связи с выраженной гипокалиемией.
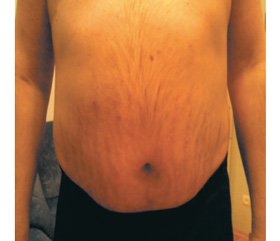
Анамнез жизни. Гипертоническая болезнь в течение 12 лет, рожистое воспаление правой голени (2014 г.). Аллергологический анамнез: отягощен (непереносимость йода). Объективно: при осмотре состояние средней тяжести. Пациент повышенного питания, абдоминальный (диспластический) тип ожирения с атрофией мышц и истончением конечностей. Кожа истончена, плетора лица, стрии на животе широкие розового цвета (рис. 1). Артериальное давление (АД) на правой руке 130/90 мм рт.ст., на левой — 130/95 мм рт.ст. Пульс — 88 в 1 мин, удовлетворительных свойств. Левая граница сердца смещена влево на 1 см. Тоны сердца приглушены, ритм правильный, акцент 2-го тона на аорте. Над легкими дыхание везикулярное, перкуторно тон ясный легочной. Частота дыхания — 18 в 1 мин. Живот мягкий, безболезненный. Симптомы раздражения брюшины негативные. Печень выступает из-под края реберной дуги на 2 см. Симптом Пастернацкого отрицательный с обеих сторон. Мочеиспускание свободное. Стул регулярный. Щитовидная железа не увеличена.
/103-1.jpg)
Данные лабораторного и инструментального обследования. Кальций ионизированный — 1,32–1,44–1,46–1,42 ммоль/л, калий — 2,43–4,0–4,4–3,69 ммоль/л, натрий — 140–154–151–140 ммоль/л, мочевина — 10,68–7,5 ммоль/л, креатинин — 0,077–0,074 ммоль/л. Гликемический профиль: 7,8–8,9 ммоль/л, 6,1–6,9 ммоль/л. Общий анализ крови: гемоглобин — 135 г/л, эритроциты — 3,97 • 1012/л, гематокрит — 38,8, лейкоциты — 7,7 • 109/л, п/я — 1 %, с/я — 57 %, лимфоциты — 28 %, моноциты — 10 %, эозинофилы — 3 %, базофилы — 1 %, тромбоциты — 162 • 109/л, скорость оседания эритроцитов (СОЭ) — 8 мм/ч. Гормоны: АКТГ — 110 пг/мл (7–69), суточная экскреция кортизола с мочой — 3400 мкг/сут (28,5–213,7), паратгормон — 75,5 пг/мл (15–67). Электрокардиография: ритм синусовый правильный, частота сердечных сокращений — 59 уд/мин, нормальное положение электрической оси сердца. Диффузные метаболические изменения миокарда, перегрузка левого предсердия. Эхокардиоскопия (ЭхоКС): размеры полостей сердца в пределах нормы. Умеренно выраженная гипертрофия миокарда. Сократимость и насосная функция левого желудочка миокарда в норме, фракция выброса — 65 %. Нарушения функции клапанного аппарата сердца не выявлено.
Мультиспиральная компьютерная томография (МСКТ) органов брюшной полости: правый надпочечник Y-образной формы, ножки максимальной шириной до 3,5–4,5 мм, в теле определяется округлое образование с четкими неровными контурами, размерами 12 × 9 × 11 мм, плотностью 22–24 НU. На границе тела и латеральной ножки визуализируется участок округлой формы размером до 3 мм, по плотности равный жировой ткани. Левый надпочечник Y-образной формы, ножки максимальной шириной до 5,5 мм, дополнительных образований не выявлено. Почки расположены обычно, правая размерами 93 × 60 × 76 мм. В области верхнего полюса определяется многокамерное кистозное образование, общими размерами 64 × 42 × 65 мм. Увеличенные лимфоузлы в брюшной полости не определяются. Костно-деструктивных изменений поясничного отдела позвоночника, остеопороза не выявлено. Заключение: КТ-признаки дополнительного образования правого надпочечника, миелолипомы правого надпочечника, кист правой почки, мочекаменной болезни, жирового гепатоза, хронического панкреатита. Магнитно-резонансная томография (МРТ): объемной очаговой патологии в головном мозге не выявлено. МРТ-признаки атрофического процесса. Гипофиз расположен обычно, воронка гипофиза — по средней линии. При динамическом исследовании после внутривенного введения контраста (томовист) отмечается равномерное контрастирование гипофиза. Убедительных данных в пользу микроаденомы гипофиза не получено.
Консультация кардиолога: артериальная гипертензия II стадии (гипертрофия левого желудочка по данным ЭхоКС) смешанного генеза 2-й степени, риск высокий, сердечная недостаточность I с сохраненной систолической функцией (фракция выброса — 65 %). Нейрохирург: в оперативном лечении на гипофизе отказано в связи с сомнительными изменениями на МРТ в пользу микроаденомы. Эндокринный хирург: показаний к операции на надпочечниках нет. Рекомендован прием верошпирона и кетоконазола (1200 мг/сут).
Учитывая высокий уровень АКТГ и кортизола, быстрое нарастание клинической симптоматики, было сделано предположение об АКТГ-эктопированной опухоли. Однако в связи с аллергией пациента на йод МСКТ легких с контрастированием сделано не было. Поэтому больному была проведена сцинтиграфия с октреотидом, меченным радионуклидом 111In, к рецепторам соматостатина. Сцинтиграфия всего тела в ранней фазе через 1 час и в отсроченный период через 3 часа, участков патологической фиксации туморотропного радиофармацевтического препарата не выявлено, распределение препарата соответствует физиологическому. При однофотонной эмиссионной компьютерной томографии патологического накопления препарата также не было выявлено.
Больному был выставлен диагноз «синдром Кушинга (с наибольшей вероятностью гипофизарного происхождения)». Рекомендовано: лозартан, бисопролол, конкор, верошпирон, аторвастатин, ацетилсалициловая кислота, калия хлорид, кетоконазол, холекальциферол, омепразол, метформин с контролем уровня паратгормона крови, кортизола в суточной моче.
Больной был направлен в одну из клиник Израиля, где на МСКТ была обнаружена опухоль в нижней доле левого легкого (карциноид). 06.11.2014 больной прооперирован (уже в Киеве), удален карциноид нижней доли левого легкого. Патогистологическое заключение: для иммуногистохимического определения иммунофенотипа опухолевых клеток была использована панель моноклональных и поликлональных антител. Заключение: высокодифференцированная нейроэндокринная опухоль. Уровень экспрессии в клетках цитоплазматических маркеров нейроэндокринной дифференцировки: синаптофизин (+), хромогранин А (+), СD56 (–), CD68 (–). Индекс пролиферации Ki 67 составил 1 %.
В послеоперационном периоде у больного появились признаки надпочечниковой недостаточности, и 13.11.2014 он был повторно госпитализирован в стационар отделения общей эндокринной патологии центра для подбора заместительной гормональной терапии (ЗГТ). Учитывая небольшой срок заболевания (1,5 года), оперативное удаление эктопированной АКТГ-продуцирующей опухоли, было сделано заключение о транзиторном характере надпочечниковой недостаточности. Данные лабораторного обследования. Кальций ионизированный — 1,23–1,21 ммоль/л, калий — 3,93–3,87 ммоль/л, натрий — 137–140 ммоль/л, глюкоза крови (венозная) — 7,1 ммоль/л (13.11.2014), кортизол крови — 4,77 мкг/дл (норма — 6,2–19,4), суточная экскреция кортизола с мочой — 191 мкг/сут (норма — 28,5–213,7) (18.11.2014). В отделении больной получал заместительную (гидрокортизон) и симптоматическую терапию. В результате проведенного лечения надпочечниковая недостаточность переведена в стадию медикаментозной субкомпенсации. При выписке пациенту рекомендовано постепенное снижение дозы глюкокортикоидов. 10.12.2014 ЗГТ была отменена. Самочувствие больного улучшилось. Отмечается регрессирование клинических проявлений СК (рис. 2): уменьшился в размерах живот, стрии побледнели, значительно исчезла мышечная слабость, стабилизировалось АД. Отмечена и положительная лабораторная динамика. Данные лабораторного обследования в динамике (11.12.14–24.12.2014): АКТГ — 55–34 пг/мл (норма — 7–69), кортизол крови — 11,5–5,5–8,1–13,69 мкг/дл (норма — 6,2–19). Кальций ионизированный — 1,59 ммоль/л, фосфор неорганический — 1,12 ммоль/л, калий — 4,0 ммоль/л, натрий — 141 ммоль/л. Общий анализ крови: гемоглобин — 135 г/л, эритроциты — 4,8 • 1012/л, гематокрит — 40,8, лейкоциты — 7,1 • 109/л, п/я — 1 %, с/я — 44 %, лимфоциты — 40 %, моноциты — 11,1 %, эозинофилы — 3 %, базофилы — 0,7 %. Тромбоциты — 162 • 109/л. СОЭ — 27 мм/ч.
/104-1.jpg)
Обсуждение
Данный случай поучителен тем, что при окончательной неправильной диагностике генеза АКТГ-зависимого гиперкортицизма исход для пациента мог быть печальным. Конечно, пациенту необходимо было поставить диагноз АКТГ-зависимого СК без указания вероятности какого-либо варианта. В случае операции на гипофизе у пациента не отмечалось бы регрессирование заболевания и могли наблюдаться послеоперационные осложнения, что привело бы к нарушению качества жизни пациента. В нашем случае в итоге после удаления карциноида фактически произошло выздоровление по поводу данного тяжелого эндокринного заболевания.
Сцинтиграфия с октреотидом, меченным радионуклидом 111In, позволяет диагностировать опухоли, не визуализирующиеся другими методами, может использоваться с дифференциально-диагностической целью в дополнение к МСКТ, а также установить рецепторный статус опухоли, в определенной степени позволяя прогнозировать биохимический и клинический ответ на лечение октреотидом.
Октреотид — синтетический октапептид, являющийся аналогом соматостатина и обладающий сходными с ним фармакологическими эффектами, но значительно большей продолжительностью действия. Фармакологическая активность октреотида обусловлена его способностью связываться с рецепторами соматостатина (S2 и S5), находящимися на поверхности клеток. 111In-октреотид активно связывается с теми же рецепторами соматостатина, что и обычный октреотид. Клетки ряда опухолей и их метастазы имеют высокую плотность рецепторов соматостатина, существенно превышающую их плотность на клетках нормальных тканей, что позволяет визуализировать эти опухоли, используя препарат 111In-октреотид. Распространенность рецепторов соматостатина в карциноиде составляет 96 % при in vivo сцинтиграфии.
В одной из работ было обследовано 30 пациентов с карциноидом, и только у 27 из них было обнаружено патологическое поглощение радиофарм–препарата (111In-октреотид) при сцинтиграфии, что составляет 90 % [5]. В другом исследовании сцинтиграфия соматостатиновых рецепторов с использованием 111In меченного аналога соматостатина октреотида ([111In-DTPA-D-Phe1]-октрео–тид) была выполнена у 40 пациентов с карциноидными опухолями. У 31/40 пациента (77,5 %) сцинтиграфия оказалась положительной по сравнению с 33/40 пациентами (82,5 %), опухоли которых были выявлены при МСКТ-сканировании [1]. Чувствительность и специфичность сцинтиграфии с 111In-октреотидом при обнаружении первичной опухоли (карциноид) и метастазов составляет, по данным J. Banzo, 72 и 84 % соответственно [3]. Возможно, в нашем случае это исследование не дало позитивного результата ввиду отсутствия экспрессии рецепторов к октреотиду либо чувствительности к нему.
Поэтому при аллергии на йодсодержащие препараты МСКТ легких в любом случае является обязательным первичным методом дифференциальной диагностики АКТГ-зависимого СК (что и было дополнительно сделано в клинике в Израиле), чувствительность которого достигает 94 %.
Длинный дексаметазоновый тест (HDDT) уступает по чувствительности МСКТ или сцинтиграфии с 111In-октреотидом, поэтому проводить его обязательно нужно при сомнительных (спорных) результатах МРТ гипофиза (подозрение/наличие признаков микроаденомы гипофиза, МРТ только 1,5Т или 3Т) либо при позитивном тесте с кортиколиберином (CRH). В случае негативного теста с CRH проводится катетеризация нижних каменистых синусов (можно на фоне стимуляции CRH) с определением градиента АКТГ центр/периферия (при эктопии менее 3,0 или (–)) [6, 7].
Выводы
При дифференциальной диагностике АКТГ-зависимого СК на первичном этапе предпочтение следует отдавать МСКТ органов грудной клетки.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи, а также сообщают о взятии информированного согласия у пациента на публикацию данных в научном медицинском издании.

/103-1.jpg)
/104-1.jpg)