Вступ
Цукровий діабет (ЦД) у всьому світі є одним із поширених хронічних захворювань та глобальною медичною соціальною й економічною проблемою сучасності, в основному через осіб, які страждають від ЦД типу 2 [1].
Діабетична нейропатія, що є найбільш тяжким та інвалідизуючим ускладнення ЦД, якому піддаються пацієнти як з першим, так і з другим типом захворювання, у наш час перетворилася на мультидисциплінарну проблему, яка близька не лише ендокринологам, а й неврологам, а також хірургам. При цьому йдеться насамперед про периферичну форму діабетичної нейропатії, яка набагато більшою мірою, ніж центральна нейропатія, знижує якість життя хворих і погіршує перебіг ЦД.
Оцінка поширеності діабетичної дистальної симетричної полінейропатії (ДСПН) серед хворих на ЦД типу 2 широко варіює в різних дослідженнях (понад 50 % у Рочестерському дослідженні та менше 30 % у дослідженнях індійської популяції) [2, 3]. Така велика різноманітність отриманих результатів може бути зумовлена використанням різних діагностичних критеріїв, особливо якщо не застосовувались електронейрофізіологічні, що дозволяють виявляти субклінічну форму ДСПН. У такому разі слід орієнтуватися тільки на дані досліджень, в яких використовувалися міжнародні критерії діагностики ДСПН, що обов’язково включають результати електронейроміографічного (ЕНМГ) тестування [4–6].
З іншого боку, не можна виключити зв’язок великої варіабельності поширеності ДСПН у різних популяціях хворих на ЦД із впливом генетичних факторів, які «призводять» до розвитку ДСПН або, навпаки, «захищають» від її формування. Про роль генетичних факторів свідчить і кластерний феномен діабетичної полінейропатії, коли розвиток цього пізнього ускладнення в одного члена сім’ї, який хворіє на ЦД, призводить до зростання ризику його розвитку в інших членів сім’ї від 20 до 80 % [7].
Низка клінічних досліджень свідчить про те, що розвиток діабетичної нейропатії визначається не тільки тривалістю й якістю контролю ЦД, тобто рівнем його компенсації, а й генетичними факторами. На користь останніх свідчить розвиток ДСПН у де–яких хворих у дуже короткі терміни після маніфестації ЦД, в той час як у багатьох хворих і після 20 років перебігу ЦД не вдається виявити ані субклінічну, ані симптомну форму ДСПН [8].
Вираженим маркером наявності генетичної схильності до будь-якого захворювання є етнічна залежність до її формування. Відомо, що поширеність ДCПН значно відрізняється між етнічними групами. У Росії та США поширеність даного ускладнення у популяції хворих на ЦД становить понад 50 %, а у жителів Індійського субконтиненту — менше 10 %. Це підтвердили дослідження поширеності діабетичної нейропатії у популяції хворих на ЦД, які живуть на острові Маврикій, де основним населенням є індуси [9, 10].
Останніми роками в літературі широко обговорюється генетичний ризик розвитку ЦД та його ускладнень залежно від генів інсулінорезистентності, генів, які визначають знижений рівень інсуліну, поліморфізму гена ангіотензин-I-перетворюючого ферменту (АСЕ), гена ендотеліальної NO-синтази (еNOS) у пацієнтів з обома типами ЦД [18, 30, 40].
Встановлена асоціація з ДСПН при ЦД типу 1 та поліморфними маркерами декількох генів-кандидатів, а саме гени, які кодують білок р53 (TP53), пероксидази глутатіону-3 (GPX3), β3-субодиницю G-білка (GNB3), переносник АТФ/АДФ 1-го типу (ANT1), хеліказим тДНК (PEO1), ДНК-полімеразу гамма-1 (POLG1) та полі(АДФ-рибоза)-полімеразу (ADPRT1) у росіян (м. Москва) [1, 8].
Генетичні чинники ризику розвитку ДСПН вивчені також у багатьох дослідженнях, які показали вірогідні асоціативні зв’язки терміну розвитку діабетичної полінейропатії з поліморфізмом генів SOD2 (мітохондріальна супероксиддисмутаза), SOD3 (ендотеліальна супероксиддисмутаза) і PARP (регенеративних полімераз, що активуються руйнуванням ДНК мітоходрій вільним радикалом супероксидом) [32].
Відомо, що поліморфізм генів, які детермінують функціональний стан ендотелію, є причиною схильності організму до розвитку різних патологічних станів, у першу чергу до ангіопатій. В основі ендотеліальної дисфункції як одного з факторів розвитку діабетичної нейропатії лежить дисбаланс між локальним синтезом і розпадом вазоактивних речовин, з-поміж яких виділяють монооксид нітрогену (NO) [7]. Ендотеліальна NО-синтаза (еNOS) у клітинах ендотелію підвищує продукцію NO і циклічний гуанозин-3',5'-монофосфат (цГМФ) у гладком’язових клітинах, знижуючи ефект вазоконстрикції, викликаний фенілефрином, і забезпечує ендотелій-залежну релаксацію у відповідь на ацетилхолін [31]. NO ендотеліального походження є важливим атеропротекторним медіатором. NO-синтазу слід розглядати як складний ферментний комплекс, що синтезує високоактивні сполуки залежно від функціонального стану клітини. У зв’язку з цим процеси регуляції синтезу NO і ген, що кодує еNOS, є першочерговими кандидатами при дослідженні ендотеліальної дисфункції судин [35, 44].
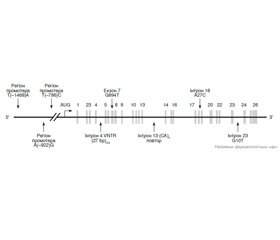
Ген еNOS, виділений у 1993 році, локалізований у хромосомі 7q35-36. Займаючи інтервал 4,4 Кб геномної ДНК, він складається з 26 екзонів, які кодують 135-кДа білка, що містить 1203 амінокислоти. Матрична РНК гена еNOS кодується 4052 нуклео–тидами. Послідовності у 5’-фланкуючій ділянці гена представлена численними потенційними цис-регуляторними послідовностями ДНК: Sp1, GATA, AP-1, NF-1, елементом, що відповідає за напруження зміщення (shear stress), і елементом, що відповідає за регуляцію стеролу [45, 50, 55]. Прогрес у розумінні молекулярних механізмів, залучених у конститутивну та регульовану експресію мРНК гена еNOS, забезпечує нові підходи до вивчення ендотеліальної генної регуляції в нормі та при патології [20].
Ген, що кодує eNOS, має алельний поліморфізм, який асоційований з різною активністю вироблення NO [51]. У гені еNOS виявлено кілька поліморфних сайтів (рис. 1), з яких найбільший інтерес становить структурна заміна в 7-му екзоні 894G>T. Точкова заміна гуаніну на тимін у позиції 894 в 7-му екзоні (GAG на GAT) гена eNOS призводить до зміни амінокислотної послідовності білка: глутамін у позиції 298 змінюється на аргінін (Glu298Asp) [25, 36, 39].
Деякі дослідники пов’язують поліморфізм Glu298Asp (rs1799983) гена еNOS з дозозалежним зниженням ферментативної активності еNOS і зниженням продукції NO. Гомозиготи Asp/Asp характеризуються більш низькою активністю еNOS порівняно з генотипом Glu/Glu. Іншим можливим механізмом впливу цього поліморфізму на рівень/активність еNOS може бути його нерівноважне зчеплення з ще не встановленими функціональними варіантами гена еNOS [39].
Численними дослідженнями встановлено, що ендотелій-залежна вазодилатація у разі наявності алелі 298Asp (Т894) ушкоджується, і цей тип поліморфізму пов’язаний з ішемічною хворобою серця (ІХС) і гіпертензією та є предиктором атеросклерозу каротидної артерії [10, 12, 16, 38]. Отже, була встановлена асоціація цього типу поліморфізму з атеросклерозом коронарних артерій, яка не залежала від інших факторів ризику. Крім того, авторами було досліджено зв’язок між основним ефектором ренін-ангіотензинової системи ангіотензином II і алельним поліморфізмом G894Т гена еNOS. У зв’язку з цим проведені дослідження поєднаного впливу поширеного поліморфізму інсерція/делеція гена ангіо–тензинперетворюючого ферменту і алелі 894Т гена еNOS на розвиток дисфункції ендотелію, гіпертензії, атеросклерозу, нефропатії [13, 46, 53].
Окремі дослідження показали, що Т894G та 4b/поліморфізм гена eNOS пов’язаний із захворюваністю на ЦД типу 2 і схильністю до розвитку тяжких діабетичних нефропатій у жителів Східної Азії [42]. Зміни в експресії гена eNOS можуть бути чинником генетичної схильності до розвитку ішемічної зорової нейропатії [28], діабетичної ретинопатії при ЦД типу 1 [27]. Простежується зв’язок між генами eNOS та ангіотензинперетворюючого ферменту та визначена їх роль у підвищенні схильності до захворювання периферичних артерій у курців. Таким чином, надаються докази взаємодії генів і навколишнього середовища, способу життя та шкідливих звичок у моделюванні схильності до розвитку захворювання [15, 18].
S. Frank et al. [21] досліджували вплив поліморфізму гена eNOS на толерантність до глюкози на тлі фізичного навантаження в осіб із діабетом (n = 461) та у контрольній групі (n = 474) в американців та іспанців європейського походження з порушенням толерантності до глюкози. Дослідження не підтвердило, що варіанти гена еNOS впливають на ризик виникнення діабету, толерантності до глюкози, і модифікують зв’язок між витратами енергії та толерантністю до глюкози. Для значної частини популяційних досліджень, що аналізують зв’язок між поліморфізмом гена еNOS і толерантністю до глюкози при ЦД типу 2, встановлено зв’язок між поліморфізмом даного гена і гіпертензією, нефропатією, ретинопатією та ІХС [24, 26, 51, 52].
Про генетику ускладнень ЦД і поліморфних варіантів гена ендотеліальної NO-синтази, а саме поліморфізму G894T, існують суперечливі результати. Поширеність мутації Glu298Asp варіює в різних етнічних групах. Так, при дослідженні однонуклеотидного поліморфізму G894T гена eNOS серед населення Південної Індії виявлено взаємозв’язок патологічних генотипів з розвитком ЦД типу 2: з’ясовано, що у хворих наявність мутантних генотипів (GT/TT) спостерігалася у 7,2 раза (95% довірчий інтервал (СI) = 4,09–12,71) частіше, ніж у конт–ролі [34, 41, 48]. При дослідженні генотипів eNOS у турецького населення з діабетичними судинними ускладненнями виявлено, що між генотипами контролю та хворими ЦД типу 2 не було суттєвих відмінностей у співвідношенні алелей G894T гена eNOS. Між групами з ускладненнями діабету та без таких значне розходження було знайдено тільки в розподілі алелей у пацієнтів із супутньою атеросклеротичною хворобою серця, чиї GT-TT алелі були значно вище, ніж алелі GG (р = 0,004) [17].
Беручи до уваги фізіологічну роль еNOS і дані попередніх досліджень, ми припустили, що вивчення розподілу частот генотипів поліморфізму G894T гена eNOS у хворих із ДСПН на тлі ЦД типу 2 дасть можливість уточнити патогенетичні механізми розвитку захворювання, а у подальшому молекулярно-генетичні дані можуть бути корисні для обґрунтування тактики ведення хворих на дану патологію.
Матеріали та методи
Обстежено 110 хворих із ДСПН на тлі ЦД типу 2, що становили основну групу. Середній вік хворих — 54,2 року (від 38 до 72 років). Чоловіків було 62 особи, жінок — 48 осіб. Групу порівняння становили 80 практично здорових осіб віком від 32 до 56 років, зокрема 36 чоловіків і 44 жінок. Розподіл хворих здійснювався за ступенем тяжкості ДСПН: з початковими проявами ДСПН — 32 (29,1 %) пацієнти (перша група), з помірним ступенем — 58 (52,7 %) (друга група) та з вираженим ступенем ДСПН — 20 (18,2 %) (третя група) хворих.
Усім пацієнтам проводилося неврологічне обстеження за шкалами нейропатичного симптоматичного розрахунку (NSS) [22] та нейропатичного дисфункціонального розрахунку (NDS) [5]. Електронейроміографічне (ЕНМГ) обстеження здійснювалося на комп’ютеризованому програмному комплексі М-ТEST («DX-системи», Україна), при цьому вивчали: амплітуду потенціалів максимальної рухової відповіді (М-відповідь), швидкість проведення збудження (ШПЗ), резидуальну латентність (мс) при дослідженні малогомілкового та великогомілкового нервів [19].
Рівень глікемії досліджували глюкозооксидазним методом з використанням стандартних наборів реактивів виробництва НВП «Філісітдіагностика» (Україна). Глікований гемоглобін (HbA1с) визначали методом рідинної іонообмінної хроматографії високого тиску на автоматичному аналізаторі глікованого гемоглобіну D10 фірми Bio-Rad Laboratories Inc. (Франція). Рівень імунореактивного інсуліну (ІРІ) і С-пептиду встановлювали за імуноферментним методом на аналізаторі STAT Fax Plus-303 (США) з використанням реактивів фірми DRG International Inc. (США).
Ступінь інсулінорезистентності встановлювали за індексом інсулінорезистентності HOMA-IR з використанням програми HOMA Calculator Version 2.2 Diabetes Trials Unit University of Oxford (Великобританія). Критичним вважалося значення вище 2,0.
Для оцінки активності окиснювальних процесів визначали вміст продуктів перекисного окислення ліпідів (ПОЛ), а саме за рівнем малонового альдегіду (МА) у плазмі крові та еритроцитах, відновленого глутатіону (Г-SH). Стан системи антиоксидантного захисту (АОЗ) аналізували за визначенням активності каталази (КАТ) та глутатіонпероксидази (ГП). [4]
Функціональний стан ендотелію досліджували за вмістом у крові стабільних метаболітів монооксиду нітрогену (NO) та кількістю циркулюючих у крові злущених ендотеліоцитів. При цьому кількість циркулюючих у крові ендотеліоцитів визначалася за методом J. Hladovec у модифікації Н.Н. Петрищева та співавт. Уміст у крові стабільних метаболітів NO (нітритів, нітратів) досліджували за вмістом нітрит-аніону (NO2–) та сумою NO2– та нітрат-аніону (NO3–) в сироватці венозної крові фотоколориметричним методом за L.C. Green et al. [11].
ДНК виділяли з клітин крові за допомогою набору «ДНК-сорб-В» («АмпліСенс», Росія). Детекцію поліморфізму G894T у гені eNOS проводили методом полімеразної ланцюгової реакції (ПЛР). Алельний поліморфізм визначали ампліфікацією гена з подальшою рестрикцією рестриктазою Есо24І. Фрагменти ампліфікованої ДНК розділяли методом гель-електрофорезу. Візуалізація ДНК проводилася за допомогою ультрафіолетового (УФ) випромінювача. Підбір праймерів для ампліфікації та наступного секвенсу, а також аналіз ПЛР здійснювався відповідно до загальноприйнятих світових методик [3].
Статистична обробка проводилася з використанням прикладних програми MS® Excel® 2003тм, Biostat®, Statistika® 6. Вірогідність отриманих даних вираховували методом парного тесту із застосуванням t-критерію Стьюдента. Вірогідну відмінність у розподілі вибірок визначали за критерієм χ2. Значення р < 0,05 вважали вірогідним.
Результати
За даними нашого дослідження встановлено, що генетично зумовлений ризик появи виражених ознак ДСПН у хворих на ЦД типу 2 (р ≤ 0,05) асоційований із наявністю гомозиготного генотипу за рідкісною алеллю Т гена еNOS, оскільки у більшості хворих із даним генотипом спостерігали виражений ступінь тяжкості ДСПН (χ2 = 4,568; р = 0,033). Окрім того, частота мінорної Т алелі в основній групі обстежених була вищою (47,2%) проти групи порівняння (36,9 %). У зв’язку з тим, що гетерозиготний генотип GТ гена еNOS майже утричі рідше трапляється у хворих із тяжким ступенем ДСПН порівняно з контролем, хворі на ЦД типу 2 із таким генотипом мають найбільш сприятливий прогноз щодо уникнення розвитку синдрому діабетичної стопи.
При порівнянні клінічних, біохімічних і функціональних показників у хворих на ЦД 2-го типу, ускладнений ДСПН, стратифікованих за поліморфізмом G894T гена eNOS, встановлено асоціацію суб’єктивної та деякою мірою з об’єктивною симптоматикою при ДСПН із гомозиготним генотипом ТТ за рідкісною алеллю. Крім того, у хворих із цим генотипом зареєстровано найсуттєвіші ЕНМГ-ознаки аксонопатії, що вірогідно відрізнялися порівняно з носіями гетерозиготного генотипу.
Аналізуючи літературні джерела, ми знайшли окремі повідомлення про роль гена еNOS у розвитку та прогресуванні діабетичної полінейропатії, що перекликаються з нашими результатами. У дослідженні, в якому вивчали поліморфізм G894T гена еNOS у хворих на ЦД типу 2, ускладнений ДСПН, виявлена асоціація G894T варіанта гена еNOS з прогресуванням діабетичної нейропатії та серцево-судинними захворюваннями. Встановлено, що даний поліморфізм може моделювати перебіг і тяжкість діабетичної нейропатії [17]. У дослідженнях, проведених у населення Південної Індії, було визначено, що поява мутантного генотипу (еNOS-894 GT/TT) була вищою (75 %) у хворих на ЦД типу 2 порівняно з контрольною групою (29,37 %) [25]. Аналогічне дослідження, проведене Монті [29], який описав істотний зв’язок між поліморфізмом гена еNOS і ЦД типу 2, припускаючи, що даний поліморфізм є фактором генетичної схильності для гіперінсулінемії, резистентності до інсуліну, і ЦД типу 2. П’ятирічним проспективним дослідженням, проведеним серед китайського населення, визначено, що поліморфізм G894T гена еNOS може бути прогностичним маркером стійкої гіперглікемії у пацієнтів із порушеною толерантністю до глюкози [23].
Обговорення
За нашими результатами, виявлено асоціацію гомозиготного генотипу ТТ за рідкісною алеллю гена еNOS з показниками вуглеводного обміну, а саме рівнем HbA1c (р ≤ 0,05). Окрім того, спостерігалися дещо вищі рівні ІРІ та індексу інсулінорезистентності НОМА-IR у носіїв даного генотипу, однак ці значення були статистично невірогідні порівняно з носіями інших генотипів, що може вказувати на ймовірний зв’язок даного поліморфізму гена еNOS з розвитком гіперглікемії та інсулінорезистентності.
NO, що синтезується еNOS, є учасником практично всіх метаболічних і фізіологічних процесів, відіграючи роль універсального регулятора. Особливий інтерес становить здатність NО і його похідних впливати на синтез низки найважливіших білків і ферментів як на рівні транскрипції, так і на рівні трансляції. Роль NО як модулятора фізіологічної секреції інсуліну була ретельно вивчена у дослідженнях G. Spinas [49]. NO має здатність модулювати периферичний і печінковий метаболізм глюкози та секрецію інсуліну. Отже, генетичний дефект в еNOS може відігравати вирішальну роль в еволюції гіперінсулінемії та інсулінорезистентності, як це було запропоновано раніше.
Водночас патогенетична роль ендогенного NO при ЦД, ускладненому ДСПН, визначається з двох точок зору: як фактора, що бере участь в індукції самого захворювання, так і фактора, аномальне зниження якого відіграє визначальну роль у формування ангіопатії. За даними наших досліджень, рівень NO2– — NO3– у носіїв гетерозиготного генотипу та генотипу GG вірогідно не відрізнявся порівняно з практично здоровими особами, однак у 19,3 % пацієнтів із генотипом GT та у 5 (20,0 %) осіб із генотипом GG рівень NO був підвищений внаслідок активності іNOS. У хворих із гомозиготним генотипом ТТ цей показник у 1,7 раза (р < 0,05) був нижчим порівняно з контролем, однак вірогідно не різнився порівняно з носіями інших генотипів. Отже, за нашими даними, не встановлена асоціація показників рівнів NO з алельними варіантами гена еNOS, проте у хворих із гомозиготним генотипом ТТ за мінорною алеллю рівні стабільних метаболітів монооксиду нітрогену були найнижчими.
При аналізі показників про- та антиоксидантних систем крові в обстежених нами пацієнтів залежно від розподілу частот генотипів G894T поліморфізму гена еNOS встановлена асоціація гомозиготного генотипу ТТ із збільшенням умісту продуктів ПОЛ, а саме МАпл. крові (р ≤ 0,05), рівень якого вірогідно зростав у хворих на ДСПН із даним генотипом. Показники активності антиоксидантного захисту у носіїв всіх генотипів були нижчими за нормативне значення, проте між групами різниці не спостерігали. Проведені нами дослідження відрізнялися від інших нечисленних літературних даних, під час яких встановлено, що показники пероксидного окиснення (МА) і активність ензимів антиоксидантного захисту (СОД та глутатіон-редуктази) у хворих із різними генотипами гена еNOS (G894T-поліморфізм) не мали вірогідних відмінностей [2].
Висновки
Частота розвитку та особливості перебігу діабетичної полінейропатії детерміновані генетичними чинниками. У хворих із дистальною симетричною полінейропатією на тлі ЦД типу 2 має місце асоціація гомозиготного генотипу ТТ поліморфізму G894T гена ендотеліальної NO-синтази з вірогідно вираженими ознаками суб’єктивної симптоматики, наявністю аксонального ураження моторних нервів за даними нейрофізіологічного дослідження периферичних нервів, із зростанням рівня глікозильованого гемоглобіну, а також із збільшенням умісту продуктів ПОЛ. Отже, гомозиготність за мінорною алеллю підвищує ймовірність ризику розвитку діабетичної полінейропатії та її тяжких ускладнень, таких як синдрому діабетичної стопи.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Wilson N., Wright D. Inflammatory mediators in diabetic neuropathy // J. Diabetes. 2011; S5: 004.10.4172/2155-6156.S5-004.
2. Tesfaye S., Boulton A.J.M., Dyck P.J., Freeman R., Horo–witz M., Kempler P. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care. 2010; 33(10): 2285-93. 10.2337/dc10-1303.
3. Vinik A.I., Maser R.E., Ziegler D. Neuropathy: the crystal ball for cardiovascular disease? // Diabetes Care. 2010; 33(7): 1688-90. 10.2337/dc10-0745.
4. Ciccacci C., Di Fusco D., Cacciotti L., Morganti R., D’Amato C., Novelli G. et al. TCF7L2 gene polymorphisms and type 2 diabetes: association with diabetic retinopathy and cardiovascular autonomic neuropathy // Acta Diabetol. 2013; 50(5): 789-99. 10.1007/s00592-012-0418-x.
5. Osztovits J., Horváth T., Littvay L., Steinbach R., Jermendy A., Tárnoki A. et al. Effects of genetic vs. environmental factors on cardiovascular autonomic function: a twin study // Diabet. Med. 2011; 28: 1241-8. 10.1111/j.1464-5491.2011.03363.x.
6. Basile K.J., Johnson M.E., Xia Q., Grant S.F. Genetic susceptibility to type 2 diabetes and obesity: follow-up of findings from genome-wide association studies // Int. J. Endocrinol. 2014; 2014: 769671. 10.1155/2014/769671.
7. Dimitropoulos G., Tahrani A.A., Stevens M.J. Cardiac autonomic neuropathy in patients with diabetes mellitus // World J. Diabetes. 2014; 5(1): 17-39. 10.4239/wjd.v5.i1.17.
8. Kota S., Meher L., Jammula S., Modi K. Diabetic periphe–ral neuropathy-recent trends and future perspectives in management // Int. J. Clin. Cases Investig. 2012; 4(2): 44-59.
9. Tesfaye S., Selvarajah D. Advances in the epidemiology, pathogenesis and management of diabetic peripheral neuropathy // Diabetes Metab. Res. Rev. 2012; 28(1): 8-14. 10.1002/dmrr.2239.
10. A polymorphism (T894G) in eNOS increases the risk of coronary atherosclerosis rather than intracranial atherosclerosis in Koreans. B.W. Min, J.Y. Na, S.W. Juhng et al. // Acta Neuro–logy. 2010; 5: 255-262.
11. Analysis of nitrate, nitrite and [15N] nitrate in biological fluids. L.C. Green et al. // Analyt. Biochem. 1982; 126: 131-138.
12. Association between the endothelial nitric oxide synthase gene glu298asp polymorphism and coronary heart disease: A metaanalysis of 39 casecontrol studies. G.X. Tian, X.T. Zeng, X.B. Wang et al. // Mol. Med. Rep. 2013; 7: 1310-1318.
13. Association of eNOS Gene Polymorphisms T-786C and G894T With Blood Pressure Variability in Man. M. Jíra, E. Závodná, N. Honzíková et al. // Physiol. Res. 2011; 60: 193-197.
14. Association of gene with diabetic polyneuropathy in Russian patients with type 1 diabetes / V.V. Nosikov, I.A. Strokov, A.G. Nikitin, A.M. Burdennyy, Z.S. Albekova, G.A. Melnichenko // 20th Annual Meeting of Diabetic Neuropathy Study Group of the EASD. — Stockholm, Sweden, 2010: 90.
15. Association of renin-angiotensin and endothelial nitric oxi–de synthase gene polymorphisms with blood pressure progression and incident hypertension: prospective cohort study / D. Conen, R.J. Glynn, J.E. Buring et. al. // Journal of Hypertension. 2008; 26: 1780-1786.
16. Association of the 894G>T polymorphism in the endothelialnitric oxide synthase gene with risk of venous thromboembolism in Chinese population / Y. Li, Z. Zhai, Y. Yang et al. // Thromb. Res. 2011; 127(4): 324-327.
17. Association of the G894T Polymorphism of the Endothelial Nitric Oxide Synthase Gene with Diabetic Foot Syndrome Foot Ulcer, Diabetic Complications, and Comorbid Vascular Diseases: A Turkish Case-Control Study / D. Corapcioglu, M. Sahin, R. Emral et al. // Genet. Test Mol. Biomarkers. 2010; 14(4): 483-488.
18. Association of the genetic polymorphisms of the ACE gene and the eNOS gene with lupus nephropathy in northern Chinese population. X. Li, J. An, R. Guo et al. // BMC Med. Genet. 2010; 11: 94-97.
19. Butugan M.K. Multichannel EMG-based estimation of fiber conduction velocity during isometric contraction of patients with different stages of diabetic neuropathy / M.K. Butugan, C.D. Sartor, R. Watari, M.C. Martins. // J. Electromyogr. Kinesiol. 2014; 24(4): 465-72.
20. Deleterious effects of silymarin on the expression of genes controlling endothelial nitric oxide synthase activity in carbon tetrachloride-treated rat livers / Y.K. Cho, J.W. Yun, J.H. Park et al. // Life Science. 2009; 7–8: 281-290.
21. Differential regulation of vascular endothelial growth factor and its receptor fms-like-tyrosine kinase is mediated by nitric oxide in rat renal mesangial cells. S. Frank, B. Stallmeyer, H. Kampfer et al. // Biochem J. 1999; 338: 367-374.
22. Dyck PJ. Detection, characterization, and staging of polyneuropathy: assessed in diabetics // Muscle Nerve. 1988; 11: 21-32.
23. Endothelial nitric oxide synthase G894T (Glu298Asp) polymorphism was predictive of glycemic status in a 5-year prospective study of Chinese subjects with impaired glucose tolerance. A.W. Tso, K.C.B. Tan, N.M.S. Wat et al. // Metabolism. 2006; 55(9): 1155-1158.
24. Endothelial nitric oxide synthase gene haplotypes and diabetic nephropathy among Asian Indians / T.S. Ahluwalia, M. Ahuja, T.S. Rai et al. // Molecular and Cellular Biochemistry. 2008; 314(1–2): 9-17.
25. Endothelial Nitric Oxide Synthase Gene Polymorphism (G894T) and Diabetes Mellitus (Type II) among South Indians. T. Angeline, H.R. Krithiga, W. Isabel et al. // Oxidative Medicine and Cellular Longevity. 2011. http://dx.doi.org/10.1155/2011/462607.
26. Endothelial nitric oxide synthase gene polymorphism and type 2 diabetic retinopathy among Asian Indians / B.S. Cheema, H.S. Kohli, R. Sharma, A. Bhansali, M. Khullar // Acta Diabetol. 2012; 49: 481-488.
27. Endothelial nitric oxide synthase genotypes in the etiology of re–tinopathy of prematurity in premature infants / K. Yanamandra, D. Napper, A. Pramanik et al. // Ophthalmic. Genetic. 2010; 4: 173-177.
28. Endothelial nitric oxide synthase polymorphism (T894G) and nonarteritic anterior ischemic optic neuropathy / S. Giannopoulos, S. Markoula, I. Asproudis et al. // Vis. Neurosci. 2010; 15: 1-3.
29. Endothelial nitric oxide synthase polymorphisms are associated with type 2 diabetes and the insulin resistance syndrome / L.D. Monti, C. Barlassina, L. Citterio et al. // Diabetes. 2003; 52(5): 1270-1275.
30. eNOS and ACE genes influence peripheral arterial di–sease predisposition in smokers / E. Sticchi, F. Sofi, I. Romagnuolo et al. // Journal of Vascular Surgery. 2010; 1: 97-102.
31. Forstermann U. Nitric oxide synthases: regulation and function / U. Forstermann, W. Sessa. // Europian Heart Journal. 2012; 33: 829-837.
32. Gene polymorphisms of superoxide dismutases and catalase in diabetes mellitus / Milan Flekac, Jan Skrha, Jirina Hilgertova et al. // BMC Medical Genetics. 2008: 1-9.
33. Genome-wide association scan for diabetic nephropathy susceptibility genes in type 1 diabetes. M.G. Pezzolesi, G.D. Poznik, J.C. Mychaleckyj et al. // Diabetes. 2009; 58: 1403-1410.
34. Heltianu C. Genetic determinants of microvascular complications in type 1 diabetes: Type 1 Diabetes Pathogenesis, Gene–tics and Immunotherapy / C. Heltianu, C. Guja, S.A. Manea // In Tech, 2011. ISBN 978-953-307-362.
35. Huizinga M. Painful Diabetic Neuropathy: A Management-Centred Review / M. Huizinga, A. Peltier // Clinical Diabetes. 2007; 25(1): 6-15.
36. Impact of the endothelial nitric oxide synthase gene g894t polymorphism on renal endothelial function in patients with type 2 diabetes / M. Ritt, C. Ott, C. Delles, M.P. Schneider, R.E. Schmieder // Pharmacogenet Genomics. 2008; 18: 699-707.
37. International Diabetes Federation (IDF). Diabetes Atlas. – 7th ed. – Vancouver, Canada, 2015.
38. Jude E.B. Effect of L-arginine on the microcirculation in the neuropathic diabetic foot in Type 2 diabetes mellitus: a double-blind, placebo-controlled study / E.B. Jude, C. Dang, A.J. Boulton // Diabet. Med. 2010; 27(1): 113-116.
39. Lack of association between Glu298Asp polymorphism of endothelial nitric oxide synthase (eNOS) gene and coronary artery disease in Tamilian population / J. Mathew, P. Narayanan, R. Sundaram et al. // Indian Heart Journal. 2008; 60(3): 223-227.
40. Marchesi C. Role of the renin-angiotensin system in vascular inflammation / C. Marchesi, P. Paradis, E.L. Schiffrin // Trends Pharmacol. Sci. 2008; 29: 367-374.
41. Nishevitha N.S. Endothelial nitric oxide synthase (eNOS) Glu298→Asp polymorphism (G894T) among South In–dians / N.S. Nishevitha, T. Angeline, N. Jeyaraj // Indian Journal of Medical Research. 2009; 129: 68-71.
42. Polymorphisms of eNOS gene are associated with diabetic nephropathy: a meta-analysis / Y. He, Z. Fan, J. Zhang et al. // Mutagenesis. 2010; 11: 234-236.
43. Poncelet A.N. Diabetic polyneuropathy: risk factors, cli–nical picture, diagnostics and treatment // International Neurological Journal. 2010; 5: 81-86.
44. Rate, affinity and calcium dependence of nitric oxide synthase isoform binding to the primary physiological regulator calmodulin / J.L. McMurry, C.A. Chrestensen, I.M. Scott et. al. // FEBS Journal. 2011; 78: 4943-4954.
45. Relationship between endothelial nitric oxide synthase gene polymorphisms and ischemic stroke: A meta-analysis / P.P. Niu, Yang G., B.K. Zheng, Z.N. Guo et al. // Acta Neurol. Scand. 2013; 128: 202-212.
46. Review article: endothelial progenitor cells in renal di–sease / M.S. Goligorsky, M.C. Kuo, D. Patschan, M.C. // Verhaar. Nephrology (Carlton). 2009; 14(3): 291-297.
47. Risk factors involved in symmetrical distal diabetic neuropathy / V.N. Gomes, S.A. Lavastatida, S.H. Rosello et al. // Rev. Neurol. 2001; 32: 806-812.
48. Shah V.N. Endothelial Nitric Oxide Synthase Gene Polymorphism and the Risk of Diabetic Neuropathy in Asian Indian Patients with Type 2 Diabetes. Viral N. Shah, Balneek Singh Cheema, Harbir Singh Kohli // J. Diabetes Metab. 2013; 4(2). http://dx.doi.org/10.4172/2155-6156.1000243.
49. Spinas G. The dual role of nitric oxide in islet beta-cells // News in Physiological Sciences. 1999; 14: 49-54.
50. The endothelial nitric oxide synthase gene and risk of diabetic nephropathy and development of cardiovascular disease in type 1 diabetes / A. Mollsten, M. Lajer, A. Jorsal, L. Tarnow // Mol. Genet. Metab. 2009; 97: 80-84.
51. The endothelial nitric oxide synthase gene is associated with coronary artery disease: a meta-analysis / J. Li, X. Wu, X. Li et al. // Cardiology. 2010; 4: 271-278.
52. Xin Y. A common variant of the eNOS gene (E298D) is an independent risk factor for left ventricular hypertrophy in human essential hypertension / Y. Xin, X. Song, H. Xue // Clinical –Science. 2009; 117: 67-73.
53. Vanhoutte PM. Arginine and arginase: endothelial NO synthase double crossed? // Circ. Res. 2008; 102: 866-868.
54. Volmer-Thole M. Neuropathy and Diabetic Foot Syndrome / M. Volmer-Thole, R. Lobmann // Int. J. Mol. Sci. 2016; 17(6). https: //doi./ 10.3390/ijms17060917.
55. Zintzaras E. Endothelial nitric oxide synthase gene polymorphisms and diabetic nephropathy: A huge review and meta-analysis / E. Zintzaras, A.A. Papathanasiou, I. Stefanidis // Genet Med. 2009; 11: 695-706.

/119-1.jpg)