Резюме
Мета: оцінити вплив лікування фіксованою комбінацією екстракту гарцинії камбоджійської (що відповідає вмісту кислоти гідроксилимонної 0,05 г) 0,1 г, хрому піколінату 0,0001 г, L-тирозину 0,5 г, L-карнітину 0,015 г, водоростей бурих сухого екстракту (Fucus vesiculosus L.) у перерахунку на йод 0,037 мг на показники ліпідного й вуглеводного обміну, а також на рівень адипокінів (лептину й адипонектину) в крові у хворих на цукровий діабет (ЦД) 2-го типу з ожирінням і артеріальною гіпертензією. Матеріали та методи. У дослідження були включені 53 пацієнти (з них 25 чоловіків) віком 55,90 ± 2,15 року з ЦД 2-го типу, артеріальною гіпертензією й ожирінням (індекс маси тіла ≥ 30 кг/м2). Результати. В основній групі (n = 30) через 12 тижнів лікування такою фіксованою комбінацією в дозі по 1 капсулі 3 рази на день рівень HbA1c зменшився на 0,87 ± 0,14 % (P1 = 0,0001), у контрольній (n = 23) — знизився на 0,17 ± 0,16 % (P1 = 0,1), різниця між основною й контрольною групами була статистично значущою (P2 = 0,001). Рівень глюкози в плазмі крові натще в основній групі знизився на 8,00 ± 4,26 % (P1 = 0,03), у контрольній — на 2,7 ± 4,8 % (P1 = 0,2), при цьому різниця між групами була статистично незначущою (P2 = 0,4). Рівень ліпопротеїдів низької щільності в основній групі знизився на 18,20 ± 5,43 % (P1 = 0,001), в контрольній — збільшився на 6,9 ± 6,2 % (P1 = 0,7), різниця між групами була статистично значущою (P2 = 0,003). В основній групі відмічено зниження рівня тригліцеридів на 14,9 ± 6,5 % (P1 = 0,02), у контрольній — збільшення на 20,30 ± 7,46 % (P1 = 0,04), різниця між групами була статистично значущою (P2 = 0,008). В основній групі рівень ліпопротеїдів високої щільності підвищився на 20,2 ± 6,8 % (P1 = 0,03), у контрольній — знизився на 3,7 ± 7,7 % (P1 = 0,12), різниця між групами була статистично значущою (P2 = 0,02). Терапія досліджуваним препаратом не впливала на резистентність до інсуліну, що визначалася за індексом НОМА-ІР і рівнем імунореактивного інсуліну в плазмі крові натще. На фоні лікування досліджуваним препаратом відмічено зменшення рівня лептину на 21,4 ± 6,1 % (P1 = 0,004), а також спостерігалася тенденція до збільшення рівня адипонектину — він зріс на 19,30 ± 9,36 % (P1 = 0,39). Висновки. Зниження маси тіла на фоні терапії означеною фіксованою комбінацією привело до покращення показників вуглеводного й ліпідного обміну, а також позитивно впливало на рівень лептину в плазмі крові.
Цель: оценить влияние лечения фиксированной комбинацией экстракта гарцинии камбоджийской (что соответствует содержанию кислоты гидроксилимонной 0,05 г) 0,1 г, хрома пиколината 0,0001 г, L-тирозина 0,5 г, L-карнитина 0,015 г, водорослей бурых сухого экстракта (Fucus vesiculosus L.) в пересчете на йод 0,037 мг на показатели липидного и углеводного обмена, а также уровень адипокинов (лептина и адипонектина) в крови у больных сахарным диабетом (СД) 2-го типа з ожирением и артериальной гипертензией. Материалы и методы. В исследование были включены 53 пациента (из них 25 мужчин) в возрасте 55,90 ± 2,15 года с СД 2-го типа, артериальной гипертензией и ожирением (индекс массы тела ≥ 30 кг/м2). Результаты. В основной группе (n = 30) через 12 недель лечения такой фиксированной комбинацией в дозе по 1 капсуле 3 раза в день уровень HbA1c снизился на 0,87 ± 0,14 % (P1 = 0,0001), в контрольной (n = 23) — снизился на 0,17 ± 0,16 % (P1 = 0,1), различие между основной и контрольной группами было статистически значимым (P2 = 0,001). Уровень глюкозы в плазме крови натощак в основной группе снизился на 8,00 ± 4,26 % (P1 = 0,03), в контрольной — на 2,7 ± 4,8 % (P1 = 0,2), различие между группами было статистически незначимым (P2 = 0,4). Уровень липопротеидов низкой плотности в основной группе снизился на 18,20 ± 5,43 % (P1 = 0,001), в контрольной — увеличился на 6,9 ± 6,2 % (P1 = 0,7), различие между группами было статистически значимым (P2 = 0,003). В основной группе отмечено снижение уровня триглицеридов на 14,9 ± 6,5 % (P1 = 0,02), в контрольной — увеличение на 20,30 ± 7,46 % (P1 = 0,04), различие между группами было статистически значимым (P2 = 0,008). В основной группе уровень липопротеидов высокой плотности повысился на 20,2 ± 6,8 % (P1 = 0,03), в контрольной — снизился на 3,7 ± 7,7 % (P1 = 0,12), различие между группами было статистически значимым (P2 = 0,02). Терапия исследуемым препаратом не влияла на резистентность к инсулину, которая определялась по индексу НОМА-ІР и уровню иммунореактивного инсулина в плазме крови натощак. На фоне лечения исследуемым препаратом отмечено уменьшение уровня лептина на 21,4 ± 6,1 % (P1 = 0,004), а также наблюдалась тенденция к увеличению уровня адипонектина — он возрос на 19,30 ± 9,36 % (P1 = 0,39). Выводы. Снижение массы тела на фоне терапии вышеотмеченной фиксированной комбинацией привело к улучшению показателей углеводного и липидного обмена, а также позитивно влияло на уровень лептина в плазме крови.
Background. The purpose of the study was to evaluate the impact of treatment with a fixed combination of the extract of garcinia cambogia 0.1 g (equivalent to hydroxycitric acid 0.05 g), chromium picolinate 0.0001 g, L-tyrosine 0.5 g, L-carnitine 0.015 g, dried brown algae extract (Fucus vesiculosus L.) equivalent to iodine 0.037 mg on lipid and carbohydrate metabolism, as well as on the level of adipokines (leptin and adiponectin) in the blood of type 2 diabetes patients with obesity and arterial hypertension. Materials and methods. The study included 53 patients (of whom 25 were men) aged 55.90 ± 2.15 years with type 2 diabetes, hypertension and obesity (body mass index ≥ 30 kg/m2). Results. In the main group (n = 30), after 12 weeks of treatment with such a fixed combination of 1 capsule 3 times daily, the HbA1c level decreased by 0.87 ± 0.14 % (P1 = 0.0001), in the control group (n = 23) — by 0.17 ± 0.16 % (P1 = 0.1), the difference between the main and control groups was statistically significant (P2 = 0.001). The level of fasting plasma glucose in the main group reduced by 8.00 ± 4.26 % (P1 = 0.03), in the control group — by 2.7 ± 4.8 % (P1 = 0.2), the difference between the groups was statistically non-significant (P2 = 0.4). The level of low-density lipoproteins in the main group decreased by 18.20 ± 5.43 % (P1 = 0.001), in the control group — increased by 6.9 ± 6.2 % (P1 = 0.7), the difference between the groups was statistically significant (P2 = 0.003). In the main group, there was a reduction in triglyceride levels by 14.9 ± 6.5 % (P1 = 0.02), in the control group — an increase by 20.30 ± 7.46 % (P1 = 0.04), the difference between the groups was statistically significant (P2 = 0.008). In the main group, the level of high-density lipoproteins increased by 20.2 ± 6.8 % (P1 = 0.03), in the control group — decreased by 3.7 ± 7.7 % (P1 = 0.12), the difference between the groups was statistically significant (P2 = 0.02). Therapy with the study drug did not affect insulin resistance, which was determined by the НOMA-IR, and the level of plasma fasting insulin. Therapy with the study drug showed a decrease in leptin levels by 21.4 ± 6.1 % (P1 = 0.004), and a tendency to increase in adiponectin levels by 19.30 ± 9.36 % (P1 = 0.39). Conclusions. The reduction in body weight on the background of study drug therapy led to an improvement in carbohydrate and lipid metabolism, and also had a positive effect on leptin levels in the blood plasma.
Вступ
Зниження маси тіла в пацієнтів із цукровим діабетом (ЦД) 2-го типу приводить до усунення багатьох важливих метаболічних порушень, зокрема, до покращання показників вуглеводного обміну, ліпідів крові, артеріального тиску тощо, що є істотними факторами ризику серцево-судинної патології [1–6]. Проте на сьогодні залишається актуальною проблема досягнення цільової маси тіла особами з надмірною вагою або ожирінням, які мають певні особливості харчової поведінки й ведуть малорухливий спосіб життя.
У попередній публікації ми повідомили про позитивні зміни показників маси тіла й кількості жирової тканини на фоні терапії комплексним препаратом Стифімол виробництва ПрАТ «Київський вітамінний завод», 1 капсула якого містить екстракту гарцинії камбоджійської (що відповідає вмісту кислоти гідроксилимонної 0,05 г) 0,1 г, хрому піколінату 0,0001 г, L-тирозину 0,5 г, L-карнітину 0,015 г, водоростей бурих сухого екстракту (Fucus vesiculosus L.) у перерахунку на йод 0,037 мг [7].
Метою даного дослідження було оцінити можливість комбінованого препарату Стифімол впливати на показники ліпідного й вуглеводного обміну, а також на рівень деяких гормонів жирової тканини (адипокінів) у крові хворих на ЦД 2-го типу з ожирінням та артеріальною гіпертензією.
Матеріали та методи
У дослідження були включені 53 пацієнти (з них 25 чоловіків) віком 55,90 ± 2,15 року з ЦД 2-го типу, гіпертонічною хворобою І–ІІ стадії 2-го ступеня (згідно з рекомендаціями Української асоціації кардіологів 2008 р.) та ожирінням, які перебували на лікуванні в Українському науково-практичному центрі ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України впродовж 2012–2013 років [8].
Вимірювання офісного артеріального тиску (АТ) проводилося на апараті Omron НЕМ-907 (Японія). Визначення ступеня ожиріння проводилося відповідно до рекомендацій ВООЗ (1997 р.) за розрахунком індексу маси тіла (ІМТ) за формулою: ІМТ = маса тіла/(зріст)2 (кг/м2). Визначали антропометричні показники (зріст і маса тіла) з подальшим розрахунком ІМТ, вимірювали окружність талії, стегон звичайними методами за допомогою вагів і сантиметрової стрічки.
Критеріями включення в дослідження були: діагностований ЦД 2-го типу згідно з критеріями ВООЗ (2007 р.), вік ≥ 18 і ≤ 75 років, ІМТ ≥ 30 і ≤ 45 кг/м2, діагностована артеріальна гіпертензія І–ІІ ст. (систолічний АТ ≥ 140 і ≤ 179 мм рт.ст., дастолічний АТ ≥ 90 і ≤ 109 мм рт.ст. при офісному вимірюванні в положенні сидячи або наявність антигіпертензивної терапії на момент включення в дослідження), терапія метформіном ≥ 1000 мг/добу, підписана інформована згода на участь у дослідженні. Критеріями виключення з дослідження були: ЦД 1-го типу, анамнез симптоматичної артеріальної гіпертензії (синдром Кушинга, феохромоцитома, первинний гіпер–альдостеронізм, гіперпаратиреоз, дисфункція щитоподібної залози тощо), креатинін сироватки крові ≥ 140 мкмоль/л, вік ≤ 18 і ≥ 75 років, наявність інших уроджених чи набутих захворювань, що можуть впливати на результати дослідження, наявність онкологічного захворювання на момент дослідження за винятком базаліоми шкіри, підвищена чутливість до компонентів Стифімолу, вагітність або годування груддю, гострі стани (інфекції, травми, операції) в період менше від 2 місяців до початку дослідження.
Досліджуваних пацієнтів було розподілено на дві групи: основну (n = 30) і контрольну (n = 23). Основна група на відміну від контрольної на додаток до цукрознижувальної, антигіпертензивної, гіполіпідемічної й антиагрегантної терапії отримувала препарат Стифімол у дозі 1 капсула 3 рази на день перед їжею, який запивали склянкою води. Курс лікування для всіх пацієнтів становив 12 тижнів.
Глікозильований гемоглобін (HbA1c) визначали хроматографічним методом на апараті D-10 фірми BIORAD (США) за допомогою реактиву Hemoglobin Testing System, Dual Program Recorder Pack (Франція), визначення ліпідів крові (загального холестерину, ліпопротеїдів низької щільності (ЛПНЩ), ліпопротеїдів високої щільності (ЛПВЩ), тригліцеридів) і глюкози проводили колориметричним методом на автоматичному біохімічному аналізаторі Sapphire-400, Tokio Boek L.T.D. Elitech diagnostics виробництва Seppin S.A.S. (Франція). Рівень імунореактивного інсуліну (ІРІ), лептину й адипонектину в сироватці крові визначався імуноферментним методом за допомогою реактивів фірми DRG (Німеччина) на автоматичному аналізаторі iEMS Reader MF фірми ThermoLabsystems (Фінляндія).
Оцінку чутливості тканин до інсуліну проводили за допомогою формули НОМА-ІР (Homeostasis Model Assessment for Insulin Resistance): рівень імунореактивного інсуліну натще (мкОД/мл) глюкоза крові натще (ммоль/л)/22,5. При значенні індексу вище від 3 діагностували інсулінорезистентність. Оцінку функції β-клітин острівців підшлункової залози (НОМА-β) проводили за формулою: рівень імунореактивного інсуліну натще (мкОД/мл) 20/(глюкоза крові натще (ммоль/л) – 3,5) [9].
Усім пацієнтам були надані рекомендації щодо модифікації способу життя: розширення обсягу фізичних навантажень як мінімум до 30 хвилин щодня й дотримання гіпокалорійної дієти (≤ 1200 Ккал/добу), а також була проведена раціональна психотерапія, спрямована на усунення або полегшення найбільш виражених розладів харчової поведінки.
Візити до дослідника в основній групі проводилися чотири рази впродовж усього дослідження: на початку, через 2 тижні, через 1,5 місяця й через 3 місяці від початку прийому досліджуваного препарату. У контрольній групі візити проводилися двічі: на початку дослідження і через 3 місяці від початку спостереження. В обох групах на кожному візиті проводилося визначення антропометричних показників (зріст, маса тіла, ІМТ), вимірювався офісний АТ, визначалася прихильність до лікування (комплайєнс) за кількістю прийнятих капсул та оцінювалась вираженість можливих побічних ефектів. Визначення лабораторних показників проводилося в обох групах на початку та наприкінці дослідження.
Як супутню терапію всі досліджувані пацієнти отримували лікування з використанням підібраної комбінації антигіпертензивних препаратів (табл. 1). Терапію ацетилсаліциловою кислотою в дозі 75 мг на добу і симвастатином у дозі 40 мг на добу впродовж дослідження було призначено всім пацієнтам в основній і контрольній групах. Цукрознижувальна терапія в пацієнтів упродовж дослідження не змінювалась. Усі хворі в обох групах отримували метформін у дозі 2000 мг на добу.
При статистичному аналізі даних перевірку розподілу кількісних ознак на відповідність закону –Гауса проводили, розраховуючи показники асиметрії й ексцесу. Порівняння незалежних груп (основної й контрольної) за кількісними ознаками проводили за допомогою двостороннього t-критерію Стьюдента. Для порівняння пов’язаних вибірок (до та після лікування) використовували парний t-критерій Стьюдента. При проведенні статистичного аналізу були обчислені рівні статистичної значущості порівняння незалежних вибірок за двостороннім t-критерієм Стьюдента (Р), порівняння пов’язаних вибірок за парним t-критерієм Стьюдента (Р1), а також порівняння відсотків незалежних вибірок за двостороннім t-критерієм Стьюдента (Р2). Перевірку статистичних гіпотез проводили на рівні значущості р < 0,05. Статистичні характеристики подано у вигляді середнього арифметичного (M) й стандартної похибки (± SE). Статистичний аналіз даних виконано за допомогою комп’ютерної програми Statgraphics Plus 3.0 фірми Manugistic Inc. (СШA).
Дослідження проводилося як відкрите конт–рольоване рандомізоване з дотриманням принципів Гельсінської декларації й відповідно до вимог Державного фармакологічного центру МОЗ України щодо клінічних випробувань.
На початку дослідження пацієнти основної й контрольної груп не відрізнялись за віком, статтю, антропометричними показниками, ступенем компенсації цукрового діабету, а також рівнем офісного АТ. Показники, що характеризують пацієнтів в обох групах на початку дослідження, подані в табл. 1.
Результати
Усі пацієнти в основній і контрольній групах дійшли до кінця дослідження. У попередній публікації ми показали, що в основній групі на фоні лікування препаратом Стифімол відмічено статистично значуще зниження ІМТ на 4,60 ± 0,59 % (P1 = 0,0001), тоді як у контрольній групі відмічено статистично незначуще зниження ІМТ на 0,11 ± 0,68 % (P1 = 0,79), при цьому різниця між групами була статистично значущою (P2 = 0,001) [7]. Також раніше було зазначено, що зменшення маси тіла відбулося за рахунок саме жирової тканини, переважно абдомінальної локалізації, й відрізнялося залежно від гендерної приналежності пацієнтів [7].
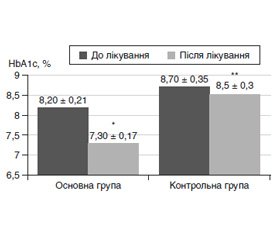
В обох досліджуваних групах пацієнтів були відмічені зміни параметрів глікемічного контро–лю. Рівень HbA1c в основній групі зменшився з 8,20 ± 0,21 % до 7,30 ± 0,17 % (на 0,87 ± 0,14 %, P1 = 0,0001), тоді як у контрольній групі HbA1c знизився статистично незначуще — з 8,70 ± 0,35 % до 8,5 ± 0,3 % (на 0,17 ± 0,16 %, P1 = 0,1) (табл. 2, рис. 1). Різниця між основною й контрольною групами щодо впливу на рівень HbA1c була статистично значущою (P2 = 0,001).
Рівень глюкози в плазмі крові натще в основ–ній групі статистично значуще знизився з 9,60 ± 0,45 ммоль/л до 8,60 ± 0,45 ммоль/л (на 8,00 ± 4,26 %, P1 = 0,03) і статистично незначуще знизився в контрольній групі з 10,90 ± 0,58 ммоль/л до 10,60 ± 0,53 ммоль/л (на 2,7 ± 4,8 %, P1 = 0,2), при цьому за цим показником різниця між групами була статистично незначущою (P2 = 0,4).
Обидві досліджувані групи пацієнтів вірогідно відрізнялися щодо впливу на показники ліпідного профілю крові. Рівень ЛПНЩ в основній групі статистично значуще знизився з 3,20 ± 0,21 ммоль/л до 2,37 ± 0,20 ммоль/л (на 18,20 ± 5,43 %, P1 = 0,001), тоді як у контрольній групі статистично незначуще збільшився з 3,13 ± 0,24 ммоль/л до 3,18 ± 0,17 ммоль/л (на 6,9 ± 6,2 %, P1 = 0,7), при цьому різниця між групами була статистично значущою (P2 = 0,003) (табл. 2, рис. 2).
В основній групі також відмічено статистично значуще зниження рівня тригліцеридів на 14,9 ± 6,5 % (P1 = 0,02), тоді як у контрольній групі рівень тригліцеридів вірогідно збільшилися на 20,30 ± 7,46 % (P1 = 0,04), при цьому різниця між обома групами була також статистично значущою (P2 = 0,008).
Зміни ЛПВЩ на фоні лікування досліджуваним препаратом також були позитивними. В основній групі рівень ЛПВЩ статистично значуще підвищився на 20,2 ± 6,8 % (P1 = 0,03), тоді як у контрольній групі відмічалося невірогідне зниження ЛПВЩ на 3,7 ± 7,7 % (P1 = 0,12), при цьому різниця між обома групами була статистично значущою (P2 = 0,02). В обох досліджуваних групах спостерігалась тенденція до зниження загального холестерину, проте різниця до і після лікування в групах та між групами була статистично незначущою.
Для з’ясування можливих причин даних змін показників вуглеводного обміну аналізувався також ступінь резистентності до інсуліну й секреторної активності бета-клітин підшлункової залози. При цьому показники, що свідчать про ступінь резистентності до інсуліну периферичних тканин (індекс НОМА-ІР і рівень ІРІ в плазмі крові натще), на фоні лікування досліджуваним препаратом статистично значуще не змінилися (табл. 2). Відмічена менш виражена тенденція до збільшення індексу НОМА-ІР на 0,05 ± 9,02 % (P1 = 0,11) в основній групі після лікування досліджуваним препаратом, тоді як у контрольній групі цей показник підвищився більш значно — на 8,03 ± 10,3 % (P1 = 0,8), але різниця між групами була статистично незначущою (P2 = 0,5). Рівень ІРІ також більш значно й статистично значуще підвищувався в контрольній групі (на 9,7 ± 8,5 %, P1 = 0,01), тоді як в основній групі спостерігалася лише тенденція до збільшення цього показника (на 4,8 ± 7,5 %, P1 = 0,18); різниця між досліджуваними групами була статистично незначущою (P2 = 0,6).
Відмічені зміни показників секреторної активності бета-клітин (рівень ІРІ в плазмі крові й індекс НОМА-β). Так, у контрольній групі індекс НОМА-β підвищився на 19,2 ± 11,7 % (P1 = 0,04) (табл. 2). В основній групі також відмічалося збільшення цих показників, але воно було статистично незначущим (P1 = 0,1). Різниця між обома досліджуваними групами пацієнтів щодо показників ІРІ в плазмі крові й індексу НОМА-β наприкінці дослідження була статистично незначущою (P2 = 0,45).
Цікавими були зміни вмісту гормонів жирової тканини в плазмі крові. В основній групі на фоні лікування препаратом Стифімол відмічено статистично значуще зменшення лептину в плазмі крові (на 21,4 ± 6,1 %, P1 = 0,004), на той час як у конт–рольній групі рівень лептину статистично значуще збільшився (на 12,2 ± 7,1 %, P1 = 0,004); різниця між групами була статистично значущою (P2 = 0,008) (табл. 2, рис. 2).
Під впливом терапії досліджуваним препаратом рівень іншого гормону, що секретується адипоцитами, адипонектину, виявив тенденцію до збільшення — зріс на 19,30 ± 9,36 % (P1 = 0,39), тоді як у контрольній групі рівень адипонектину статистично значуще зменшувався на 6,92 ± 10,70 % (P1 = 0,01); різниця між групами була статистично незначущою (P2 = 0,07) (табл. 2, рис. 3).
Обговорення
У нашому дослідженні було доведено, що терапія комплексним препаратом Стифімол порівняно із стандартним лікуванням у хворих на ЦД 2-го типу з ожирінням та артеріальною гіпертензією призводить не тільки до статистично значущого зниження показників маси тіла, але й до покращання показників вуглеводного й ліпідного обміну.
Дія даного препарату обумовлена ефектами окремих його компонентів. Так, раніше в дослідженнях на тваринах був доведений позитивний вплив терапії екстрактом гарцинії камбоджійської, що є одним із компонентів Стифімолу, на ліпіди, рівень лептину й інсуліну в крові [10–12]. Також у клінічних дослідженнях був виявлений гіполіпідемічний ефект гарцинії камбоджійської в пацієнтів з ожирінням [13, 14].
Отримані нами дані свідчать про те, що вище–описані зміни показників глікемічного контролю й ліпідів крові не можна пояснити покращенням чутливості периферичних тканин до інсуліну і/або покращенням секреторної функції β-клітин підшлункової залози, оскільки зміни індексу НОМА-ІР, НОМА-β та ІРІ статистично не відрізнялися між досліджуваними групами. Ці дані відрізняються від даних, отриманих, наприклад, у дослідженні О.О. Сергієнко та співавт., у якому терапія Стифімолом призвела до зниження рівня ІРІ в плазмі крові й зменшення індексу НОМА-ІР [15]. Проте слід зауважити, що в дослідженні О.О. Сергієнка та спів–авт. брали участь пацієнти лише з ожирінням, без ЦД 2-го типу, у яких відмічалася виражена резистентність до інсуліну, проте не було вираженого порушення його секреції. У нашому дослідженні брали участь пацієнти зі стажем ЦД 2-го типу ≥ 5 років, певна кількість із яких отримувала інсулін, або комбінацію двох цукрознижувальних препаратів, або монотерапію метформіном. Можливі причини того, що не було очікуваних змін інсулінорезистентності (ІРІ й індексу НОМА-ІР тощо) на фоні зниження маси тіла в пацієнтів, у нашому дослідженні: 1) вже наявна інсулінотерапія на тлі зниженої секреторної активності β-клітин, 2) наявна терапія метформіном, на фоні якої складно побачити ефект щодо зниження інсулінорезистентності; 3) відсутність нормального рівня глюкози крові натще в більшості осіб, що не дозволяє точно оцінювати індекс НОМА-ІР. До того ж у дослідженні О.О. Сергієнка та співавт. пацієнти впродовж перших 1,5 міс. отримували вдвічі більшу дозу досліджуваного препарату, що не могло не вплинути на кінцеві результати дослідження [15].
Позитивний вплив Стифімолу на показники вуглеводного обміну можна також пояснити впливом хрому піколінату, який наявний в складі препарату, що вже було показано в попередніх дослідженнях [16].
Виявлений позитивний вплив терапії Стифімолом на ліпіди крові можна також пояснити наявністю у складі препарату L-карнітину, який у попередніх дослідженнях вже показав здатність знижувати рівень проатерогенних ліпопротеїдів [17, 18]. Дані щодо можливостей терапії L-карнітином знижувати рівень лептину в крові є суперечливими, проте раніше було доказано таку можливість саме в групі пацієнтів із цукровим діабетом, хоча й при застосуванні набагато вищих доз, ніж у нашому дослідженні [19]. З іншого боку, зниження рівня лептину може бути наслідком зменшення кількості жирової тканини на фоні терапії Стифімолом [7]. Тенденція до збільшення рівня адипонектину є, можливо, одним із компонентів позитивного впливу Стифімолу на вуглеводний обмін.
Висновки
1. Терапія препаратом Стифімол у дозі 1 капсула 3 рази на добу привела до покращення параметрів вуглеводного обміну, а саме зниження рівня HbA1c на 0,87 ± 0,14 % (P1 = 0,0001), а також зниження рівня глюкози в плазмі крові натще на 8,00 ± 4,26 % (P1 = 0,03).
2. Позитивна динаміка маси тіла в пацієнтів, які приймали препарат Стифімол, супроводжувалась покращенням показників ліпідного профілю крові: зниженням ЛПНЩ на 18,20 ± 5,43 % (P1 = 0,001), тригліцеридів — на 14,9 ± 6,5 % (P1 = 0,02), підвищенням ЛПВЩ на 20,2 ± 6,8 % (P1 = 0,03).
3. Терапія досліджуваним препаратом не впливала на резистентність до інсуліну, що обчислювалась за індексом НОМА-ІР і визначалась за рівнем ІРІ в плазмі крові натще.
4. На фоні лікування препаратом Стифімол відмічені зміни вмісту в плазмі крові гормонів жирової тканини: відбулося зменшення рівня лептину на 21,4 ± 6,1 % (P1 = 0,004), а також спостерігалася тенденція до збільшення рівня адипонектину на 19,30 ± 9,36 % (P1 = 0,39).
Конфлікт інтересів. Дослідження проводилося за підтримки ПрАТ «Київський вітамінний завод».
Список литературы
1. Lindström J., Ilanne-Parikka P. et al. Sustained reduction in the incidence of type 2 diabetes by lifestyle intervention: The follow-up results of the Finnish Diabetes Prevention Study // Lancet. — 2006. — Vol. 368. — P. 1673-1679.
2. The Diabetes Prevention Program Research Group: Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin // N. Engl. J. Med. — 2002. — Vol. 346. — P. 393-403.
3. UK Prospective Diabetes Study 7. UK Prospective Diabetes Study 7: response of fasting plasma glucose to diet therapy in newly presenting type II diabetic patients, UKPDS Group // Metabolism. — 1990. — Vol. 39. — Ð. 905-912.
4. Goldstein D.J. Beneficial health effects of modest weight loss // Int. J. Obes. Relat. Metab. Disord. — 1992. — Vol. 16. — P. 397-415.
5. Pastors J.G., Warshaw H., Daly A. et al. The evidence for the effectiveness of medical nutrition therapy in diabetes management // Diabetes Care. — 2002. — Vol. 25. — P. 608-613.
6. Look AHEAD Research Group. Eight-year weight losses with an intensive lifestyle intervention: the Look AHEAD study // Obesity. — 2014. — Vol. 22. — P. 5-13.
7. Зуєв К.О. Особливості баріатричного впливу Стифімолу в пацієнтів із цукровим діабетом 2-го типу з ожирінням та артеріальною гіпертензією // Міжнародний ендокринологічний журнал. — 2017. — № 8(13). — C. 596-603.
8. Зуєв К.О. Особливості впливу комбінації гарцинії камбоджійської, піколінату хрому, карнітину та екстракту бурих водоростей на антропометричні, клініко-метаболічні та гормональні показники у хворих на цукровий діабет 2-го типу з ожирінням та артеріальною гіпертензією / К.О. Зуєв // Тези доповідей міжнар. наук.-практ. конф. «Актуальні питання клінічної ендокринології, імунології та алергології»Чернівці, 24–25 жовтня 2013 р.] // Міжнародний ендокринологічний журнал. — 2013. — № 6(54). — C. 141-142.
9. Matthews D.R., Hosker J.P., Rudenski A.S. et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man // Diabetologia. — 1985. — Vol. 28. — P. 412-419.
10. Ishirara K., Oyaizu S., Onuki K. et al. Chronic (–)-hydroxycitrate administration spares carbohydrate utilization and promotes lipid oxidation during exercise in mice // J. Nutr. — 2000. — Vol. 130. — P. 2990-2995.
11. Hayamizu K., Hirakawa H., Oikawa D. et al. Effect of Garcinia cambogia extract on serum leptin and insulin in mice // Fitoterapia. — 2003. — Vol. 74. — P. 267-273.
12. Kim K.Y., Lee H.N., Kim Y.J., Park T. Garcinia cambogia extract ameliorates visceral adiposity in C57BL/6J mice fed on a high-fat diet // Biosci Biotechnol. Biochem. — 2008. — Vol. 72. — P. 1772-1780.
13. Kim J.E., Jeon S.M., Park K.H. et al. Does Glycine max leaves or Garcinia Cambogia promote weight-loss or lower plasma cholesterol in overweight individuals a randomized control trial // Nutr. J. — 2011. — Vol. 10. — P. 94-108.
14. Vasques C.A., Rossetto S., Halmenschlager G. et al. Evaluation of the pharmacotherapeutic efficacy of Garcinia cambogia plus Amorphophallus konjac for the treatment of obesity // Phytother. Res. — 2008. — Vol. 22. — P. 1135-1140.
15. Сергієнко О.О., Сергієнко В.О., Підсадочна І.І. та ін. Ефективність «Стифімолу» в лікуванні ожиріння // Фундаментальна та клінічна ендокринологія: проблеми, здобутки, перспективи: Восьмі Данилевські читання: матеріали наук.-практ. конф. з міжнар участю (Харків, 26–27 лютого 2009 р.) / Ін-т проблем ендокринної патології ім. В.Я. Данилевського АМН України, Харк. нац. мед. ун-т, Харк. мед. акад. післядиплом. освіти МОЗ України; відповід. ред. Ю.І. Караченцев. — Х., 2009.
16. Sala M., Breithaupt L., Bulik C.M. et al. A Double-Blind, Randomized Pilot Trial of Chromium Picolinate for Overweight Individuals with Binge-Eating Disorder: Effects on Glucose Regulation // J. Diet Suppl. — 2017. — Vol. 14(2). — P. 191-199.
17. Derosa G., Cicero A.F., Gaddi A. et al. The effect of L-carnitine on plasma lipoprotein (a) levels in hypercholestero–lemic patients with type 2 diabetes mellitus // Clin. Ther. — 2003. — Vol. 25(5). — P. 1429-1439.
18. Serban M.C., Sahebkar A., Mikhailidis D.P. et al. Impact of L-carnitine on plasma lipoprotein(a) concentrations: A systematic review and meta-analysis of randomized controlled trials // Sci. Rep. — 2016. — Vol. 12(6). — P. 19188.
19. Nazary-Vannani A., Ghaedi E., Mousavi S.M. et al. The effect of L-carnitine supplementation on serum leptin concentrations: a systematic review and meta-analysis of randomized controlled trials // Endocrine. — 2018. — Vol. 60(3). — P. 386-394.

/604-1.jpg)
/605-1.jpg)
/605-2.jpg)
/606-1.jpg)