Резюме
Актуальність. Мікроекосистема організму людини тісно взаємодіє з імунною та ендокринною системами, і власне мікробіом приепітеліальної біоплівки слизової оболонки товстої кишки є одним з найчутливіших біотопів, здатних зазнавати змін за різних захворювань. Мета. Встановлення мікробіологічної структури (видовий склад і популяційний рівень мікрофлори) приепітеліальної біологічної плівки слизової оболонки товстої кишки білих щурів з експериментальним гіпотиреозом. Матеріали та методи. Проведено експерименти на 25 статевозрілих самцях білих щурів масою 220–240 г, з яких 15 тварин були віднесені до контрольної групи (інтактні тварини), 10 щурів належали до основної групи. Експериментальний гіпотиреоз моделювали шляхом внутрішньошлункового введення мерказолілу впродовж 14 днів. У стерильних умовах проводили лапаротомію, брали відрізок (до 3 см) товстої кишки з її вмістом. Відмиту частину кишки гомогенізували зі стерильним 0,9% розчином хлориду натрію. Готували серію десятикратних розведень з концентрацією суміші від 10–2 до 10–7. З кожної пробірки 0,01 мл висівали на тверді оптимальні живильні середовища з подальшим виділенням та ідентифікацією мікробів за морфологічними, тинкторіальними, культуральними та біохімічними властивостями. Результати. Колонізаційна резистентність приепітеліальної біоплівки слизової оболонки товстої кишки в експерименті на дослідних тваринах при моделюванні гіпотиреозу зазнає змін: знижується популяційний рівень лактобактерій на 51,58 %, біфідобактерій — на 37,35 %, бактероїдів — на 22,82 %, пептострептококів — на 6,5 %. Приепітеліальна біоплівка контамінується кишковою паличкою та іншими ентеробактеріями (Proteus, Klebsiella), P.niger, стафілококами. Встановлено зростання популяційного рівня кишкових паличок на 10,31 % і клостридій на 8,2 %. Детерміновано дисбіотичні порушення І–III ступеня, що потребує корекції і лікування за допомогою пробіотиків. Висновки. В експерименті на білих щурах при мерказоліл-модельованому гіпотиреозі встановлено елімінацію бактерій роду Bifidobacterium, Lactobacillus, контамінацію і колонізацію біотопу умовно-патогенними мікроорганізмами родів Proteus, Klebsiella, Staphylococcus, Peptococcus на тлі зростання популяційного рівня кишкової палички. Наявні порушення мікробіоценозу у вигляді дисбіозу I–III ступеня.
Актуальность. Микроэкосистема организма человека тесно взаимодействует с иммунной и эндокринной системами, и собственно микробиом приэпителиальной биопленки слизистой оболочки толстого кишечника является одним из самых чувствительных биотопов, которые способны претерпевать изменения при различных заболеваниях. Цель. Установление микробиологической структуры (видовой состав и популяционный уровень микрофлоры) приэпителиальной биологической пленки слизистой оболочки толстого кишечника белых крыс с экспериментальным гипотиреозом. Материалы и методы. Проведены эксперименты на 25 половозрелых самцах белых крыс массой 220–240 г, из которых 15 животных отнесены к контрольной группе (интактные животные), 10 крыс принадлежали к основной группе. Экспериментальный гипотиреоз моделировали путем внутрижелудочного введения мерказолила в течение 14 дней. В стерильных условиях проводили лапаротомию, брали отрезок (до 3 см) толстого кишечника с его содержимым. Отмытую часть кишечника гомогенизировали со стерильным 0,9% раствором хлорида натрия. Готовили серию десятикратных разведений с концентрацией исходной смеси от 10–2 до 10–7. Из каждой пробирки высевали 0,01 мл на твердые оптимальные для отдельного таксона питательные среды с последующим выделением и идентификацией микробов по морфологическим, тинкториальным, культуральным и биохимическим свойствам. Результаты. Колонизационная резистентность приэпителиальной биопленки слизистой оболочки толстого кишечника в эксперименте на опытных животных при моделировании гипотиреоза изменяется: снижается популяционный уровень лактобактерий на 51,58 %, бифидобактерий — на 37,35 %, бактероидов — на 22,82 %, пептострептококков — на 6,5 %. Приэпителиальная биопленка контаминируется кишечной палочкой и другими энтеробактериями (Proteus, Klebsiella), P.niger, стафилококками. Установлено возрастание популяционного уровня кишечных палочек на 10,31 % и клостридий на 8,2 %. Детерминированы дисбиотические нарушения I, II и III степени, что требует коррекции с помощью пробиотиков. Выводы. В эксперименте на белых крысах при мерказолил-моделируемом гипотиреозе установлена элиминация бактерий рода Bifidobacterium, Lactobacillus, контаминация и колонизация биотопа условно-патогенными микроорганизмами родов Proteus, Klebsiella, Staphylococcus, Peptococcus на фоне роста популяционного уровня кишечной палочки. Присутствует нарушение микробиоценоза в виде дисбактериоза I–III степени.
Background. The microecosystem of human organism closely cooperates with immune and endocrine systems, and in particular the microbiome of the pre-epithelial biofilm of the large intestine is one of the most sensitive biotopes that is able to change in different diseases. The purpose was to establish the microbiological structure (species composition and population level of microflora) of the pre-epithelial biofilm of the large intestine in albino rats with experimental hypothyroidism. Materials and methods. Experiments were carried out on 25 mature male albino rats weighing 220–240 g, of which 15 animals were included to the control group (intact animals), and 10 rats — to the main group. The experimental thyrotoxicosis was simulated by intragastric administration of mercazolilum for 14 days. Under sterile conditions, laparotomy was performed; a sample (up to 3 cm) of the large intestine with its contents was taken. The washed portion of the intestine was homogenized with a sterile 0.9% NaCl solution. A series of ten-fold dilutions with 10–2 to 10–7 concentrations of the initial mixture were prepared. From each tube, 0.01 ml were seeded on solid optimal nutrient media with subsequent isolation and identification of microbes according to morphological, tinctorial, cultural and biochemical properties. Results. Colonization resistance of the pre-epithelial biofilm of the large intestine changed in experimental animals when modeling hypothyroidism: the population level of lactobacteria reduced by 51.58 %, bifidobacteria — by 37.35 %, bacteroides — by 22.82 %, peptostreptococci — by 6.5 %. Pre-epithelial biofilm was contaminated by collibacillus and other enterobacteria (Proteus, Klebsiella), P.niger, staphylococci. The increase was detected in the population level of collibacillus by 10.31 % and clostridia by 8.2 %. Dysbiotic violations of I, II and III degrees were determined that requires a correction by means of probiotics. Conclusions. In the experimental research of mercazolilum-induced hypothyroidism on albino rats, the elimination of Bifidobacterium, Lactobacillus was established; contamination and colonization of biotope by opportunistic pathogenic microorganisms of Proteus, Klebsiella, Staphylococcus, Peptococcus were detected on the background of increased population level of collibacillus. There are violations of microbiocenosis in the form of dysbacteriosis degree I–III.
Вступ
Результати досліджень засвідчують, що будь-які мікроорганізми, як ті, що живуть вільно, так і ті, що мешкають в організмі хазяїна (людини і тварини), ведуть іммобілізований спосіб життя [1]. Тобто в природних умовах значна кількість мікроорганізмів персистує у вигляді фіксованих до різних поверхонь мікроколоній. Ці угруповання мікроорганізмів продукують екзополісахаридний глікокалікс, який «огортає» мікробну клітину та формує біологічну плівку на поверхні, в середині якої відбувається поділ бактерій і міжклітинні взаємозв’язки.
На відміну від вільноживучих представників мікробіому представники нормального мікробіому зазвичай фіксуються до рецепторів клітин у відповідних, з оптимальними умовами для мікроорганізмів, місцях шкіри і слизової оболонки, утворюючи приепітеліальну біологічну плівку, в якій знаходяться мікроорганізми та муцин. Біологічна плівка формується в онтогенезі внаслідок спільної гармонійної діяльності макроорганізму (хазяїна) та його фізіологічного мікробіому. Біоплівка товстої кишки — основний резервуар екзогенного мікробіому в організмі хазяїна. При формуванні біоплівки слизової оболонки товстої кишки окремі мікробні клітини нормального мікробіому, за реалізацією ко-адгезії складних механізмів комунікативних зв’язків, специфічно об’єднуються в різноманітних відношеннях (нейтралізму, конкуренції, мутуалізму, синергізму, коменсалізму, паразитизму та ін.) [2, 3]. Шляхом таких видів взаємодій формуються стабільні своєрідні «мікробні ансамблі» — мікроколонії, занурені до глікокаліксного матриксу. Отже, біоплівка формує колонізаційну резистентність слизової оболонки товстої кишки.
Біоплівка — це екзополісахаридно-муциновий матрикс на слизовій оболонці, через який відбувається активний обмін речовин між мікробіомом і макроорганізмом. Найважливішими з функцій приепітеліальної біоплівки є захисні (колонізаційна резистентність), трофічні, обмінні та енергетичні зв’язки [4, 5]. Завдяки унікальності структури та функцій приепітеліальних біоплівок у нормі забезпечується довічне збереження облігатного автохтонного мікробіому, індивідуального щодо кожної людини і тварини [6, 7].
Надлишок або недостатність того чи іншого субстрату, метаболіту, а також зміни фізіологічного стану організму, інфекційне чи неінфекційне захворювання є сигналом для адаптивних компенсаторних або необоротних змін мікроекологічної системи, включно з мікробіомом слизової оболонки [8, 9–14]. Останнє може порушувати структуру та функції приепітеліальної біоплівки, лімітувати колонізаційну резистентність слизової оболонки біотопу, що становить на сьогодні не до кінця вивчене наукове питання.
Мета. Встановлення мікробіологічної структури приепітеліальної біологічної плівки слизової оболонки товстої кишки білих щурів з експериментальним гіпотиреозом.
Матеріали та методи
Експерименти проведено на 25 самцях білих щурів масою 220–240 г (10 тварин основної групи, 15 — інтактних), що знаходились в однакових умовах. Перед експериментом тварини підлягали обсервації впродовж 10–14 днів і щоденному спостереженню. Тварин годували один раз на добу вранці гранульованим комбінованим кормом ПК 121-7. Енергетична цінність кормів становила від 5,8 до 6,2 кДж на кілограм маси тіла на добу. Воду тваринам давали протягом усього часу спостереження та експерименту в необмеженій кількості. Умови утримання були стабільними. Всі тварини відповідали IV типу чистоти за мікробіологічними та паразитологічними стандартами.
Моделювання гіпотиреозу у тварин проводили шляхом введення щоденно протягом 14 днів розчину мерказолілу (ВАТ «Фармацевтична фірма «Здоров’я», Україна) з розрахунку 10 мг/кг маси тіла металічним зондом безпосередньо у шлунок. Мерказоліл розчиняли стерильною дистильованою водою. Інтактним тваринам за аналогічним типом уводили протягом 14 днів 1,0 мл стерильної дистильованої води.
Дослідження мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки проводили через 14 днів після початку формування гіпотиреозу. В процесі експерименту тварин зважували декілька разів, визначали динаміку маси, поведінки, реакцію на слухові та зорові сигнали тощо від початку введення мерказолілу до часу завершення дослідження та евтаназії.
Після завершення експерименту дослідних та інтактних тварин забивали під глибоким ефірним наркозом. Експериментальні роботи проводили з дотриманням основних положень GLP (1981), «Правил проведення робіт з використанням експериментальних тварин» (1977), Конвенції Ради Європи про охорону хребетних тварин, що використовують в експериментальних та інших цілях, від 18.03.1981 р., Директиви EZC № 609 від 24.11.1986 р. і наказу МОЗ України № 281 від 01.11.2000 р. Комісією з питань біомедичної етики Буковинського державного медичного університету (БДМУ) порушень морально-етичних норм під час виконання дослідження не виявлено.
У боксі за стерильних умов у тварин розкривали черевну порожнину, відрізали 1,5–2 см товстої кишки з її вмістом. Спочатку видавлювали вміст, в якому вивчали мікробіом. Потім стерильними ножицями розрізали кишку по довжині. Отриману частину товстої кишки очищали стерильним шпателем від умісту, а потім промивали проточною стерильною водою протягом 3 хвилин для вимивання залишків умісту. Далі шматок кишки промивали 7 разів у стерильному ізотонічному розчині хлориду натрію у чашках Петрі. Після цього шматочки розміщували на стерильному фільтрувальному папері, підсушували, клали на стерильний вощений папір і зважували. Вибирали часточку не менше 0,01 г товстої кишки, далі її гомогенізували у десятикратному об’ємі стерильного ізотонічного розчину хлориду натрію, одержуючи розведення стінки товстої кишки 1 : 10 (10–1). Із цієї зависі готували серійний десятикратний титраційний ряд пробірок з концентраціями суміші від 10–2 до 10–7. За допомогою стерильних мікропіпеток відбирали з кожної пробірки ряду по 0,1 мл зависі та наносили на відповідні, оптимальні для кожного таксону живильні середовища, де за допомогою стерильного скляного шпателя розподіляли матеріал на поверхні середовища.
Посів факультативних аеробних та анаеробних мікроорганізмів культивували у термостаті (37 °С) протягом 24–48 годин. Посів облігатних анаеробних бактерій вирощували у стаціонарному анаеро–статі «CO2 Incubator T-125» (Sweden) протягом 5–7 днів (при появі росту), інколи до 14 діб. Після цього вивчали отримані однотипові колонії для кожного таксону мікробів. Із колоній одержували чисті культури облігатних і факультативних анаеробних та аеробних мікроорганізмів, яких ідентифікували до роду (виду) за морфотинкторіальними, культуральними та біохімічними властивостями, за ознаками патогенності та антигенною структурою (за необхідності).
Результати експериментальних досліджень були проаналізовані з використанням методів варіаційної статистики. Статистичну обробку проводили за допомогою прикладних програм MS Excel 2010 та Statistica 7.0 (StatSoft Inc., США). Вірогідність отриманих даних вираховували за методом парного тесту із застосуванням t-критерію Student. Різницю вважали вірогідною при р > 0,05.
Результати
Приепітеліальна біоплівка слизової оболонки товстої кишки відіграє роль потужного захисного бар’єру, який перешкоджає патологічній транслокації у внутрішнє середовище організму бактерій, вірусів, мікробних і харчових токсинів, антигенів та інших шкідливих речовин екзогенного та ендогенного походження. У виконанні приепітеліальною біоплівкою захисної функції ключова роль належить синергічній діяльності популяцій автохтонного нормального мікробіому та імунної системи, що стимулюється симбіотичними бактеріями, які відіграють ключову роль у колонізаційній резистентності слизової оболонки товстої кишки.
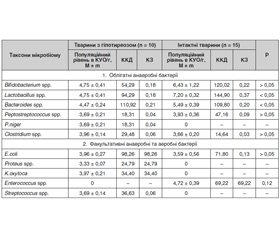
За індексом постійності, частотою виявлення, індексом видового багатства Маргалефа, індексом видового різноманіття Уїтеккера до головного мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки інтактних білих щурів належать бактерії роду Lactobacillus, Bacteroides, Escherichia, Bifidobacterium. Ці бактерії є також домінуючими (за індексом видового домінування Сімпсона) у приепітеліальній біоплівці слизової оболонки товстої кишки контрольних тварин. У тварин з експериментальним гіпотиреозом головний мікробіом формують бактерії роду Bacteroides, Escherichiа. Наведені у табл. 1 дані засвідчують наявність незначних змін таксономічного складу мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки експериментальних тварин із гіпотиреозом. В експериментальних тварин відбувається елімінація з приепітеліальної біоплівки слизової оболонки товстої кишки ентерококів і часткова елімінація бактерій роду Bifidobacterium і Lactobacillus. За таких умов здійснюється контамінація та колонізація слизової оболонки товстої кишки умовно-патогенними (Proteus, Klebsiella) ентеробактеріями, стафілококом і пептококом.
Стан мікробіому будь-якого біотопу визначається не тільки таксономічним складом, більш важливим є кількісна характеристика мікробіоценозу, де встановлюється кількісне домінування та роль кожного таксону у системі мікроекологічних відношень «мікробіом — макроорганізм». Результати вивчення популяційного рівня мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки експериментальних тварин із гіпотиреозом наведені у табл. 1.
За популяційним рівнем, коефіцієнтом кількісного домінування, значущості з урахуванням індексу постійності, частоти виявлення, індексом видового багатства Маргалефа, видового різноманіття Уїтеккера та індексом видового домінування головний мікробіом, який формує колонізаційну резистентність слизової оболонки товстої кишки інтактних експериментальних тварин, складається з бактерій роду Bifidobacterium, Lactobacillus та Bacteroideus. Додатковий мікробіом біотопу представлений бактеріями роду Escherichiа та Enterococcus.
Формування та розвиток експериментального гіпотиреозу у білих щурів супроводжується зниженням популяційного рівня в приепітеліальній біоплівці лактобактерій (на 3 порядки) — на 51,58 %, біфідобактерій — на 37,35 %, бактероїдів — на 22,82 %, пептострептококів — на 6,5 %. При цьому зростає популяційний рівень кишкових паличок на 10,31 %, клостридій — на 8,2 %.
Зміна популяційного рівня різних таксонів у мікробіоценозі призводить до порушень ролі представників товстокишкового біоценозу у підтримці мікроскопічного гомеостазу. Так, знижується роль найважливіших за представництвом у складі товстокишкового мікробіоценозу людини і тварини та за мультифункціональною роллю у підтримці мікроекологічної системи «мікробіом — макроорганізм» бактерій роду Bifidobacterium на 2 порядки (на 27,29 %), Lactobacillus — майже на 3 порядки (на 52,72 %). Зменшення кількості біфідобактерій і лактобактерій у приепітеліальній біоплівці слизової оболонки товстої кишки негативно впливає на стійкість (зниження) травного тракту до заселення його умовно-патогенними мікроорганізмами приепітеліальної біоплівки слизової оболонки і сприяє розвитку інфекційно-запальних процесів на слизовій оболонці та негативних наслідків, що з цього витікають. При цьому зростає роль у мікробіоценозі приепітеліальної біоплівки слизової оболонки товстої кишки кишкової палички на 36,82 % та інших ентеробактерій (Proteus, Klebsiella), P.niger, стафілококів, які контамінують слизову оболонку товстої кишки експериментальних тварин із гіпотиреозом.
Обговорення
За індивідуальними для кожної експериментальної тварини даними таксономічного складу, індексу постійності, частоти виявлення, індексом видового багатства Маргалефа, видового різноманіття Уїтеккера, видового домінування Сімпсона та значень популяційного рівня, коефіцієнту кількісного домінування також встановлено ступінь порушень мікробіоценозу приепітеліальної біоплівки слизової оболонки товстої кишки експериментальних тварин із гіпотиреозом. Результати встановлення ступеня дисбактеріозу у приепітеліальній біоплівці слизової оболонки товстої кишки білих щурів з експериментальним гіпотиреозом наведені у табл. 2.
Показано, що в експериментальних тварин із гіпотиреозом у приепітеліальній біоплівці слизової оболонки товстої кишки формуються порушення І і ІІ ступеня, які потребують корекції пробіотиками та лікування основного захворювання. У двох тварин виявлено порушення ІІІ ступеня, що потребує лікування пробіотиками.
Таким чином, формування та перебіг гіпотиреозу в експериментальних тварин супроводжується порушенням таксономічного складу та популяційного рівня як головного, так і додаткового мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки, що суттєво знижує колонізаційну резистентність слизової оболонки товстої кишки. Формування у частини (20 %) експериментальних тварин дисбактеріозу ІІІ ступеня потребує терапії виявлених порушень шляхом застосування заходів і засобів, спрямованих на деконтамінацію умовно-патогенних мікроорганізмів та корекцію таксономічного складу і популяційного рівня мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки.
Висновки
1. В експериментальних тварин із гіпотиреозом знижується колонізаційна резистентність слизової оболонки товстої кишки внаслідок порушень таксономічного і кількісного складу головного та додаткового мікробіому приепітеліальної біоплівки слизової оболонки товстої кишки.
2. Формування і перебіг гіпотиреозу в експериментальних тварин супроводжуються елімінацією з приепітеліальної біоплівки слизової оболонки товстої кишки ентерококів, бактерій роду Bifidobacterium, Lactobacillus, та здійснюється контамінація і колонізація приепітеліальної біоплівки слизової оболонки товстої кишки умовно-патогенними ентеробактеріями (Proteus, Klebsiella), стафілококами і пептококами.
3. У приепітеліальній біологічній плівці слизової оболонки товстої кишки білих щурів із гіпотиреозом знижується популяційний рівень головного мікробіому: бактерій роду Bifidobacterium (на два порядки — 35,37 %), Lactobacillus (майже на три порядки — 53,5 %), а також окремих таксонів додаткового мікробіому на тлі зростання кількості умовно-патогенних ентеробактерій, клостридій.
Перспективи подальших досліджень
Отримані та наведені результати є підставою для вивчення мікробіому дистального відділу тонкої кишки в експериментальних тварин із гіпотиреозом, вивчення можливостей корекції мікробіому за допомогою пробіотичних препаратів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. De Weirdt R., Van de Wiele T. Micromanagement in the gut: microenvironmental factors govern colon mucosal biofilm structure and functionality // NPJ Biofilms and Microbiomes. — 2015. — Vol. 1. — P. 15026. — doi: 10.1038/npjbiofilms.2015.26.
2. Sirisinha S. The potential impact of gut microbiota on your health: Current status and future challenges // Asian Pac. J. Allergy Immunol. — 2016. — Vol. 34(4). — P. 249-264. — doi: 10.12932/AP0803.
3. Dore J., Multon M.C., Behier J.M. et al. The human gut microbiome as source of innovation for health: Which physiological and therapeutic outcomes could we expect? // Therapie. — 2017. — Vol. 72(1). — P. 21-38. — doi: 10.1016/j.therap.2016.12.007.
4. Mori K., Nakagawa Y., Ozaki H. Does the gut microbio–ta trigger Hashimoto’s thyroiditis? // Discov. Med. — 2012. — Vol. 14(78). — P. 321-6. — doi: 10.4049/jimmunol.1502465.
5. Min Y.W., Rhee P.L. The Role of Microbiota on the Gut Immunology // Clin. Ther. — 2015. — Vol. 37(5). — P. 968-75. — doi: 10.1016/j. clinthera.2015.03.009.
6. Hooper L.V., Littman D.R., Macpherson A.J. Interactions between the microbiota and the immune system // Science. — 2012. — Vol. 336(6086). — P. 1268-73. — doi: 10.1126/science.1223490.
7. Sicard J.F., Le Bihan G., Vogeleer P. et al. Interactions of Intestinal Bacteria with Components of the Intestinal Mucus // Front. Cell. Infect. Microbiol. — 2017. — Vol. 7. — P. 387. — doi: 10.3389/fcimb.2017.00387.
8. Hooper L.V., Macpherson A.J. Immune adaptations that maintain homeostasis with the intestinal microbiota // Nat. Rev. Immunol. — 2010. — Vol. 10(3). — P. 159-69. — doi: 10.1038/nri2710.
9. Rakoff-Nahoum S., Foster K.R., Comstock L.E. The evolution of cooperation within the gut microbiota // Nature. — 2016. — Vol.12. — P.533(7602):255-9. doi: 10.1038/nature17626.
10. Hooper L.V., Littman D.R., Macpherson A.J. Interactions between the microbiota and the immune system // Scien–ce. — 2012. — Vol. 336(6086). — P. 1268-73. — doi: 10.1126/science.1223490.
11. Geuking M.B., Köller Y., Rupp S., McCoy K.D. The interplay between the gut microbiota and the immune system // Gut. Microbes. — 2014. — Vol. 5(3). — P. 411-8. — doi: 10.4161/gmic.29330.
12. Virili C., Centanni M. Does microbiota composition affect thyroid homeostasis? // Endocrine. — 2015. — Vol. 49(3). — P. 583-7. — doi: 10.1007/s12020-014-0509-2.
13. Kunc M., Gabrych A., Witkowski J.M. Microbiome impact on metabolism and function of sex, thyroid, growth and parathyroid hormones // Acta Biochim. Pol. — 2016. — Vol. 63(2). — P. 189-201. — doi: 10.18388/abp.2015_1093.
14. Сидорчук Л.І. Мікробіом приепітеліальної біоплівки товстої кишки білих щурів з експериментальним тиреотоксикозом // Міжнародний ендокринологічний журнал. — 2017. — Т. 13(8). — С. 612-617. — doi: 10.22141/2224-0721.13.8.2017.119280.

/638-1.jpg)
/639-1.jpg)