Вступ
Сексуальність чоловіка розглядається як комплекс біопсихосоціальних процесів. Підтримання відповідної статевої активності регулюється складним комплексом, який формується з нейроендокринної, судинної систем і метаболічних процесів [1, 2]. Статева функція — важливий елемент нормального способу життя чоловіка. Крім того, статеві розлади спостерігаються у більше ніж 150 млн чоловіків у всьому світі та проявляються розладами всіх складових копулятивного циклу — змінами статевого потягу, ерекцій, еякуляцій та оргазму.
Еректильна дисфункція (ЕД) — одна з найчастіших загальних хронічних дисфункцій у чоловіків після 40-річного віку. Поширеність ЕД у загальній популяції, за даними Массачусетського дослідження з вивчення старіння чоловіків (MMAS), становила 52 % у чоловіків віком 40–79 років, причому помірна ЕД спостерігалася у 25,2 %, мінімальна — у 17,2 % і тяжка — у 9,6 % обстежених. ЕД діагностовано у 28 % чоловіків із цукровим діабетом (ЦД), у 9 % — із серцево-судинними захворюваннями (ССЗ) та у 15 % — з артеріальною гіпертензією (АГ) [3].
Статеві розлади належать до одного з найпоширеніших ускладнень ЦД. Найчастіше у чоловіків із ЦД спостерігається ЕД — нездатність чоловіка досягти та/або підтримувати ерекцію статевого члена, достатню для здійснення задовільного статевого акту. За даними різних дослідників, статеві розлади відзначаються у 50–75 % чоловіків, хворих на ЦД, і проявляються розладами всіх складових копулятивного циклу — змінами статевого потягу, ерекцій, еякуляцій та оргазму [4]. Згідно з даними MMAS, у 35 % чоловіків віком 40–70 років наявна ЕД, причому превалювання та тяжкість зростають з віком і наявністю коморбідних станів — ЦД 2-го типу, вісцерально-абдомінального ожиріння, АГ і ССЗ [5]. Повна імпотенція відзначалася у 28 % чоловіків, хворих на ЦД, у той час як у загальній популяції чоловіків вона траплялася лише у 9,6 % обстежених. Вважають, що у структурі ЕД хворі на ЦД становлять до 40 %, а ССЗ — до 30 % [3, 6].
ЦД — найбільш загальне метаболічне захворювання: у 2012 р. він діагностований у 22,3 млн осіб (7 % населення) у США, на його лікування припадало 176 млрд доларів прямих коштів і 69 млрд доларів непрямих витрат. ЦД 2-го типу становить 90–95 % всіх випадків діабету, спостерігається постійне підвищення його частоти [7].
Дані MMAS також засвідчили у чоловіків тісну асоціацію частоти ЕД з віком. Річний ступінь поширеності ЕД зростає з кожною віковою декадою і становить 12,4, 29,8 і 46,4 випадку на 1000 чоловіків віком 40–49, 50–59 і 60–69 років відповідно. Ризик розвитку ЕД — приблизно 26 випадків на 1000 чоловіків щорічно та підвищується за наявності таких захворювань, як ЦД, АГ і хвороби серця [8].
Дані щодо частоти ЕД у чоловіків із ЦД неодно–значні. За різними джерелами, 35–75 % чоловіків із ЦД мають ЕД будь-якого ступеня, причому ЕД у них часто асоціюється з коморбідними станами — АГ, ожирінням, атеросклерозом, ССЗ, гіперхолестеринемією. Тяжкість ЕД корелює з глікемічним контролем, тривалістю ЦД, наявністю хронічних діабетичних ускладнень [9]. Встановлено, що при ЦД статеві розлади розвиваються на декілька років раніше, ніж у загальній популяції, та мають більш тяжкий перебіг. До того ж ЕД нерідко може бути першим симптомом ЦД 2-го типу і виявляється на декілька місяців раніше, ніж маніфестують симптоми діабету. У чоловіків із ЦД ризик розвитку ЕД утричі вищий, ніж у загальній популяції [6].
Мета роботи: дослідити вплив судинних і гормональних чинників на розвиток еректильної дисфункції у чоловіків із цукровим діабетом 1-го та 2-го типів.
Матеріали та методи
Для з’ясування впливу віку та клінічного перебігу ЦД проаналізовано результати обстеження 205 пацієнтів чоловічої статі, хворих на ЦД 2-го типу, та 286 чоловіків, хворих на ЦД 1-го типу.
Пацієнтам було проведено анкетування з використанням опитувальника «Міжнародний індекс еректильної функції». Допплерівська ультрасонографія судин статевого члена була проведена у 27 чоловіків, хворих на ЦД. Визначення рівнів тесто–стерону (Т), лютеїнізуючого (ЛГ) і фолікулостимулюючого (ФСГ) гормонів у крові обстежених пацієнтів здійснювали імуноферментним методом.
Результати
У хворих на ЦД 2-го типу спостерігалася вікова залежність частоти ЕД, яка у чоловіків віком до 40 років становила 6,3 %, у віковій групі 41–50 років — 25,4 % і в осіб старше 60 років — 36,1 %. У той же час у чоловіків із ЦД 1-го типу найбільша частка з порушенням статевої функції була у групі 41–50 років (35,6 %), після чого спостерігалося значне зниження частоти скарг на ЕД з боку чоловіків, хворих на ЦД 1-го типу (7,4 % у групі хворих старше 60 років) (табл. 1).
Отримані дані свідчать, що чинник віку у чоловіків, хворих на ЦД 2-го типу, має вагоме значення, а у чоловіків із ЦД 1-го типу втрачає провідну роль у розвитку порушень статевої функції, стає вторинним, підпорядкованим клінічному перебігу хвороби.
За результатами наших досліджень, частота ЕД має пряму залежність із тривалістю ЦД. У чоловіків, хворих на ЦД 2-го типу, частота порушення еректильної функції виражено зростала в групі пацієнтів із тривалістю ЦД понад 5–10 років і понад 10 років після встановлення діагнозу (з 14,7 % у групі, де тривалість становила 2–5 років, до 32,2 % при тривалості ЦД 2-го типу 5–10 років). Характерно, що у пацієнтів із тривалістю ЦД менше одного року ЕД відзначалась у чоловіків, хворих на ЦД 2-го типу, втричі частіше, ніж у хворих на ЦД 1-го типу, що підтверджує роль чинника віку в розвитку ЕД для осіб з ЦД 2-го типу та можливий вплив латентного періоду ЦД 2-го типу.
/646-1.jpg)
У хворих на ЦД і ЕД при проведенні допплерівської ультрасонографії судин статевого члена виявлено зниження пікової систолічної швидкості (ПСШ) кровотоку в a. dorsalis penis порівняно з чоловіками контрольної групи (табл. 2). Резистентний і пульсаційний індекси були вірогідно нижчими у хворих на ЦД, ніж у чоловіків контрольної групи, при дослідженні як a. cavernosum, так і a. dorsalis penis у стані спокою.
Реакція на введення вазоактивного препарату (ВАП) інтракавернозно у хворих на ЦД була менш інтенсивною порівняно з чоловіками контрольної групи для a. сavernosum на 5, 15, 30-й хв, а для a. dorsalis penis — на 5-й та 30-й хв.
Приріст ПСШ кровотоку був послаблений у хворих на ЦД, а абсолютні показники — нижчими в a. сavernosum протягом усього періоду переходу від стану спокою до фази ригідної ерекції з більш значним підйомом на 15-й хв і деяким послабленням через 30 хв після введення ВАП.
Суттєву роль у патогенезі ЕД у чоловіків із ЦД 2-го типу відіграє зниження рівнів андрогенів. Низькі рівні андрогенів викликають зниження лібідо, що ще більше погіршує якість адекватних і спонтанних ерекцій. Андрогенний дефіцит може бути загальним знаменником різних патологічних станів, які впливають на ендотелій, і центральним чинником розвитку метаболічного синдрому, ЦД 2-го типу та ЕД [14].
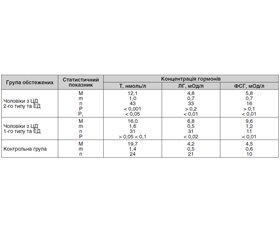
Проведеними нами дослідженнями стану системи «гіпофіз — статеві залози» встановлено, що у чоловіків із ЦД 2-го типу середні рівні загального тестостерону в крові були вірогідно нижчі порівняно з чоловіками контрольної групи, а у хворих на ЦД 1-го типу такої різниці не виявлено (табл. 3).
/647-1.jpg)
Аналіз показника рівнів Т у крові в обстежених індивідуально пацієнтів, хворих на ЦД 2-го типу з ЕД, свідчив про зниження рівня Т у 39 % обстежених чоловіків. Натомість у чоловіків із ЦД 1-го типу та статевими розладами середній рівень Т показував тенденцію до зниження, а знижені рівні Т у крові спостерігалися тільки у 12 % пацієнтів. Середні рівні гонадотропінів у чоловіків із ЦД 2-го типу та ЕД вірогідно не змінювалися, тоді як у пацієнтів із ЦД 1-го типу були помірно підвищені порівняно з контрольною групою, а також із групою осіб, хворих на ЦД 2-го типу. Отримані результати свідчать, що андрогенний дефіцит у чоловіків, хворих на ЦД 2-го типу з ЕД, відіграє суттєву роль у патогенезі статевих порушень, у той час як при ЦД 1-го типу його роль не є такою значущою.
Отже, андрогенний дефіцит у чоловіків із ЦД 2-го типу порушує фізіологічний і біохімічний субстрати еректильної функції. Ці процеси є зворотними та нормалізуються у разі медикаментозної компенсації дефіциту тестостерону. Вважається, що, з одного боку, поєднане ураження центральної і периферичної ланок регуляції гіпофізарно-гонадної системи у чоловіків із ЦД 2-го типу, особливо за умови наявності надмірної маси тіла, пов’язане з інволютивними змінами тестикулярної тканини та кори головного мозку, атеросклеротичними процесами в судинах і впливом хронічних захворювань. З іншого боку, старіння чоловіків як один з основних станів, що пов’язують із ЦД 2-го типу та віковим андрогенним дефіцитом, асоціюється з дефектом сигналу трансдукції ЛГ на клітини Лейдіга, а у чоловіків з ожирінням встановлений дефект продукції Т, який корелює з інсулінорезистентністю та є наслідком хронічних змін функціонального стану гіпоталамо-гіпофізарної системи.
Обговорення
Праць, у яких безпосередньо досліджується взаємозв’язок регуляції ЦД і еректильної функції, в літературі вкрай мало. При оцінюванні впливу агресивного лікування та регуляції метаболічних діабетичних порушень на еректильну функцію у чоловіків із ЦД 2-го типу встановлено вірогідне поліпшення рівнів глюкози натще та глікованого гемоглобіну (HbA1c) (з 8,87 до 6,56 %) на тлі прийому пероральних препаратів у 10 із 11 хворих, пероральних препаратів та інсуліну — у 11 із 13 осіб за період 6–7,5 місяця [10].
В одному з досліджень було показано, що статистично вірогідне зниження рівнів глюкози натще і HbA1c у обстежених авторами чоловіків, хворих на ЦД 2-го типу, не призводило до вірогідного покращення еректильної функції [11].
Вважають, що у хворих на ЦД із вищими рівнями глюкози натще (≥ 9,9 ммоль/л) і HbA1c (≥ 8,1 %) є вищий ризик будь-яких хронічних ускладнень ЦД, а ЕД корелює з рівнями глікемічного контролю, наявністю периферичної нейропатії і показником HbA1c, які є незалежними предикторами розвитку ЕД. У той же час бракує відповіді на питання, чи може досягнення цільового глікемічного контролю покращити еректильну функцію. Автори вважають, що хоча регуляція ЕД (глікемічного контролю) є важливою для лікування ЦД, можливо, є й інші чинники розвитку ЕД у чоловіків із ЦД.
В огляді потенційних механізмів розвитку ЕД у пацієнтів із ЦД 2-го типу автори стверджують, що мікроангіопатії кавернозних артерій, корпоральна венооклюзивна дисфункція та автономна нейропатія є первинними патофізіологічними шляхами ЕД [12]. Підвищена глікація кінцевих продуктів належить до причин недостатнього глікемічного конт–ролю, і підвищення колагену в оболонках члена та кавернозних тілах пенільної тканини хворих на ЦД гальмує продукцію оксиду азоту.
Вважають, що зниження ПСШ кровотоку зі збільшенням приросту показників тонусу артеріальної стінки та периферичного опору є наслідком порушень мікроциркуляції, тканинної проникності, що спостерігається у хворих на ЦД 2-го типу [12]. Підвищення тиску у функціонуючих капілярах призводить до значного підвищення транскапілярного фільтраційного тиску, сприяє транссудації, проявом чого спочатку є набряк тканини, а в подальшому — формування порушень трофіки, ступінь яких пропорційний ступеню венозної недостатності. Поширена недостатність венозних клапанів підсилює периферичний застій крові. Гістологічна перебудова стінок колатералей призводить до зриву компенсації, розвитку хронічної венозної недостатності та порушень венооклюзивного механізму.
Виявлені зниження резистентного та пульсаційного індексів у хворих на ЦД і ЕД порівняно з чоловіками контрольної групи як у фазі спокою, так і в динаміці фармакологічної індукції ерекції при дослідженні a. cavernosum і a. dorsalis penis свідчать про формування артеріальної недостатності у хворих цієї категорії.
ЕД у хворих на ЦД 1-го і 2-го типів, в основному, має васкулогенний характер, що підтверджується даними опитування та фармакодопплерографією. Крім того, васкулогенні порушення можуть поєднуватися з низькими рівнями андрогенів у крові та з ураженнями вегетативної і соматичної іннервації статевого члена [12]. Ендотеліальна дисфункція є одним із проявів системних судинних порушень. На початкових етапах захворювання часто спостерігаються відносно легкі та оборотні функціональні зміни, що проявлялися гіперрефлекторними кривими при електроміографії. Вони були виявлені, в основному, у пацієнтів із вираженим ожирінням та інсулінорезистентністю, що є свідченням гіпертонусу симпатичної нервової системи. Підвищена симпатична активність призводить до порушення нервової регуляції кавернозних тіл і спричинює розвиток ЕД. Але при наявності пізніх ускладень розвиваються більш виражені та стійкі порушення вегетативної іннервації статевого члена, про що свідчать гіпо- та арефлекторні криві. Вони розглядаються як прояв діабетичної полінейропатії, тому частота цих порушень корелює з тривалістю ЦД. Структурні ураження нервів статевого члена поряд із судинними порушеннями зумовлюють розвиток тяжчих форм ЕД у хворих на ЦД [14].
В одному з досліджень при оцінюванні поширеності ЕД 95,9 % ендокринологів вказали, що вважають ЕД досить поширеною, 22,4 % вважали ЕД проблемою розвинутих країн і лише 14,3 % визначили ЕД як надто проблематичну. Лише 12,2 % вважають, що статева активність може збільшити тривалість життя, але тільки 22,4 % ендокринологів часто запитують пацієнтів про їхнє статеве життя, 16,3 % цікавляться цим, якщо пацієнт молодший 45 років, 4,1 % — ніколи, а 57,1 % — у виняткових випадках.
Призначаючи лікарські препарати, лише 38,8 % лікарів завжди беруть до уваги їх вплив на статеву систему [15].
Висновки
Еректильна дисфункція — поширене ускладнення ЦД. Патогенез ЕД у хворих на цукровий діабет багатокомпонентний і переважно зумовлений васкулогенними, а у хворих на ЦД 2-го типу — і гормональними чинниками.
Широке використання у пацієнтів із ЦД різних лікарських препаратів без урахування їх впливу на еректильну функцію може індукувати розвиток ЕД або посилювати вже наявну ЕД.
Низька якість збору сексуального анамнезу ендокринологом часто не дозволяє своєчасно виявляти еректильну дисфункцію у хворих на ЦД, утруднюючи ранню діагностику асоційованих із ЕД станів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Гомула А. Влияние половых гормонов и нейротрансмиттеров на сексуальную функцию и поведение человека // Андрология и сексуальная медицина. — 2006. — № 1. — С. 36-46.
2. Gooren L., Lunenfeld B. Screening of the aging male: Textbook of men’s health / B. Lunenfeld, L. Gooren. — London: The Parthenon Publish. Group, 2002. — P. 15-43.
3. Feldman H.A., Goldstein I., Hatzichristou D.G. et al. Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study // J. Urol. — 1994. — Vol. 151. — P. 54-61.
4. Lewis R.W., Fugl-Meyer K.S. et al. Definitions/еpidemiology/risk factor of sexual dysfunction // J. Sex. Med. — 2010. — Vol. 4. — P. 1598-1607.
5. Shabsigh R., Mattern A. REVITALISE: A Large Observational Study Assessing the Safety and Effectiveness of Vardenafil in Men With Erectile Dysfunction and Metabolic Syndrome // J. Sex. Med. — 2016. — Vol. 4. — P. 135-144.
6. Antonio L., Wu F.C., O‘Neil T.W. et al. EMAS Study Group. Associations between sex steroids and the development of metabolic syndrome: a longitudinal study in European men // Diabetes Care. — 2015. — Vol. 100. — P. 1396-1404.
7. Ganz M., Wintfeld N., Li Q. et al. The association of body mass index witn the risk of type 2 diabetes: a case-control study nested in an electronic health records system in the United States // Diabetol. Metabolic Syndr. — 2014. — Vol. 6. — P. 50.
8. Johannes C.B., Araujo A.B., Feldman H.A. et al. Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massachusetts male aging study // J. Urol. — 2000. — Vol. 163(2). — P. 460-463.
9. Yaman O. et al. The Effect of Diabetes Mellitus Treatment and Good Glycemic Control on the Erectile Function in Men with Diabetes Mellitus-Induced Erectile Dysfunction: A Pilot Study // J. Sex. Med. — 2006. — Vol. 3. — P. 344-348.
10. Lowe G., Costabile R.A. 10-year analysis of adverse event reports to the Food and Drug Administration for phosphodiesterase type-5 inhibitors // J. Sex. Med. — 2011. — Vol. 9(1). — Р. 265-270.
11. Yamah O., Akand M., Gursoy A. et al. The effect of diabetes mellitus treatment and good glycemic control on the erectile function in men with diabetes mellitus-induced erectile dysfunction: a pilot study // J. Sex. Med. — 2006. — Vol. 3. — P. 344-48.
12. Kamenov Z.A. A comprehensive review of erectile dysfunction in men with diabetes // Exp. Clin. Endocrinol. Diabetes. — 2015. — Vol. 123. — P. 141-158.
13. Shen Q. et al. Doppler Characteristics of Cavernosal-Spongiosal Communications in Patients with Erectile Dysfunction // Ultrasound Med. Biol. — 2016. — Vol. 42. — P. 159-166.
14. Shabsigh R., Arver S., Channer K.S. et al. The triad of erectile dysfunction, hypogonadism and the metabolic syndrome // Int. J. Clin. Pract. — 2008. — Vol. 62. — P. 791-798.
15. Верткин А.Л. Распространенность эректильной дисфункции и ее связь с сердечно-сосудистой патологией у больных сахарным диабетом / А.Л. Верткин, А.Н. Демидов, Ю.С. Полупанова [и др.] // Consilium medicum. — 2005. — Т. 7(11). — С. 973-979.

/646-1.jpg)
/647-1.jpg)