Международный эндокринологический журнал Том 14, №8, 2018
Вернуться к номеру
Дисекція лімфатичних вузлів за диференційованого раку щитоподібної залози: огляд сучасних тенденцій
Авторы: Смоляр В.А.(1), Товкай О.А.(1), Паламарчук В.О.(1), Хоперія В.Г.(2)
1 - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
2 - ННЦ «Інститут біології та медицини» Київського національного університету імені Тараса Шевченка, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Протягом останніх десятиліть відзначається значне зростання захворюваності на рак щитоподібної залози (РЩЗ), пов’язане як із несприятливим впливом навколишнього середовища, так і зі швидким розвитком методів візуалізації дослідження. Це призвело до пошуку адаптованих та менш агресивних терапевтичних протоколів з метою уникнути ризику ускладнень та неадекватних утручань. Незважаючи на переважно сприятливий прогноз за диференційованого РЩЗ (ДРЩЗ), наявність метастазів до лімфатичних вузлів пов’язана з підвищеним ризиком рецидивів, що значно погіршує якість життя та негативно впливає на прогноз хвороби. До цього часу лікуванням РЩЗ займаються в загальнохірургічних лікувальних закладах, що супроводжується великою кількістю неадекватно виконаних оперативних утручань і високою частотою післяопераційних ускладнень. Крім цього, в нашій країні радіойодотерапія залишається малодоступною процедурою для більшості пацієнтів, також відсутній реєстр даної патології для оцінки ефективності лікування. З огляду на останні рекомендації ендокринних товариств ми проаналізували основні підходи щодо визначення показань та обсягу дисекції лімфатичних вузлів за ДРЩЗ, беручи до уваги їх переваги та ризики. Дані літератури показали, що дискусія все ще відкрита, і хірурги розподілились на прихильників та противників його застосування. Через те існує необхідність у додаткових клінічних і перспективних довгострокових рандомізованих дослідженнях прогностично значущих чинників у виборі тактики дисекції лімфатичних вузлів за ДРЩЗ.
В течение последних десятилетий отмечается значительный рост заболеваемости раком щитовидной железы (РЩЖ), связанный как с неблагоприятным воздействием окружающей среды, так и с быстрым развитием методов визуализации исследования. Это привело к поиску адаптированных и менее агрессивных терапевтических протоколов, избегая риска осложнений и неадекватных вмешательств. Несмотря на преимущественно благоприятный прогноз при дифференцированном РЩЖ (ДРЩЖ), наличие метастазов в лимфатических узлах связано с повышенным риском рецидивов, что значительно ухудшает качество жизни и негативно влияет на прогноз болезни. До сих пор лечением РЩЖ занимаются в общехирургических лечебных учреждениях, что сопровождается большим количеством неадекватно выполненных оперативных вмешательств и высокой частотой послеоперационных осложнений. Кроме того, в нашей стране радиойодтерапия остается малодоступной процедурой для большинства пациентов, также отсутствует реестр данной патологии для оценки эффективности лечения. Исходя из последних рекомендаций эндокринных обществ, мы проанализировали основные подходы к определению показаний и объему диссекции лимфатических узлов при ДРЩЖ, учитывая их преимущества и риски. Данные литературы показали, что дискуссия все еще открыта, и хирурги разделились на сторонников и противников его применения. Именно поэтому существует необходимость в дополнительных клинических и перспективных долгосрочных рандомизированных исследованиях прогностически значимых факторов при выборе тактики диссекции лимфатических узлов ДРЩЖ.
Recently, there has been a significant increase in the incidence of thyroid cancer (TC), both due to the adverse environmental effects and the rapid development of imaging methods. This led to the search for adapted and less aggressive therapeutic protocols, avoiding the risk of complications and inadequate interventions. Despite the predominantly favorable prognosis for differentiated thyroid cancer (DTC), the presence of metastases to the lymph nodes is associated with an increased risk of relapse, which significantly deteriorates the quality of life and adversely affects the prognosis of the disease. Currently, TC treatment is being carried out in general surgical hospitals, which is accompanied by a large number of inadequately executed surgical procedures and a high frequency of postoperative complications. In addition, in our country, radioiodine therapy remains unavailable to most patients, and there is no registry of this pathology to assess the effectiveness of treatment. Taking into account the latest guidelines of endocrine societies, we analyzed the main approaches to determining the indications and volume of lymph node dissection for DTC in terms of their benefits and risks. The literature data showed that the discussion is still open, and surgeons are divided between supporters and opponents of its use. That is why there is a need for additional clinical and perspective long-term randomized studies of prognostically significant factors when choosing approaches to lymph node dissection in DTC.
диференційований рак щитоподібної залози; дисекція лімфатичних вузлів; огляд
дифференцированный рак щитовидной железы; диссекция лимфатических узлов; обзор
differentiated thyroid cancer; lymph node dissection; review
Вступ
Сучасні тенденції у дисекції відповідно до рекомендацій Американської тиреоїдної асоціації (2015)
Ультразвукові особливості метастазування за ДРЩЗ
Застосування ТАПБ із визначенням концентрації тиреоглобуліну в лімфатичних вузлах
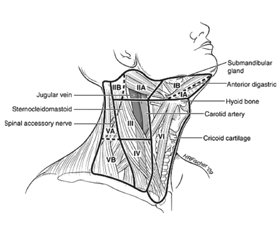
Типи дисекції лімфатичних вузлів
Згідно з результатами комплексного аналізу Національного інституту раку (США), встановлено підвищений ризик смерті серед пацієнтів молодше 45 років із метастазами у лімфатичні вузли порівняно з молодими хворими без метастазів і поступове збільшення додаткового ризику смертності в цій віковій групі зі збільшенням кількості метастатичних лімфатичних вузлів (до шести) [52]. Це дослідження підкреслює роль передопераційного скринінгу метастазів і ставить питання про необхідність застосування сучасних схем діагностики РЩЗ.
Ультразвукова діагностика метастазів у шийні лімфатичні вузли
- Agate L, Lorusso L, Elisei R. New and old knowledge on differentiated thyroid cancer epidemiology and risk factors. J Endocrinol Invest. 2012;35(6 Suppl):3-9.
- Davies L, Welch HG. Increasing incidence of thyroid cancer in the United States, 1973–2002. JAMA. 2006 May 10;295(18):2164-7. doi: 10.1001/jama.295.18.2164.
- Wang Y, Wang W. Increasing Incidence of Thyroid Cancer in Shanghai, China, 1983–2007. Asia Pac J Public Health. 2015 Mar;27(2):NP223-9. doi: 10.1177/1010539512436874.
- Bellevicine C, Vigliar E, Malapelle U, et al. Cytopathologists can reliably perform ultrasound-guided thyroid fine needle aspiration: a 1-year audit on 3715 consecutive cases. Cytopathology. 2016 Apr;27(2):115-21. doi: 10.1111/cyt.12243.
- Pellegriti G, Frasca F, Regalbuto C, Squatrito S, Vigneri R. Worldwide increasing incidence of thyroid cancer: update on epidemiology and risk factors. J Cancer Epidemiol. 2013;2013:965212. doi: 10.1155/2013/965212.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016 Jan;26(1):1-133. doi: 10.1089/thy.2015.0020.
- Hay ID, Bergstralh EJ, Goellner JR, Ebersold JR, Grant CS. Predicting outcome in papillary thyroid carcinoma: development of a reliable prognostic scoring system in a cohort of 1779 patients surgically treated at one institution during 1940 through 1989. Surgery. 1993 Dec;114(6):1050-7; discussion 1057-8.
- Shah MD, Hall FT, Eski SJ, Witterick IJ, Walfish PG, Freeman JL. Clinical course of thyroid carcinoma after neck dissection. Laryngoscope. 2003 Dec;113(12):2102-7. doi: 10.1097/00005537-200312000-00008.
- Wang TS, Dubner S, Sznyter LA, Heller KS. Incidence of metastatic well-differentiated thyroid cancer in cervical lymph nodes. Arch Otolaryngol Head Neck Surg. 2004 Jan;130(1):110-3. doi: 10.1001/archotol.130.1.110.
- Mazzaferri EL. An overview of the management of papillary and follicular thyroid carcinoma. Thyroid. 1999 May;9(5):421-7. doi: 10.1089/thy.1999.9.421.
- Bhargav PRK, Mishra A, Agarwal G, et al. Long term outcome of differentiated thyroid carcinoma: experience in a developing country. World J Surg. 2010 Jan;34(1):40-7. doi: 10.1007/s00268-009-0293-y.
- Cooper DS, Specker B, Ho M, et al. Thyrotropin suppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid. 1998 Sep;8(9):737-44. doi: 10.1089/thy.1998.8.737.
- Lin JD, Chao TC, Huang MJ, Weng HF, Tzen KY. Use of radioactive iodine for thyroid remnant ablation in well-differentiated thyroid carcinoma to replace thyroid reoperation. Am J Clin Oncol. 1998 Feb;21(1):77-81.
- Brierley JD, Panzarella T, Tsang RW, Gospodarowicz MK, O’Sullivan B. A comparison of different staging systems predictability of patient outcome. Thyroid carcinoma as an example. Cancer. 1997 Jun 15;79(12):2414-23.
- Hay ID, Thompson GB, Grant CS, et al. Papillary thyroid carcinoma managed at the Mayo Clinic during six decades (1940–1999): temporal trends in initial therapy and long-term outcome in 2444 consecutively treated patients. World J Surg. 2002 Aug;26(8):879-85. doi: 10.1007/s00268-002-6612-1.
- Sosa JA, Bowman HM, Tielsch JM, Powe NR, Gordon TA, Udelsman R. The importance of surgeon experience for clinical and economic outcomes from thyroidectomy. Ann Surg. 1998 Sep;228(3):320-30.
- Loyo M, Tufano RP, Gourin CG. National trends in thyroid surgery and the effect of volume on short-term outcomes. Laryngoscope. 2013 Aug;123(8):2056-63. doi: 10.1002/lary.23923.
- Gourin CG, Tufano RP, Forastiere AA, Koch WM, Pawlik TM, Bristow RE. Volume-based trends in thyroid surgery. Arch Otolaryngol Head Neck Surg. 2010 Dec;136(12):1191-8. doi: 10.1001/archoto.2010.212.
- Stavrakis AI, Ituarte PH, Ko CY, Yeh MW. Surgeon volume as a predictor of outcomes in inpatient and outpatient endocrine surgery. Surgery. 2007 Dec;142(6):887-99; discussion 887-99. doi: 10.1016/j.surg.2007.09.003.
- Nam-Goong IS, Kim HY, Gong G, et al. Ultrasonography-guided fineneedle aspiration of thyroid incidentaloma: correlation with pathological findings. Clin Endocrinol (Oxf). 2004 Jan;60(1):21-8.
- Chow SM, Law SC, Chan JK, Au SK, Yau S, Lau WH. Papillary microcarcinoma of the thyroid—prognostic significance of lymph node metastasis and multifocality. Cancer. 2003 Jul 1;98(1):31-40. doi: 10.1002/cncr.11442.
- Grebe SK, Hay ID. Thyroid cancer nodal metastases: biologic significance and therapeutic considerations. Surg Oncol Clin N Am. 1996 Jan;5(1):43-63.
- Scheumann GF, Gimm O, Wegener G, Hundeshagen H, Dralle H. Prognostic significance and surgical management of locoregional lymph node metastases in papillary thyroid cancer. World J Surg. 1994 Jul-Aug;18(4):559-67; discussion 567-8.
- Ito Y, Uruno T, Nakano K, et al. An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid. Thyroid. 2003 Apr;13(4):381-7. doi: 10.1089/105072503321669875.
- Hay ID, Grant CS, van Heerden JA, Goellner JR, Ebersold JR, Bergstralh EJ. Papillary thyroid microcarcinoma: a study of 535 cases observed in a 50-year period. Surgery. 1992 Dec;112(6):1139-46; discussion 1146-7.
- Qubain SW, Nakano S, Baba M, Takao S, Aikou T. Distribution of lymph node micrometastasis in pN0 well-differentiated thyroid carcinoma. Surgery. 2002 Mar;131(3):249-56.
- Arturi F, Russo D, Giuffrida D, et al. Early diagnosis by genetic analysis of differentiated thyroid cancer metastases in small lymph nodes. J Clin Endocrinol Metab. 1997 May;82(5):1638-41. doi: 10.1210/jcem.82.5.4062.
- Solorzano CC, Carneiro DM, Ramirez M, Lee TM, Irvin GL. Surgeon-performed ultrasound in the management of thyroid malignancy. Am Surg. 2004 Jul;70(7):576-80; discussion 580-2.
- Shimamoto K, Satake H, Sawaki A, Ishigaki T, Funahashi H, Imai T. Preoperative staging of thyroid papillary carcinoma with ultrasonography. Eur J Radiol. 1998 Nov;29(1):4-10.
- Stulak JM, Grant CS, Farley DR, et al. Value of preoperative ultrasonography in the surgical management of initial and reoperative papillary thyroid cancer. Arch Surg. 2006 May;141(5):489-94; discussion 494-6. doi: 10.1001/archsurg.141.5.489.
- Kouvaraki MA, Shapiro SE, Fornage BD, et al. Role of preoperative ultrasonography in the surgical management of patients with thyroid cancer. Surgery. 2003 Dec;134(6):946-54; discussion 954-5. doi: 10.1016/S0039.
- O’Connell K, Yen TW, Quiroz F, Evans DB, Wang TS. The utility of routine preoperative cervical ultrasonography in patients undergoing thyroidectomy for differentiated thyroid cancer. Surgery. 2013 Oct;154(4):697-701; discussion 701-3. doi: 10.1016/j.surg.2013.06.040.
- Leboulleux S, Girard E, Rose M, et al. Ultrasound criteria of malignancy for cervical lymph nodes in patients followed up for differentiated thyroid cancer. J Clin Endocrinol Metab. 2007 Sep;92(9):3590-4. doi: 10.1210/jc.2007-0444.
- Frasoldati A, Valcavi R. Challenges in neck ultrasonography: lymphadenopathy and parathyroid glands. Endocr Pract. 2004 May-Jun;10(3):261-8. doi: 10.4158/EP.10.3.261.
- Kuna SK, Bracic I, Tesic V, Kuna K, Herceg GH, Dodig D. Ultrasonographic differentiation of benign from malignant neck lymphadenopathy in thyroid cancer. J Ultrasound Med. 2006 Dec;25(12):1531-7; quiz 1538-40.
- Park JH, Lee YS, Kim BW, Chang HS, Park CS. Skip lateral neck node metastases in papillary thyroid carcinoma. World J Surg. 2012 Apr;36(4):743-7. doi: 10.1007/s00268-012-1476-5.
- Snozek CL, Chambers EP, Reading CC, et al. Serum thyroglobulin, high-resolution ultrasound, and lymph node thyroglobulin in diagnosis of differentiated thyroid carcinoma nodal metastases. J Clin Endocrinol Metab. 2007 Nov;92(11):4278-81. doi: 10.1210/jc.2007-1075.
- Frasoldati A, Pesenti M, Gallo M, Caroggio A, Salvo D, Valcavi R. Diagnosis of neck recurrences in patients with differentiated thyroid carcinoma. Cancer. 2003 Jan 1;97(1):90-6. doi: 10.1002/cncr.11031.
- Boi F, Baghino G, Atzeni F, Lai ML, Faa G, Mariotti S. The diagnostic value for differentiated thyroid carcinoma metastases of thyroglobulin (Tg) measurement in washout fluid from fine-needle aspiration biopsy of neck lymph nodes is maintained in the presence of circulating anti-Tg antibodies. J Clin Endocrinol Metab. 2006 Apr;91(4):1364-9. doi: 10.1210/jc.2005-1705.
- Jeon MJ, Park JW, Han JM, et al. Serum antithyroglobulin antibodies interfere with thyroglobulin detection in fine-needle aspirates of metastatic neck nodes in papillary thyroid carcinoma. J Clin Endocrinol Metab. 2013 Jan;98(1):153-60. doi: 10.1210/jc.2012-2369.
- Chung J, Kim EK, Lim H, et al. Optimal indication of thyroglobulin measurement in fine-needle aspiration for detecting lateral metastatic lymph nodes in patients with papillary thyroid carcinoma. Head Neck. 2014 Jun;36(6):795-801. doi: 10.1002/hed.23371.
- Grani G, Fumarola A. Thyroglobulin in lymph node fine-needle aspiration wash-out: a systematic review and meta-analysis of diagnostic accuracy. J Clin Endocrinol Metab. 2014 Jun;99(6):1970-82. doi: 10.1210/jc.2014-1098.
- Pak K, Suh S, Hong H, et al. Diagnostic values of thyroglobulin measurement in fine-needle aspiration of lymph nodes in patients with thyroid cancer. Endocrine. 2015 May;49(1):70-7. doi: 10.1007/s12020-014-0410-z.
- Pacini F, Fugazzola L, Lippi F, et al. Detection of thyroglobulin in fine needle aspirates of nonthyroidal neck masses: a clue to the diagnosis of metastatic differentiated thyroid cancer. J Clin Endocrinol Metab. 1992 Jun;74(6):1401-4. doi: 10.1210/jcem.74.6.1592886.
- Moon JH, Kim YI, Lim JA, et al. Thyroglobulin in washout fluid from lymph node fine-needle aspiration biopsy in papillary thyroid cancer: large-scale validation of the cutoff value to determine malignancy and evaluation of discrepant results. J Clin Endocrinol Metab. 2013 Mar;98(3):1061-8. doi: 10.1210/jc.2012-3291.
- Giovanella L, Bongiovanni M, Trimboli P. Diagnostic value of thyroglobulin assay in cervical lymph node fine-needle aspirations for metastatic differentiated thyroid cancer. Curr Opin Oncol. 2013 Jan;25(1):6-13. doi: 10.1097/CCO.0b013e32835a9ab1.
- Hughes DT, White ML, Miller BS, Gauger PG, Burney RE, Doherty GM. Influence of prophylactic central lymph node dissection on postoperative thyroglobulin levels and radioiodine treatment in papillary thyroid cancer. Surgery. 2010 Dec;148(6):1100-6; discussion 1006-7. doi: 10.1016/j.surg.2010.09.019.
- Randolph GW, Duh QY, Heller KS, et al. The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes, as well as the presence of extranodal extension. Thyroid. 2012 Nov;22(11):1144-52. doi: 10.1089/thy.2012.0043.
- Podnos YD, Smith D, Wagman LD, Ellenhorn JD. The implication of lymph node metastasis on survival in patients with well-differentiated thyroid cancer. Am Surg. 2005 Sep;71(9):731-4.
- Leboulleux S, Rubino C, Baudin E, et al. Prognostic factors for persistent or recurrent disease of papillary thyroid carcinoma with neck lymph node metastases and/or tumor extension beyond the thyroid capsule at initial diagnosis. J Clin Endocrinol Metab. 2005 Oct;90(10):5723-9. doi: 10.1210/jc.2005-0285.
- Sugitani I, Kasai N, Fujimoto Y, Yanagisawa A. A novel classification system for patients with PTC: addition of the new variables of large (3cm or greater) nodal metastases and reclassification during the follow-up period. Surgery. 2004 Feb;135(2):139-48. doi: 10.1016/S0039.
- Adam MA, Pura J, Goffredo P, et al. Presence and number of lymph node metastases are associated with compromised survival for patients younger than age 45 years with papillary thyroid cancer. J Clin Oncol. 2015 Jul 20;33(21):2370-5. doi: 10.1200/JCO.2014.59.8391.
- Robbins KT, Shaha AR, Medina JE, et al. Consensus statement on the classification and terminology of neck dissection. Arch Otolaryngol Head Neck Surg. 2008 May;134(5):536-8. doi: 10.1001/archotol.134.5.536.
- Hwang HS, Orloff LA. Efficacy of preoperative neck ultrasound in the detection of cervical lymph node metastasis from thyroid cancer. Laryngoscope. 2011 Mar;121(3):487-91. doi: 10.1002/lary.21227.
- Mulla M, Schulte KM. Central cervical lymph node metastases in papillary thyroid cancer: a systematic review of imaging-guided and prophylactic removal of the central compartment. Clin Endocrinol (Oxf). 2012 Jan;76(1):131-6. doi: 10.1111/j.1365-2265.2011.04162.x.
- Hartl DM, Leboulleux S, Al Ghuzlan A, et al. Optimization of staging of the neck with prophylactic central and lateral neck dissection for papillary thyroid carcinoma. Ann Surg. 2012 Apr;255(4):777-83. doi: 10.1097/SLA.0b013e31824b7b68.
- Popadich A, Levin O, Lee JC, et al. A multicenter cohort study of total thyroidectomy and routine central lymph node dissection for cN0 papillary thyroid cancer. Surgery. 2011 Dec;150(6):1048-57. doi: 10.1016/j.surg.2011.09.003.
- Lang BH, Wong KP, Wan KY, Lo CY. Impact of routine unilateral central neck dissection on preablative and postablative stimulated thyroglobulin levels after total thyroidectomy in papillary thyroid carcinoma. Ann Surg Oncol. 2012 Jan;19(1):60-7. doi: 10.1245/s10434-011-1833-x.
- Sancho JJ, Lennard TW, Paunovic I, Triponez F, SitgesSerra A. Prophylactic central neck disection in papillary thyroid cancer: a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbecks Arch Surg. 2014 Feb;399(2):155-63. doi: 10.1007/s00423-013-1152-8.
- Barczynski M, Konturek A, Stopa M, Nowak W. Prophylactic central neck dissection for papillary thyroid cancer. Br J Surg. 2013 Feb;100(3):410-8. doi: 10.1002/bjs.8985.
- Ito Y, Yoshida H, Kihara M, Kobayashi K, Miya A, Miyauchi A. BRAF(V600E) mutation analysis in papillary thyroid carcinoma: is it useful for all patients? World J Surg. 2014 Mar;38(3):679-87. doi: 10.1007/s00268-013-2223-2.
- Moreno MA, Edeiken-Monroe BS, Siegel ER, Sherman SI, Clayman GL. In papillary thyroid cancer, preoperative central neck ultrasound detects only macroscopic surgical disease, but negative findings predict excellent long-term regional control and survival. Thyroid. 2012 Apr;22(4):347-55. doi: 10.1089/thy.2011.0121.
- Robenshtok E, Fish S, Bach A, Dominguez JM, Shaha A, Tuttle RM. Suspicious cervical lymph nodes detected after thyroidectomy for papillary thyroid cancer usually remain stable over years in properly selected patients. J Clin Endocrinol Metab. 2012 Aug;97(8):2706-13. doi: 10.1210/jc.2012-1553.

/750-1.jpg)
/751-1.jpg)