Международный эндокринологический журнал Том 14, №8, 2018
Вернуться к номеру
Гострий тромбоз стента при інфаркті міокарда, ускладненому кардіогенним шоком, за наявності цукрового діабету 2-го типу
Авторы: Кияк Ю.Г., Лабінська О.Є., Галькевич М.П., Барнетт О.Ю., Кияк Г.Ю., Ковалишин В.І.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
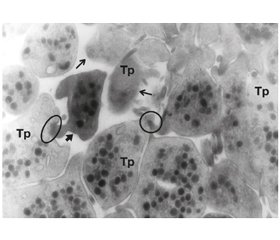
Актуальність. Гострий тромбоз стента (ТС) є нечастим, але грізним ускладненням при стентуванні вінцевих артерій. Він виникає під час черезшкірних коронарних втручань або впродовж 24 годин після цієї процедури. Мета дослідження: з’ясувати причини та проаналізувати фактори, що призвели до гострого ТС при гострому коронарному синдромі і цукровому діабеті (ЦД) 2-го типу, для уникнення подібних ускладнень. Матеріали та методи. Обстежено 119 пацієнтів із гострим інфарктом міокарда з елевацією сегмента ST, які лікувалися в інфарктному відділенні комунального некомерційного підприємства «Клінічна лікарня швидкої медичної допомоги м. Львова». Усім пацієнтам проводили коронарографію та стентування вінцевих артерій, ультраструктурні дослідження тромбоцитів венозної крові за допомогою електронної мікроскопії. Результати. Пацієнти із ЦД 2-го типу мають вищий кардіоваскулярний ризик розвитку серцево-судинних ускладнень, що пов’язано з ендотеліальною дисфункцією, схильністю до гіперкоагуляції і, як наслідок, тенденцією до вазоконстрикції, запальних реакцій та порушень гемостазу. У цієї категорії пацієнтів спостерігається підвищена адгезивність тромбоцитів і збільшена концентрація тканинного активатора плазміногену. В експрес-некроптатах і періопераційних біоптатах міокарда пацієнтів із ЦД нами виявлено домінування процесів гіперкоагуляції в мікросудинах міокарда в результаті активності системи згортання крові за відсутності безпосередньої участі тромбоцитів, оскільки частина з них була кальцифікована (осміофільні) і мала знижену функціональну здатність, в результаті чого відмічається резистентність до аспірину. В осіб із ЦД 2-го типу виникає зазвичай тяжкий і більш генералізований коронаросклероз, що призводить до погіршення перебігу гострого коронарного синдрому і частішого виникнення ТС, що робить доцільним додаткове призначення ривароксабану цій категорії пацієнтів. Висновки. Враховуючи виявлені нами ознаки зниженої реактивності тромбоцитів і домінування активації системи згортання крові у хворих на ЦД і з підвищеним ризиком коронаротромбозу, вважаємо, що застосування нових пероральних антикоагулянтів є актуальним і заслуговує подальших досліджень.
Актуальность. Острый тромбоз стента (ТС) является нечастым, но угрожающим осложнением при стентировании венечных артерий. Он возникает во время чрескожных коронарных вмешательств или на протяжении 24 часов после этой процедуры. Цель исследования: установить причины и проанализировать факторы, которые привели к острому ТС у пациентки с острым коронарным синдромом и сахарным диабетом (СД) 2-го типа, во избежание подобных осложнений. Материалы и методы. Обследованы 119 пациентов с острым инфарктом миокарда с элевацией сегмента ST, которые находились на лечении в инфарктном отделении коммунального некоммерческого предприятия «Клиническая больница скорой помощи г. Львова». Всем пациентам проводили коронарографию и стентирование венечных артерий, а также ультраструктурные исследования тромбоцитов венозной крови с помощью электронной микроскопии. Результаты. Пациенты с СД 2-го типа имеют более высокий кардиоваскулярный риск развития сердечно-сосудистых осложнений, что связано с эндотелиальной дисфункцией, склонностью к гиперкоагуляции и, как следствие, тенденцией к вазоконстрикции, воспалительным реакциям и нарушениям гемостаза. У этой категории пациентов наблюдается повышенная адгезивность тромбоцитов и увеличена концентрация тканевого активатора плазминогена. В экспресс-некроптатах и периоперационных биоптатах миокарда пациентов с СД выявлено доминирование процессов гиперкоагуляции в микрососудах миокарда в результате активности системы оседания крови при отсутствии непосредственного участия тромбоцитов, так как часть из них была кальцифицирована и имела сниженную функциональную способность, в результате чего отмечается резистентность к аспирину. У лиц с СД 2-го типа возникает, как правило, тяжелый и более генерализованный коронаросклероз, что приводит к более тяжелому протеканию острого коронарного синдрома и более частому возникновению ТС, что делает уместным дополнительное назначение ривароксабана этой категории пациентов. Выводы. Учитывая обнаруженные нами признаки пониженной реактивности тромбоцитов и доминирование активации системы оседания крови у больных СД и с повышенным риском коронаротромбоза, считаем, что использование новых пероральных антикоагулянтов является актуальным и заслуживает дальнейших исследований.
Background. Acute stent thrombosis is a rare, but life-threatening complication of coronary stenting. It occurs during percutaneous coronary intervention or within 24 hours after this procedure. The purpose of the study was to find out the causes and analyze the factors that led to acute stent thrombosis in patients with acute coronary syndrome and type 2 diabetes mellitus (DM) in order to avoid such complications. Materials and methods. There were 119 patients with acute ST-segment elevation myocardial infarction. They were treated in the cardiology unit of the Municipal Non-Profit Enterprise “Lviv Clinical Emergency Hospital”. All patients were treated using coronary angiography and coronary stenting. An ultrastructural study of venous blood platelets was performed using electron microscopy. Results. Patients with type 2 DM have a higher cardiovascular risk of cardiovascular complications associated with endothelial dysfunction and risk of hypercoagulation and, as a consequence, a tendency towards vasoconstriction, inflammatory reactions, and hemostatiс disorders. In these patients, there is an increased platelet adhesion and an increased concentration of tissue plasminogen activator. During express necropsy and perioperative biopsy of myocardium in patients with DM, we identified the dominance of hypercoagulation in myocardial microvessels as a result of the activity of the blood coagulation system in the absence of direct involvement of the platelets, since some of them were calcified and had reduced functional capacity, and therefore, resistance to aspirin was detected. Persons with type 2 DM usually have severe and more generalized coronary sclerosis, which leads to a more severe course of acute coronary syndrome and a more frequent occurrence of stent thrombosis, which makes expedient the additional prescription of rivaroxaban. Conclusions. Given the signs of decreased platelet reactivity, the dominance of activated coagulation system in patients with DM and an increased risk of coronary artery disease, the use of new oral anticoagulants is relevant and deserves further research.
цукровий діабет 2-го типу; гострий тромбоз стента; інфаркт міокарда; черезшкірне коронарне втручання; агрегація тромбоцитів
сахарный диабет 2-го типа; острый тромбоз стента; инфаркт миокарда; чрескожное коронарное вмешательство; агрегация тромбоцитов
type 2 diabetes mellitus; acute stent thrombosis; myocardial infarction; percutaneous coronary intervention; platelet aggregation
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Tyczynski P, Karcz M, Kalinczuk L, Fronczak A, Witkowski A. Early stent thrombosis. Aetiology, treatment and prognosis. Postepy Kardiol Interwencyjnej. 2014;10(4):221-5. doi: 10.5114/pwki.2014.46761.
- Ganiukov VI, Shilov AA, Bokhan NS, Moiseenkov GV, Barbarash L.S. The Causes of Thrombosis in the Coronary Artery Stent. Int J Intervent Cardioangiol. 2012;28:26-30.
- Kuchulakanti PK, Chu WW, Torguson R, et al. Correlates and Long-Term Outcomes of Angiographically Proven Stent Trombosis With Sirolimus- and Paclitaxel-Eluting Stents. Circulation. 2006 Feb 28;113(8):1108-13. doi: 10.1161/CIRCULATIONAHA.105.600155.
- Holmes DR, Kereiakes DJ, Garg S, et. al. Stent Thrombosis. J Am Coll Cardiol. 2010 Oct 19;56(17):1357-65. doi: 10.1016/j.jacc.2010.07.016.
- Alfonso F, Suarez A, Angiolillo DJ, et al. Findings of intravascular ultrasound during acute stent thrombosis. Heart. 2004 Dec;90(12):1455-9. doi: 10.1136/hrt.2003.026047.
- Byrne RA, Joner M, Kastrati A.Stent thrombosis and restenosis: what have we learned and where are we going? Eur Heart J. 2015 Dec 14;36(47):3320-31. doi: 10.1093/eurheartj/ehv511.
- Claessen BE, Henriques JP, Jaffer FA, Mehran R, Piek JJ, Dangas GD. Stent Thrombosis: A Clinical Perspective. JACC Cardiovasc Interv. 2014 Oct;7(10):1081-92. doi: 10.1016/j.jcin.2014.05.016.
- Daemen J, Wenaweser P, Tsuchida K, et al. Early and late coronary stent thrombosis of sirolimuseluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 2007 Feb 24;369(9562):667-78. doi: 10.1016/S0140-6736(07)60314-6.
- Kyyak YH, Barnett OY, Kovalyshyn VI, Kyyak HY. Koreljacii’ mizh klinichnoju i klitynnoju kardiologijeju (kliniko-ul’trastrukturni doslidzhennja): monografija [Correlations between clinical and cellular cardiology (clinical and ultrastructural examinations]. Lviv: Kvart; 2012. 160 p. (in Ukrainian).
- Hoffbrand V, Pettit J. Color Atlas of Clinical Hematology. Mosby; 2010. 527 p.
- Sevostyanova S. The choice of antiaggregants for patients with ACS after fibrinolysis: the results of the TREAT study. Medicine review. 2018;2(49):47-50. (in Russian).
- Armstrong EJ, Waltenberger J, Rogers JH. Percutaneous Coronary Intervention in Patients With Diabetes: Current Concepts and Future Directions. J Diabetes Sci Technol. 2014 May;8(3):581-9. doi: 10.1177/1932296813517058.
- Kukula K, Klopotowski M, Kunicki PK, et al. Platelet aggregation and risk of stent thrombosis or bleeding in interventionally treated diabetic patients with acute coronary syndrome. BMC Cardiovasc Disord. 2016 Dec 8;16(1):252. doi: 10.1186/s12872-016-0433-x.
- Carrié D. The use of the Cre8 Stent in Patients With Diabetes Mellitus. Interv Cardiol. 2016 May;11(1):47-50. doi: 10.15420/icr.2016.11.1.47.
- Ibanez B, James S, Agewall S, et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2018 Jan 7;39(2):119-177. doi: 10.1093/eurheartj/ehx393.
- Mega JL, Braunwald E, Wiviott SD, et. al. Rivaroxaban in Patients with a Recent Acute Coronary Syndrome. N Engl J Med. 2012 Jan 5;366(1):9-19. doi: 10.1056/NEJMoa1112277.

/778-1.jpg)
/779-1.jpg)
/780-1.jpg)
/780-2.jpg)