Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Особливості ремоделювання міокарда лівого шлуночка при гіпотиреозі й ішемічній хворобі серця на тлі хронічного системного запалення
Авторы: Городинська О.Ю., Бобирьова Л.Є., Весніна Л.Е., Ізмайлова О.В., Баранова А.Ф.
Українська медична стоматологічна академія, м. Полтава, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Дисфункція щитоподібної залози у сучасній медичній науці розглядається як один із факторів ризику серцево-судинних захворювань, на жаль, непередбачливо недооцінюваний. Вiдомо, що навіть незначнi порушення тиреоїдної функцiї можуть супроводжуватися зростанням кардiометаболiчного ризику. Гіпотиреоз вже на ранній (субклінічній) стадії серйозно впливає на формування і розвиток серцево-судинних захворювань. Результати масштабних досліджень демонструють, що субклінічний гіпотиреоз асоціюється з підвищенням ризику розвитку ішемічної хвороби серця (ІХС), інфаркту міокарда і смертності від серцево-судинних захворювань. Мета дослідження — вивчення структурно-функціонального стану міокарда лівого шлуночка при гіпотиреозі та ішемічній хворобі серця на тлі хронічного системного запалення. Матеріали та методи. Проаналізовано 140 історій хвороб та обстежено 55 хворих на гіпотиреоз, ІХС та за умов поєднаної патології. Пацієнти були розподілені на 3 групи: І група — хворі на гіпотиреоз — 81, ІІ група — хворі на ІХС — 67, ІІІ група — хворі на гіпотиреоз в поєднанні з ІХС — 67. Групу контролю становили 20 осіб віком від 20 до 25 років. Результати. Виявлено, що гіпертрофія міокарда розвивається у всіх групах хворих, зниження функції щитоподібної залози характеризується ремоделюванням міокарда лівого шлуночка з розвитком ексцентричної гіпертрофії, з прогресуванням систолічної дисфункції серця в умовах коморбідності. Виявлений прямий кореляційний зв’язок зниження фракції викиду з підвищенням рівня IЛ-8. Висновки. Активація хронічного системного запалення більш виражена в умовах коморбідності з негативним прогностичним впливом на стан серцево-судинної системи. Зниження функції щитоподібної залози призводить до розвитку гіпертрофії міокарда лівого шлуночка з подальшою зміною геометрії серця в бік розвитку ексцентричного ремоделювання. Гіпотиреоз характеризується порушенням центральної гемодинаміки, прояви систолічної дисфункції серця наростають за умов поєднання тиреоїдної патології та ІХС. Активація хронічного системного запалення більш виражена в умовах коморбідності з негативним прогностичним впливом на стан серцево-судинної системи.
Актуальность. Дисфункция щитовидной железы в современной медицинской науке рассматривается как один из факторов риска сердечно-сосудистых заболеваний, к сожалению, непредусмотрительно недооцениваемый. Известно, что даже незначительные нарушения тиреоидной функции могут сопровождаться ростом кардиометаболического риска. Гипотиреоз уже на ранней (субклинической) стадии оказывает серьезное влияние на формирование и развитие сердечно-сосудистых заболеваний. Результаты масштабных исследований демонстрируют, что субклинический гипотиреоз ассоциируется с повышением риска развития ишемической болезни сердца, инфаркта миокарда и смертности от сердечно-сосудистых заболеваний. Цель исследования — изучение структурно-функционального состояния миокарда левого желудочка при гипотиреозе и ИБС на фоне хронического системного воспаления. Материалы и методы. Проанализированы 140 историй болезни и обследованы 55 больных гипотиреозом, ИБС и в условиях сочетанной патологии. Пациенты были распределены на 3 группы: первая группа — больные гипотиреозом — 81, вторая — больные ИБС — 67, третья — больные гипотиреозом в сочетании с ИБС — 67. Группу контроля составили 20 лиц в возрасте от 20 до 25 лет. Результаты. Обнаружено, что гипертрофия миокарда развивается во всех группах больных, снижение функции щитовидной железы характеризуется ремоделированием миокарда левого желудочка с развитием эксцентрической гипертрофии, с прогрессированием систолической дисфункции сердца в условиях коморбидности. Обнаружена прямая корреляционная связь между снижением фракции выброса и повышением уровня ИЛ-8. Выводы. Активация хронического системного воспаления более выражена в условиях коморбидности с негативным прогностическим влиянием на состояние сердечно-сосудистой системы. Снижение функции щитовидной железы приводит к развитию гипертрофии миокарда левого желудочка с последующим изменением геометрии сердца в сторону развития эксцентрического ремоделирования. Гипотиреоз характеризуется нарушением центральной гемодинамики, проявления систолической дисфункции сердца нарастают при условиях сочетания тиреоидной патологии и ишемической болезни сердца. Активация хронического системного воспаления более выражена в условиях коморбидности с отрицательным прогностическим влиянием на состояние сердечно-сосудистой системы.
Background. Thyroid dysfunction in modern medical science is regarded as one of the risk factors for cardiovascular diseases, unfortunately, unwittingly underestimated. It is known that even insignificant violations of thyroid function can be accompanied by the increased cardiometabolic risk. Hypothyroidism already on the early (subclinical) stage has a significant influence on formation and development of cardiovascular diseases. The results of large researches demonstrate that subclinical hypothyroidism is associated with increased risk for the development of ischemic heart disease, myocardial infarction and death rate from cardiovascular diseases. The purpose of this research is to study the structural and functional status of the left ventricular myocardium in hypothyroidism, ischemic heart disease and in comorbidity. Materials and methods. One hundred and forty clinical records were analyzed and 55 patients with hypothyroidism, ischemic heart disease and combined pathology were examined. They were divided into 3 groups: the first group — 81 patients with hypothyroidism, the second group — 67 individuals with ischemic heart disease, and the third group — 67 people with combination of hypothyroidism and ischemic heart disease. Control group included 20 persons aged 20 to 25 years. Results. It was found that myocardial hypertrophy developed in all groups of patients; the decrease of thyroid function is characterized by myocardial remodeling with the development of eccentric hypertrophy, with the progression of systolic dysfunction in case of comorbidity. A direct correlation was found between reduced ejection fraction and higher levels of interleukin-8. Conclusions. Activation of chronic systemic inflammation is more significant in comorbidity, with negative prognostic influence on the state of the cardiovascular system. The decline of thyroid function results in the development of left myocardial hypertrophy with subsequent changes in cardiac geometry towards eccentric remodeling. Hypothyroidism is characterized by impaired central hemodynamics; manifestations of systolic dysfunction are increased in combination of thyroid pathology and ischemic heart disease. Activation of chronic systemic inflammation is more significant in comorbidity, with negative prognostic influence on the state of the cardiovascular system.
щитоподібна залоза; серце; гіпотиреоз; гіпертрофія міокарда; лівий шлуночок; прозапальні цитокіни
щитовидная железа; сердце; гипотиреоз; гипертрофия миокарда; левый желудочек; провоспалительные цитокины
thyroid gland; heart, hypothyroidism; myocardial hypertrophy; left ventricle; proinflammatory cytokines
Вступ
Дисфункція щитоподібної залози (ЩЗ) у сучасній медичній науці розглядається як один із факторів ризику серцево-судинних захворювань, на жаль, непередбачливо недооцінюваний [1–3].
На сьогодні проведено досить багато досліджень, присвячених механізмам впливу зниженої функції ЩЗ на серцево-судинну систему. Вiдомо, що навіть незначнi порушення тиреоїдної функцiї можуть супроводжуватися зростанням кардiометаболiчного ризику [4, 5]. Показано, що гіпотиреоз вже на ранній (субклінічній) стадії серйозно впливає на формування і розвиток серцево-судинних захворювань (ССЗ) [6, 7]. Результати масштабних досліджень демонструють, що субклінічний гіпотиреоз асоціюється з підвищенням ризику розвитку ішемічної хвороби серця (ІХС), інфаркту міокарда, хронічної серцевої недостатності і смертності від ССЗ незалежно від статі, віку і попередніх серцево-судинних захворювань [8]. Існують наукові дані про взаємозв’язок гіпотиреозу з такими «новими» факторами ризику атеросклерозу, як С-реактивний білок, ендотеліальна дисфункція, хронічне системне запалення, прокоагулянтні зміни крові тощо [9, 10].
Однак поширеність указаних факторів ризику у хворих на гіпотиреоз, ІХС та за умов поєднаної патології, їх зв’язок зі станом серцево-судинної системи на тлі дефіциту тиреоїдних гормонів потребують більш детального вивчення.
Мета дослідження — вивчення структурно-функціонального стану міокарда лівого шлуночка при гіпотиреозі та ІХС на тлі хронічного системного запалення.
Матеріали та методи
Для формування основної групи був проведений скринінговий аналіз історій хвороб пацієнтів, що лікувались в ендокринологічному та кардіологічному відділеннях Полтавської обласної клінічної лікарні ім. М.В. Скліфосовського у 2006–2015 роках. Для подальшого дослідження відібрано 140 історій хвороб пацієнтів із гіпотиреозом, кардіальною та кардіотиреоїдною патологією. Наступний етап рандомізації проводився безпосередньо з пацієнтами, які лікувались у даних відділеннях. На підставі аналізу скарг, анамнезу, фізикального дослідження пацієнта, даних лабораторно-інструментальним методів, аналізу відповідності критеріям включення/вилучення було відібрано 55 осіб.
Пацієнтів було розподілено на 3 групи: І група — хворі на гіпотиреоз — 81 (жінки — 72, чоловіки — 9, віком 46,0 ± 6,1 року), ІІ група — хворі на ІХС — 67 (жінки — 27, чоловіки — 40, віком 59,0 ± 8,8 року), ІІІ група — хворі на гіпотиреоз у поєднанні з ІХС — 67 (жінки — 39, чоловіки — 28, віком 55,0 ± 7,5 року). Групу контролю становили 20 осіб віком від 20 до 25 років.
Критеріями включення хворих у дослідження були: діагноз первинний «гіпотиреоз», післяопераційний гіпотиреоз, гіпотиреоз на тлі автоімунного тиреоїдиту, ІХС: стабільні форми стенокардії напруження ФК І–ІІІ, кардіосклероз атеросклеротичний та післяінфарктний, а також поєднана патологія, відсутність декомпенсованих хронічних ускладнень і супутніх захворювань.
Діагноз захворювання було верифіковано на підставі клінічних проявів захворювання, даних загальноклінічних, біохімічних, інструментальних методів дослідження.
Тиреотропний гормон (ТТГ) і гормони ЩЗ (вільний трийодтиронін, вільний тироксин), антитіла до тиреоїдної пероксидази (АТ-ТПО) визначали імуноферментним методом (набір фірми «Хема-Медика», Росія).
Концентрацію інтерлейкіну-1β, інтерлейкіну-8 визначали методом імуноферментного аналізу в сироватці крові (АТ «Вектор-Бест», Росія).
Ехокардіографічне дослідження проводили на ультразвуковому діагностичному сканері Vivid S60N виробника GE Wingmed (Норвегія) за стандартною методикою, керуючись рекомендаціями Американського та Європейського товариства ехокардіографії.
Отримані дані оброблено методом варіаційної статистики з використанням програми Microsoft Excel, Statistica 10.0 for Windows. Різницю вважали вірогідною при р < 0,05.
Результати
Група хворих на гіпотиреоз характеризується вірогідним підвищенням рівня ТТГ 10,6 (2,0; 28,9) мМО/л (р < 0,05), що свідчить про зниження функції ЩЗ порівняно з групою здорових осіб. Дана тенденція відзначається і в групі хворих на гіпотиреоз в поєднанні з ІХС: ТТГ — 5,3 (1,9; 19,3) мМО/л (р < 0,05). Оцінюючи функцію ЩЗ у хворих на ІХС при порівнянні з групою здорових осіб, вірогідних відмінностей між показниками не виявлено: вільний трийодтиронін (вТ3) — 4,19 ± 0,91 пмоль/л, вільний тироксин (вТ4) — 16,18 ± 2,31 пмоль/л, ТТГ — 2,06 (1,47; 2,6) мМО/л, що характеризують збережену функцію ЩЗ.
За даними ЕхоКГ, у хворих на гіпотиреоз відзначається потовщення стінок міокарда лівого шлуночка, на що вказує вірогідне підвищення показників розмірів міжшлуночкової перегородки (МШП) — 10,30 ± 0,82 мм (р < 0,05) та задньої стінки лівого шлуночка (ЗСЛШ) — 10,27 ± 0,82 (р < 0,05). До того ж на гіпертрофію лівого шлуночка вказує підвищення показника маси міокарда лівого шлуночка (ММ ЛШ) 198,91 ± 10,42 г (р < 0,05), індексу маси міокарда лівого шлуночка (ІММ ЛШ) 104,04 ± 10,89 г/м2 (р < 0,05) та відносної товщини стінки (ВТС) ЛШ 0,41 ± 0,05 см (р < 0,05), порівнюючи з групою здорових осіб. Дані зміни характеризують прогресування процесів гіпертрофії міокарда лівого шлуночка та зміни геометрії серця у хворих на гіпотиреоз, при цьому відмічалось вірогідне зниження фракції викиду (ФВ) до 53,44 ± 1,94 (р < 0,05) порівняно з групою контролю, що вказує на порушення центральної гемодинаміки при зниженні функції ЩЗ.
Діагностичний критерій гіпертрофії міокарда ЛШ: значення ІММ ЛШ — понад 115 г/м2 у чоловіків та 95 г/м2 — у жінок [11].
У хворих на ІХС розміри МШП становлять 11,67 ± 0,75 мм (р < 0,05) та ЗС ЛШ — 11,47 ± 0,71 (р < 0,05), що вірогідно перевищує відповідні показники в групі контролю. Більш виражені прояви ремоделювання лівого шлуночка в ІІ групі характеризувались збільшенням показників: ММ ЛШ — 244,68 ± 7,82 г (р < 0,05), ІММ ЛШ — 128,25 ± 5,19 г/м2 (р < 0,05), ВТС ЛШ — 0,47 ± 0,05 см (р < 0,05). ФВ у даної групи хворих становила 53,88 ± 1,61 % (р < 0,05).
За умов коморбідності ІІІ група хворих характеризувалась знову ж таки ознаками гіпертрофії міокарда ЛШ (МШП — 11,20 ± 0,73 мм (р < 0,05), ЗС ЛШ — 10,90 ± 0,78 мм (р < 0,05), ММЛШ — 234,06 ± 6,93 г (р < 0,05), ІММ ЛШ — 120,4 ± 5,0 г/м2 (р < 0,05), ВТС ЛШ — 0,42 ± 0,07 см (р < 0,05)), порівнюючи з контрольною групою, проте показник ФВ, що становить 49,9 ± 2,1 % (р < 0,05), вірогідно знижений порівняно з І та ІІ групами (табл. 1).
Оцінюючи значення ІММЛШ і ВТС за A. Ganau [12], виділили такі типи ремоделювання ЛШ:
— нормальну геометрію ЛШ — ІММ ЛШ у ме–жах норми і ВТС менше 0,45;
— концентричне ремоделювання ЛШ — ІММ ЛШ у межах норми і ВТС понад 0,45;
— концентричну гіпертрофію ЛШ — ІММ ЛШ більший від норми і ВТС понад 0,45;
— ексцентричну гіпертрофію ЛШ— ІММ ЛШ більше норми і ВТС менше 0,45.
Аналізуючи типи ремоделювання ЛШ у пацієнтів із гіпотиреозом, встановили: у 38 осіб (46,92 %) — нормальну геометрію серця, у 31 особи (38,27 %) — ексцентричну гіпертрофію, в 11 осіб (13,58 %) — концентричну гіпертрофію і в 1 особи (1,23 %) — концентричне ремоделювання (рис. 2).
У хворих на ІХС: у 13 осіб (19,4 %) — нормальну геометрію серця, у 13 осіб (19,4 %) — ексцентричну гіпертрофію, у 38 осіб (56,7 %) — концентричну гіпертрофію і в трьох осіб (4,5 %) — концентричне ремоделювання (рис. 3).
У ІІІ групі: у 6 осіб (10,7 %) — нормальну геометрію серця, у 30 осіб (63,8 %) — ексцентричну гіпертрофію, у 10 осіб (21,3 %) — концентричну гіпертрофію і у двох осіб (4,2 %) — концентричне ремоделювання (рис. 4).
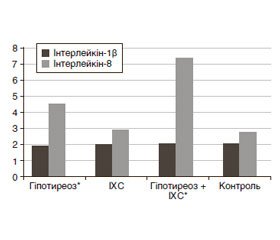
Оцінюючи показники прозапальних цитокінів (IЛ-1β та IЛ-8) в обстежуваних хворих порівняно з групою здорових осіб, не виявили вірогідної різниці між даними групами за показником IЛ-1β. Однак, порівнюючи значення IЛ-8, відзначили вірогідне збільшення даного показника в групі хворих на гіпотиреоз — 4,78 ± 1,63 пг/мл (р < 0,01) та за умов коморбідності — 7,66 ± 1,63 пг/мл (р < 0,01) порівняно з групою здорових осіб — 3,02 ± 2,6 пг/мл. У групі хворих на гіпотиреоз в поєднанні з ІХС виявлено прямий кореляційний зв’язок середньої сили між рівнем IЛ-8 та ФВ (r = 0,38).
Обговорення
Ураховуючи отримані дані, виявили, що гіпертрофія міокарда розвивається у всіх групах хворих, обумовлюючи розвиток змін геометрії серця. Для хворих на гіпотиреоз характерне ремоделювання міо–карда ЛШ у бік розвитку ексцентричної гіпертрофії, що можна вважати маркером гіпотиреоїдного серця, вираженість якого може визначати ступінь тяжкості гіпотиреозу. У хворих на ІХС відзначається переважання концентричної гіпертрофії міокарда ЛШ. У ІІІ групі хворих спостерігається зміна геометрії серця в бік розвитку ексцентричної гіпертрофії міокарда, що супроводжується вірогідним зниженням ФВ із наростанням систолічної дисфункції ЛШ. Також виявлений прямий зв’язок зниження ФВ із підвищенням рівня IЛ-8 свідчить, що персистування прозапального стану у хворих на гіпотиреоз в поєднанні з ІХС є негативним прогностичним фактором.
Отримані дані збігаються з результатами інших авторів, які довели, що ІХС на тлі гіпотиреозу характеризується розвитком порушення систолічної та діастолічної функції серця, тяжкість якої прогресує зі збільшенням функціональної недостатності ЩЗ [13, 14]. Характерними ЕхоКГ-ознаками є потовщення стінок і збільшення маси міокарда, вираженість яких пов’язана з тяжкістю тиреоїдної дисфункції [14–16]. Процеси ремоделювання серця у хворих на ІХС із гіпотиреозом пов’язані з переважанням розвитку концентричної гіпертрофії та збільшенням кількості хворих з ексцентричною гіпертрофією ЛШ [17].
Висновки
1. Зниження функції щитоподібної залози призводить до розвитку гіпертрофії міокарда ЛШ з подальшою зміною геометрії серця в бік розвитку ексцентричного ремоделювання.
2. Гіпотиреоз характеризується порушенням центральної гемодинаміки, прояви систолічної дисфункції серця наростають за умов поєднання тиреоїдної патології та ІХС.
3. Активація хронічного системного запалення більш виражена в умовах коморбідності з негативним прогностичним впливом на стан серцево-судинної системи.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
- Mitchenko OI, Logvinenko AO, Romanov VYu. The optimisation of lipid and carbohydrate exchange correction in patients with metabolic syndrome and thyroid dysfunction. Ukrainian Journal of Cardiology. 2010;(1):73-80. (in Ukrainian).
- Gallo D, Piantanida E, Pariani N, et al. P134 Masked hypertension in a cohort of newly diagnosed hypothyroid patients. In: 38th Annual Meeting of the European Thyroid Association. Eur Thyroid J. 2014;3(Suppl 1):73-226. doi: 10.1159/000365244.
- Chcl KI, Kim BH. P132 The impact of subclinical thyroid dysfunction on coronary vasospasm in patients without associated cardiovascular risk factors. In: 38th Annual Meeting of the European Thyroid Association. Eur Thyroid J. 2014;3(Suppl 1):73-226. doi: 10.1159/000365244.
- Blankova ZN, Ageev FT, Seredenina EM, Riabtseva OIu, Svirida ON, Irtuganov NSh. Hypothyroidism and cardiovascular diseases. RMJ. 2014;22(13):980-987. (in Russian).
- Starkova NT, Kandror VI, Babichev VN, et al., authors; Starkova NT, editor. Klinicheskaia endokrinologiia: rukovodstvo [Clinical endocrinology: a guide]. 3rd ed. SPb: Piter; 2002. 576 p. (in Russian).
- Hak AE, Pols HA, Visser TJ , Drexhage HA, Hofman A, Witteman JC. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam study. Ann Intern Med. 2000 Feb 15;132(4):270-8.
- Kvetny J, Heldgaard PE, Bladbjerg EM, Gram J. Sublinical hypothyroidism is associated with a low-grade inflammation, increased triglyceride levels and predicts cardiovascular disease in males bellow 50 years. Clin Endocrinol (Oxf). 2004 Aug;61(2):232-8. doi: 10.1111/j.1365-2265.2004.02088.x.
- Rodondi N, den Elzen WP, Bauer DC, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA. 2010 Sep 22;304(12):1365-74. doi: 10.1001/jama.2010.1361.
- Fes’kova AA, Dobrysheva ES. The value of subclinical hypothyroidism in the pathogenesis of diseases of the cardiovascular system: review of literature. Molodoj uсenyj. 2014;(17):207-210. (in Russian).
- Rodionova TI, Samitin VV. Influence of thyroid hormones on myocardial metabolic processes. Saratov Journal of Medical Scientific Research. 2009;5(1):123-127. (in Russian).
- Mancia G, Fagard R, Narkiewicz K, et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens. 2013 Jul;31(7):1281-357. doi: 10.1097/01.hjh.0000431740.32696.cc.
- Ganau A, Devereux RB, Roman MJ, et al. Patterns of left ventricular hypertrophy in essential hypertension. J Am Coll Cardiol. 1992 Jun;19(7):1550-8.
- Aronov DM, Lupanov VP. Ateroskleroz i koronarnaia bolezn’ serdtsa [Atherosclerosis and coronary heart disease]. Moscow: Triada-Kh; 2009. 248 p. (in Russian).
- Budnevskii AV, Burlachuk VT, Grekova TI. Hypothyroidism and cardiovascular pathology. Meditsinskii nauchnyi i uchebno-metodicheskii zhurnal. 2007;(38):80-85. (in Russian).
- Volkova А, Dora S, Berkovich O, Grineva E, Dygun O. P148 Predictive risk model of severe coronary atherosclerosis in heart ischemic disease patients with subclinical hypothyroidism. In: 38th Annual Meeting of the European Thyroid Association. Eur Thyroid J. 2014;3(Suppl 1):73-226. doi: 10.1159/000365244.
- Fernandez-Real JM, López-Bermejo A, Castro A, Casamitjana R, Ricart W. Thyroid function is intrinsically linked to insulin sensitivity and endothelium-dependent vasodilation in healthy euthyroid subjects. J Clin Endocrinol Metab. 2006 Sep;91(9):3337-43. doi: 10.1210/jc.2006-0841.
- Mykhailovska NS, Oleynik TV. Features of myocardial remodeling in patients with coronary heart disease depending on thyroid function. Pathologia. 2015;(34):17-21. (in Ukrainian).

/129-1.jpg)
/130-1.jpg)
/130-2.jpg)
/131-1.jpg)